本文作者:有机小白
导读
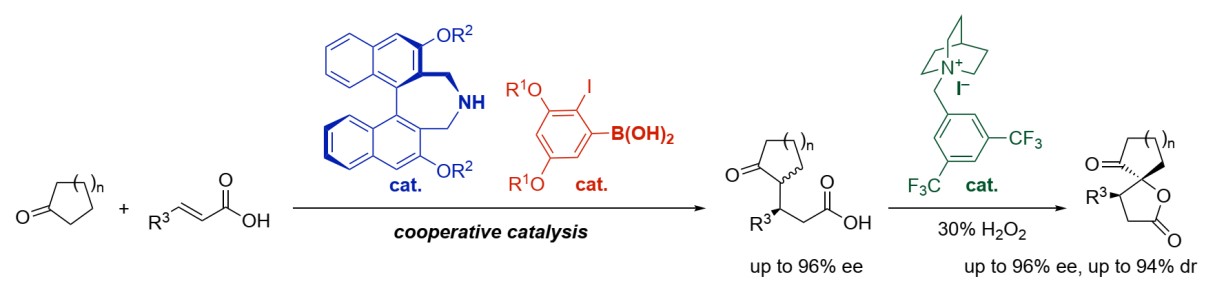
最近,日本名古屋大学Ishihara教授课题组在《德国应用化学》(Angewandte Chemie International Edition)发表文章,报道了通过手性胺与硼酸的协同催化,实现α,β-不饱和羧酸与环烷酮的对映选择性1,4-加成反应。在手性胺与硼酸存在下,环烷酮与羧酸分别被活化为手性烯胺与混合酸酐,并以高产率和高对映选择性得到相应的1,4-加成产物。另外,该产物可以进一步氧内酯化,以高非对映选择性得到螺环内酯衍生物。
Enantioselective 1,4-Addition Reaction of α,β-Unsaturated Carboxylic Acids with Cycloalkanones Using Cooperative Chiral Amine-Boronic Acid Catalysts
Takahiro Horibe, Takashi Hazeyama, Yuto Nakata, Kazuki Takeda, and Kazuaki Ishihara*
Angew. Chem. Int. Ed. 2020, ASAP DOI: 10.1002/anie.202007639
(图片来源:Angew. Chem. Int. Ed.)
正文
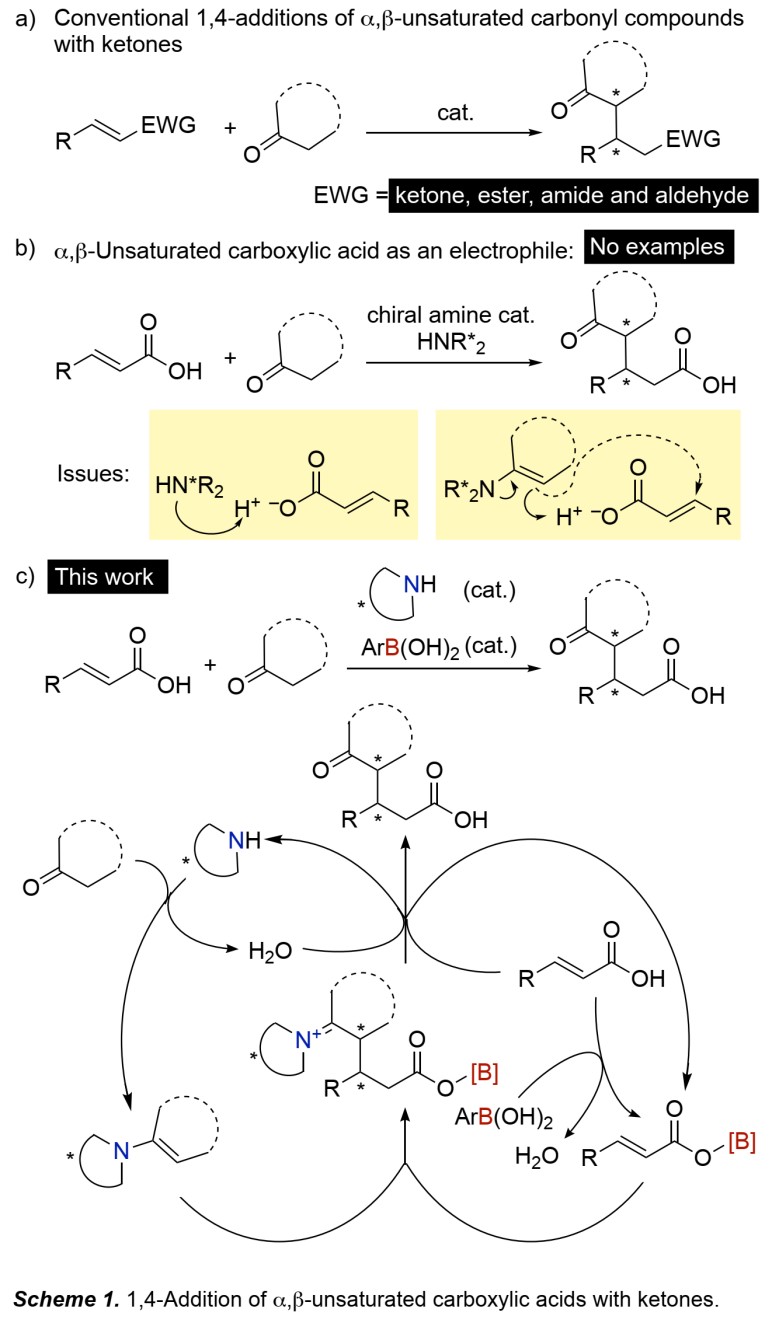
1,5-酮羰基化合物是天然产物和药物分子的重要合成砌块,α,β-不饱和羰基化合物与酮的1,4-加成反应是合成该化合物最直接的方法(Scheme 1a)。迄今为止,化学家们已经研究了各种缺电子烯烃,如α,β-不饱和醛、酮、酯和酰亚胺,其中酮通过烯胺催化模式被活化。相比之下,利用α,β-不饱和羧酸的反应还未有相关研究(Scheme 1b),可能是由于在手性胺催化剂或相应烯胺的存在下,羧酸质子易脱去,产生的羧酸根负离子不再具有吸电子性。对映选择性1,4-加成反应也仅有几例,但受限于相对活泼的亲核试剂(二烯、氧、硫、氮亲核试剂)。而对于α,β-不饱和羧酸的低活性亲核试剂,比如酮,并未有相关的文献报道,可能是因为手性烯胺能够快速捕捉羧酸质子而不会发生共轭加成。
(图片来源:Angew. Chem. Int. Ed.)
自1996年Yamamoto课题组报道了缺电子硼酸作为高效催化剂实现羧酸与胺的脱水缩合以来,许多课题组也报道了一些高效的硼酸催化剂,能通过脱水将羧酸活化为混合酸酐,用作酰基化试剂而非弱亲电性的羧酸。
在此,日本名古屋大学Ishihara教授课题组利用硼酸催化剂形成混合酸酐来活化α,β-不饱和羧酸,手性胺与酮形成手性烯胺,两种催化模式彼此兼容,共同实现了α,β-不饱和羧酸与酮的对映选择性1,4-加成反应(Scheme 1c)。
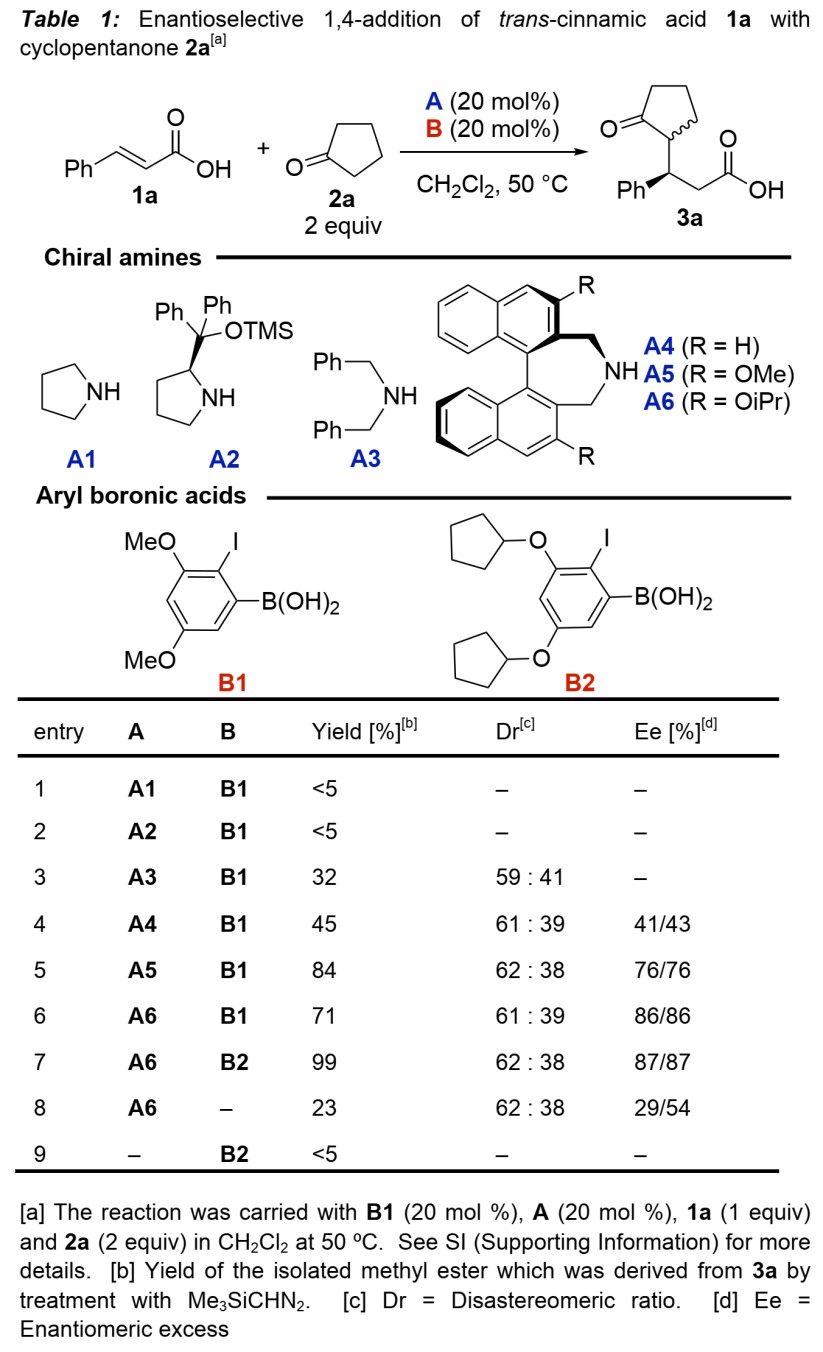
首先,作者使用反式肉桂酸1a与环戊酮2a作为模板底物,进行了反应条件的优化(Table 1)。最终,最优催化剂组合确定为A6与B2(entry 7),以99%收率,62:38 dr和87%/87% ee得到了目标产物3a。
(图片来源:Angew. Chem. Int. Ed.)
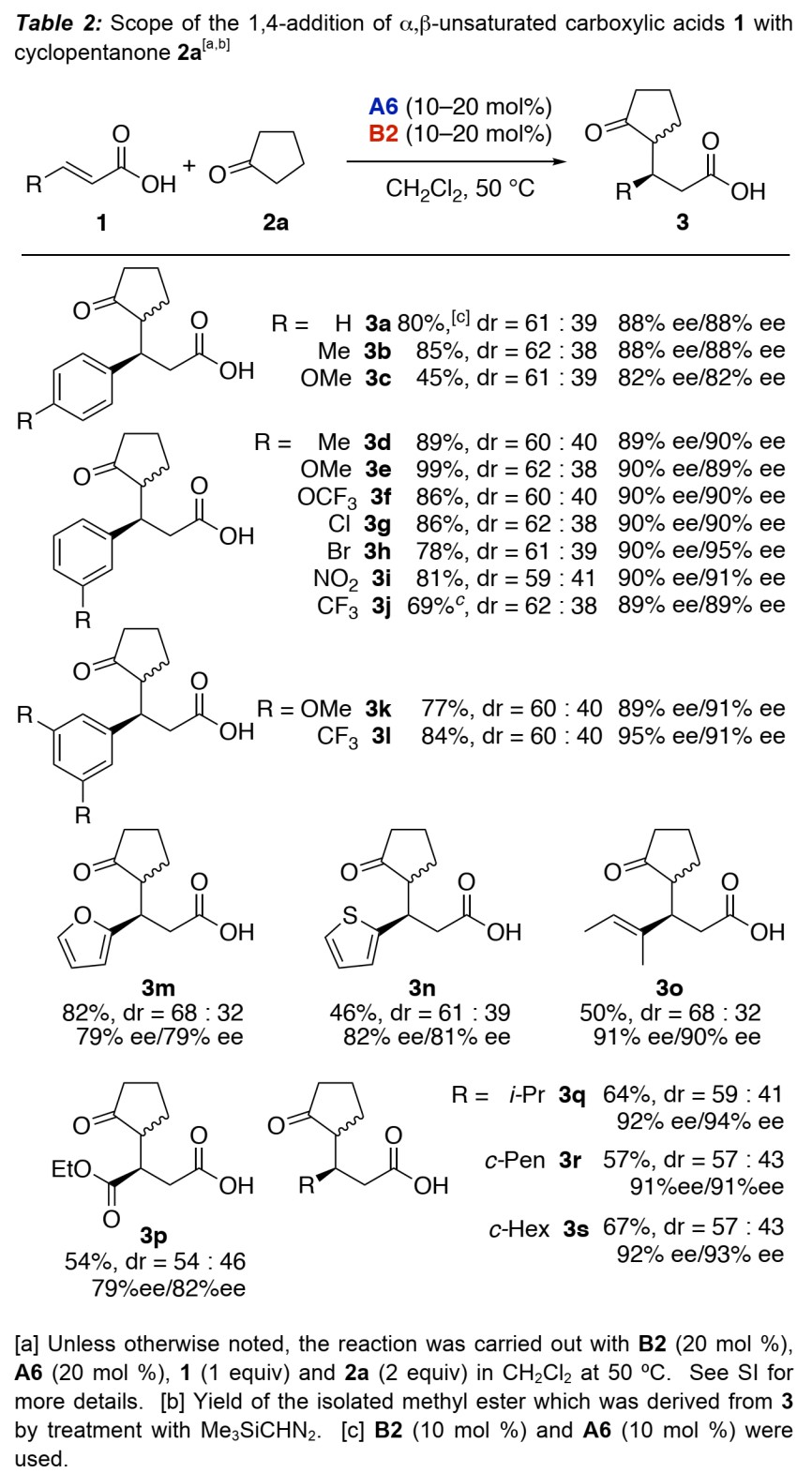
接下来,作者考察了β-取代丙烯酸1的底物范围(Table 2)。当与环戊酮2a反应时,苯环上吸电子基、给电子基以及取代位置均能很好地兼容。杂芳基、烷基取代也同样适用于该反应。值得注意的是,底物1o和1p具有反应位点的选择性。
(图片来源:Angew. Chem. Int. Ed.)
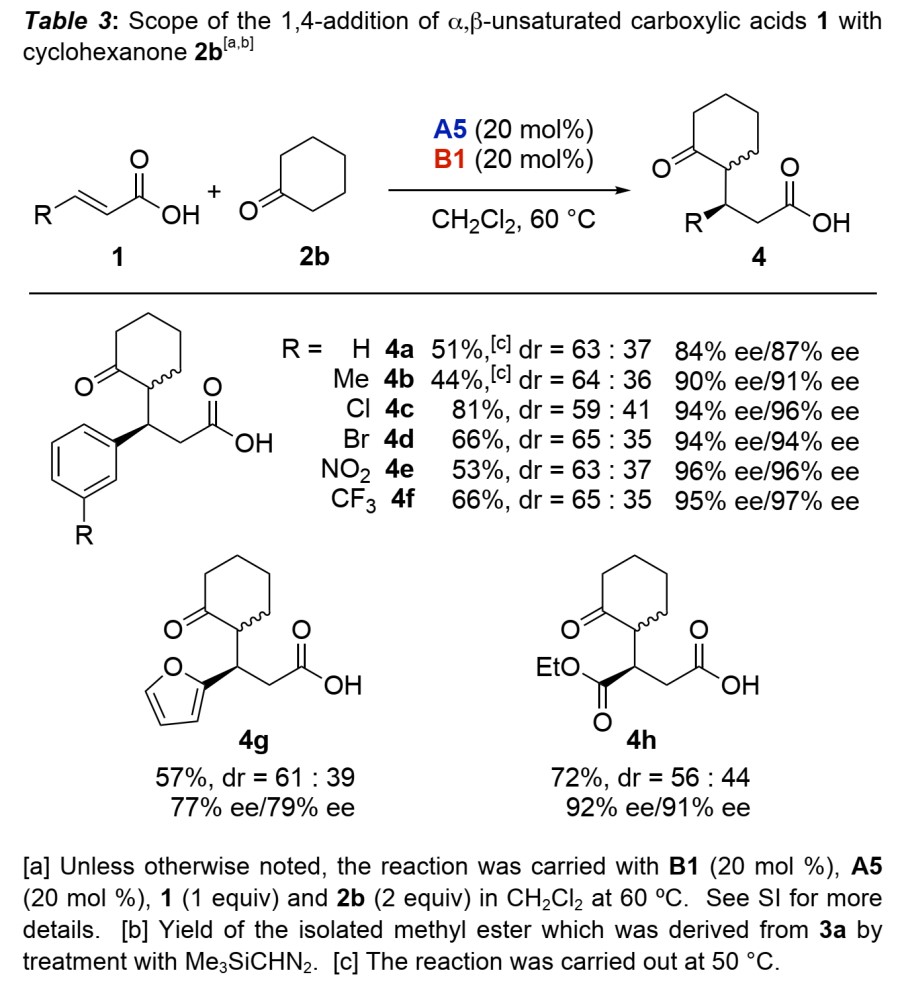
作者又将环戊酮2a换为环己酮2b进行反应(Table 3)。与2a相比,尽管2b反应性降低,但催化剂组合换为A5和B1,温度升至60 °C后,反应仍可顺利进行,以高对映选择性和中等非对映选择性得到了目标产物,而线性的酮(如2-丁酮、2-戊酮)在类似条件下不能发生该反应。
(图片来源:Angew. Chem. Int. Ed.)
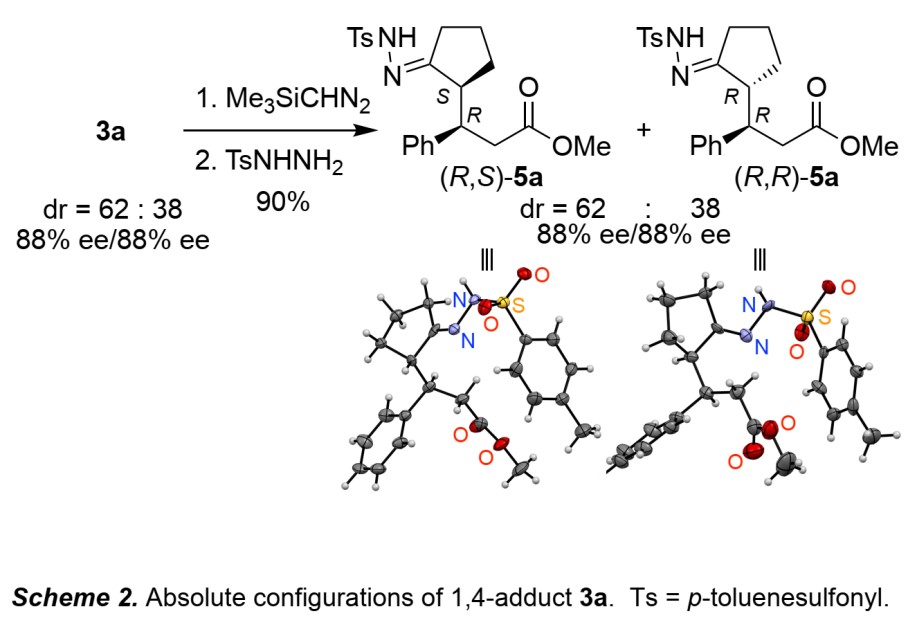
之后,作者将3a衍生为5a,其对映选择性仍保持不变,并对5a进行了单晶分析(Scheme 2)。非对映体(R,S)-5a与(R,R)-5a表明,反应的低对映选择性是由于酮部分发生α-差向异构化所致。
(图片来源:Angew. Chem. Int. Ed.)
作者认为通过烯胺催化的非对映选择性质子化反应能够提高3a的dr值。实验发现,化学计量的L-脯氨醇衍生物6能高效地将dr值提高到87:13(Scheme 3)。但是当无6存在时,室温下其dr值会逐渐降低,可能是自身差向异构化导致。
(图片来源:Angew. Chem. Int. Ed.)
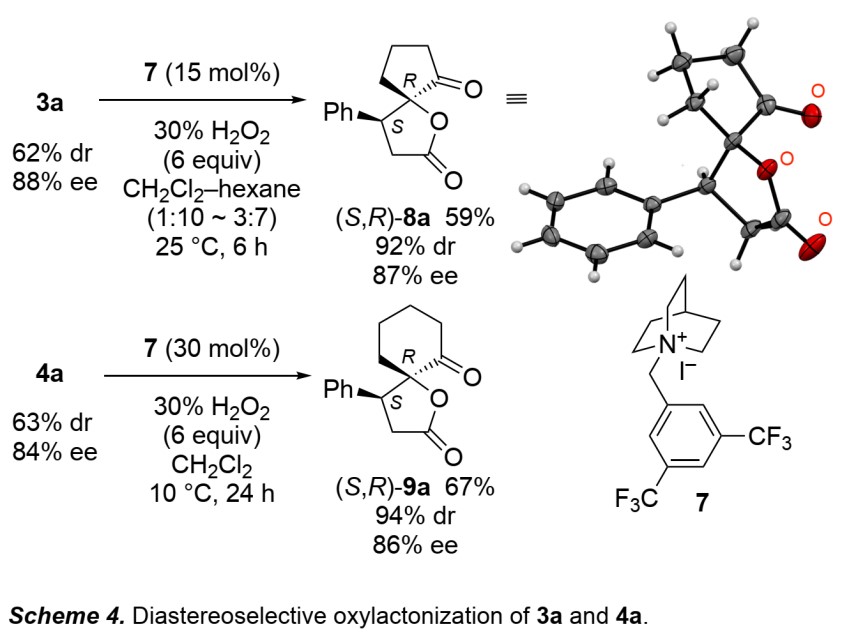
之后,作者利用高价碘催化,成功实现了1,4-加成产物3a和4a的高非对映选择性氧内酯化(Scheme 4)。
(图片来源:Angew. Chem. Int. Ed.)
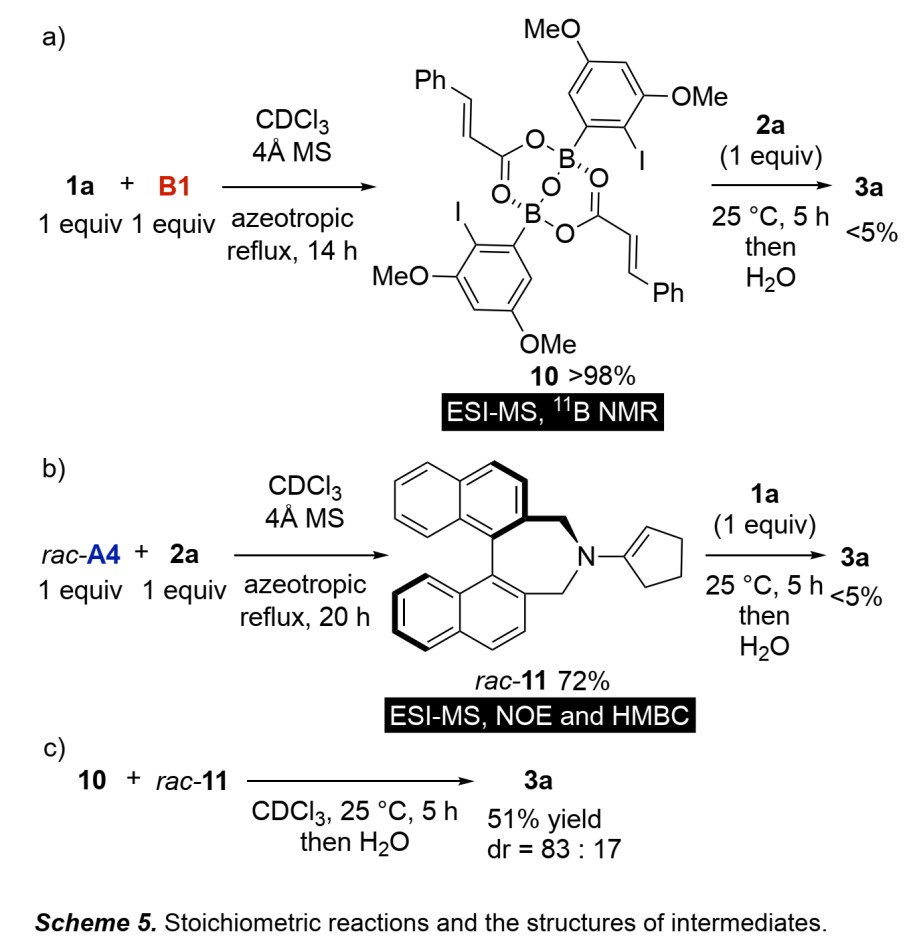
接下来,作者进行了反应机理的研究。B1与1a反应,分离出中间体10(Scheme 5a);rac–A4与2a反应,分离出中间体rac–11(Scheme 5b);这两种活性中间体在25 °C反应,以51% 收率和83:17 dr得到了3a(Scheme 5c)。如果用非活化的2a或1a分别与活性中间体10或11反应,则无法得到3a。以上结果充分说明了两个底物必须分别被两种催化剂同时活化才可以进行1,4-加成反应。
(图片来源:Angew. Chem. Int. Ed.)
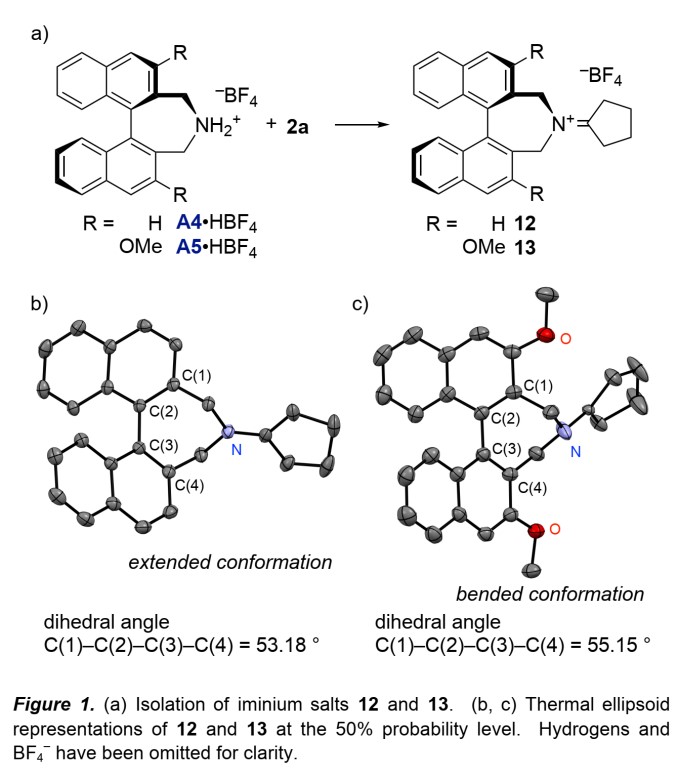
作者对A4·HBF4和A5·HBF4与2a反应的产物12和13进行了单晶分析(Figure 1),结果表明,13的联萘二面角(55.15°)大于12(53.18°),加之13具有立体位阻的3,3’-烷氧基,使环戊烯部分周围的手性口袋变得狭窄,从而提高了对映选择性。
(图片来源:Angew. Chem. Int. Ed.)
总结
日本名古屋大学Ishihara教授课题组首次利用手性胺与硼酸协同催化实现了α,β-不饱和羧酸与环烷酮的对映选择性1,4-加成反应。环烷酮与羧酸分别被活化为手性烯胺与混合酸酐,并以高产率和高对映选择性得到了相应的1,4-加成产物。随后该产物进行氧内酯化,以高非对映选择性得到了相应的螺环内酯,该结构广泛存在于药物分子中。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.