本文作者:杉杉
导读
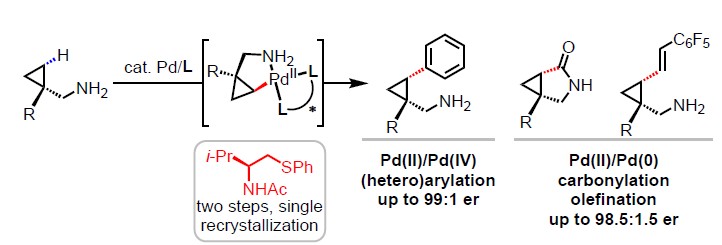
底物导向的不对称反应,因能够从廉价易得的起始原料中精确构筑立体中心而倍受赞誉,其被广泛用于现代有机合成中。过去十年里,化学家开创了导向基团实现惰性烃的对映选择性C(sp3)-H官能化反应的新途径,使得简单的化学分子变得复杂。迄今为止,由于化学分子的复杂性,使得这种方法并未成功。尽管游离的脂肪族伯胺是有机合成中通用的中间体,但在传统的C(sp3)-H活化反应中均不反应,而且在钯催化的碳氢活化反应中伯胺往往会导致催化剂失活。因此,如何在不适用保护基团的前提下,实现这类底物的不对称碳氢键活化仍是摆在科学家面前的难题。近日,美国Scripps研究所余金权教授课题组在美国化学学会杂志上(Journal of the American Chemical Society)发表论文,通过使用手性双齿二硫代醚配体,实现了Pd催化游离脂肪族伯胺(环丙基甲基胺)的对映选择性C(sp3)-H官能化。该配体特有的双齿配位模式和硫醚基团,有助于生成关键的单(胺)-Pd(II)中间体,从而实现了对游离胺的对映选择性C-H键活化。此外,生成的C-Pd(II)配合物可参与Pd(II)/Pd(IV)或Pd(II)/Pd(0)催化循环,并通过(杂)芳基化、羰基化和烯化反应,从而获得相应的产物。该法多样的反应性为药物化学家提供了一种快速制备功能化生物相关胺的通用策略。
Pd(II)-Catalyzed Enantioselective γ-C(sp3)−H Functionalizations of Free Cyclopropylmethylamines
Zhe Zhuang, and Jin-Quan Yu*
J. Am. Chem. Soc. ASAP DOI:10.1021/jacs.0c04801
正文
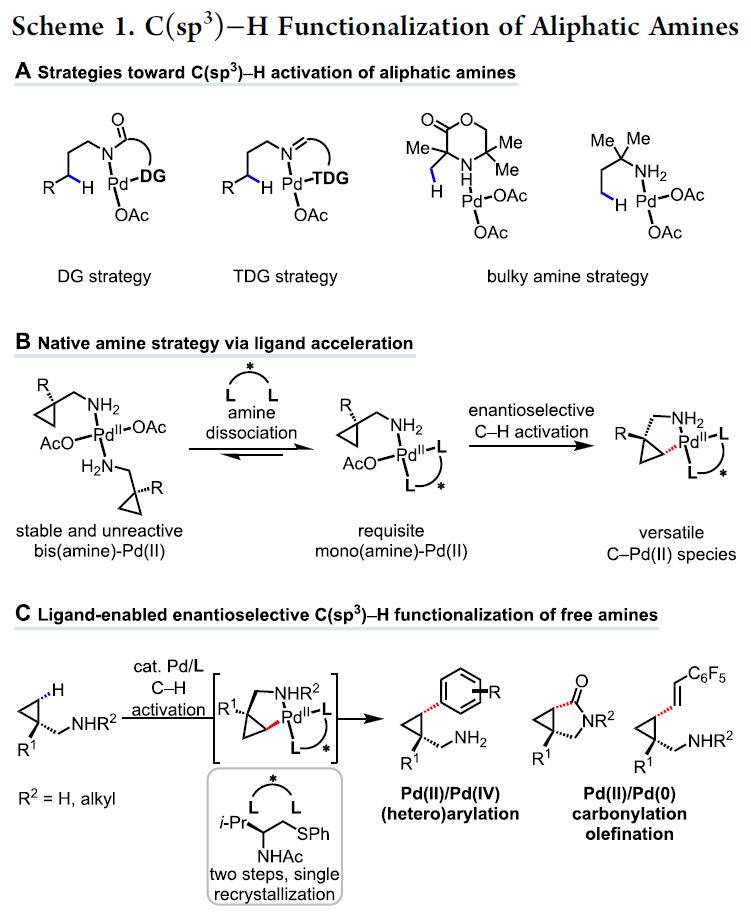
由先天性官能团(如羧酸、胺和醇)和配体同时控制的对映选择性反应,作为有机反应中区域和立体化学反应的典型,如Sharpless环氧化,Noyori和Knowles不对称氢化。尽管该策略在不饱和化学键上的官能化反应中已取得重大进步,但对于饱和烷烃的官能化反应却被忽视。通过弱配位的游离羧酸指导C-H官能化已取得一定的进展,但带有游离氨基的脂肪胺(药学、农业化学等中普遍存在的结构单元)却不太适合Pd催化的C-H官能化反应,通常导致催化剂失活。首先,由于反位效应易形成稳定但无反应的双(胺)-Pd(II)配合物。其次,脂肪伯胺易被氧化降解。同时,脂肪伯胺具有一定的亲核性,从而易与亲电试剂发生N-取代反应。在这种情况下,为了加速环金属化和抑制β-氢化物消除,需引入瞬态或双齿导向基团(DGs)(Scheme 1A)。尽管DG或TDG策略都很精致,但由于双齿导向基团极强的配位能力导致手性配体无可用的配位点,很难实现对映选择性。同时,由于缺乏空的配位点,导致该反应主要集中于Pd(II)/Pd(IV)催化循环中,对于Pd(II)/Pd(0)的循环却很少被报道。对底物DG的要求排除了使用天然氨基来指导C-H活化的可能性,这在无保护基合成的情况下提供了优异的原子和步长经济性。据报道,游离的脂肪胺直接进行C-H官能化反应主要限于体积较大的胺,需要在游离胺的α位置形成一个庞大的基团,以促进双(胺)-Pd(II)配合物通过空间排斥而解离,从而阻止氧化降解以及削弱氨基的亲核性(Scheme 1A)。
基于对单齿DGs和双齿配体的结合来实现对映选择性C-H活化反应的持续研究,作者试图将更具有挑战性的化学原料(如脂肪族伯胺)应用到此体系中(Scheme 1B)。为了解离稳定的双(胺)-Pd(II)配合物,需加入额外的配体以促进生成具有反应性的单(胺)-Pd(II)中间体。因此,该配体的设计对于反应至关重要。此外,配体上的酰胺基团(N-酰基)不仅作为内部碱(通过消除β-氢化物来促进C(sp3)-H活化),同时它也足够不稳定(可为Pd(II)/Pd(0)催化循环中生成一个空位的配位点)。在本文中,作者报道了基于硫醚的手性双齿配体的设计,该配体能够实现Pd(II)催化的脂肪族环丙基甲伯胺的对映选择性C-H功能化反应(Scheme 1C)。通过Pd(II)/Pd(IV)催化循环进行丙烯酸化反应,得到γ-取代芳基产物,包括氮杂环的手性游离脂肪胺等。同时,该催化剂能够通过Pd(II)/Pd(0)催化循环使伯(仲)游离胺进行烯化和羰基化反应,分别获得具有价值的γ-烯化游离胺和γ-内酰胺衍生物。
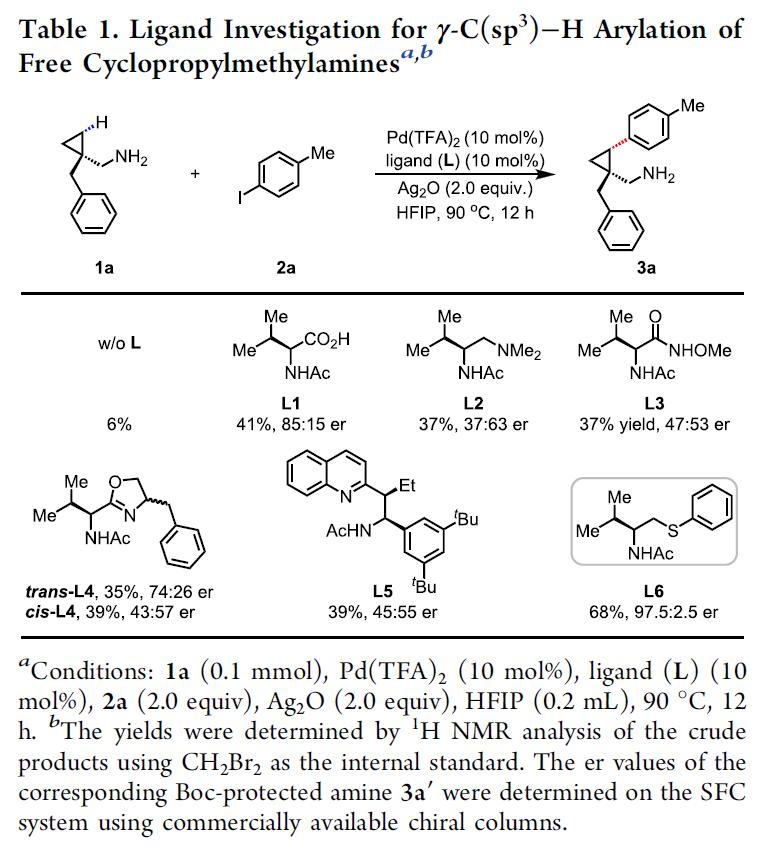
随后,作者以游离的环丙基甲胺1a和4-碘甲苯2a作为模型底物,对配体进行了相关的筛选(Table 1)。当加入一系列前期发展的手性双齿配体时,这些配体均能促进碳氢活化反应,并能观测到一定的手性诱导。为了进一步优化反应,作者将注意力转向使用硫醚作为软σ给体,认为硫醚可以促进双(胺)-Pd(II)配合物的离解,并通过它们的强配位稳定Pd催化剂,随后生成单(胺)-Pd(II)中间体。通过对硫醚配体主链的系统修饰,作者发现双齿硫配体L6,可获得68%收率和er为97.5:2.5的目标产物3a。(配体L6可从市售Evans恶唑烷酮手性剂经两步合成,重结晶后收率为92%。)
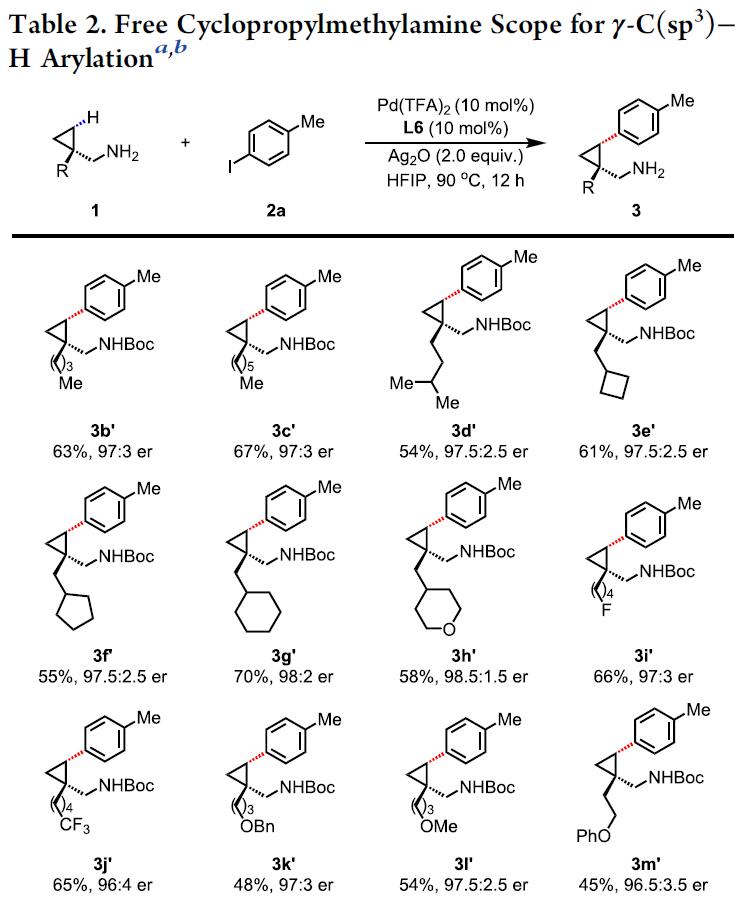
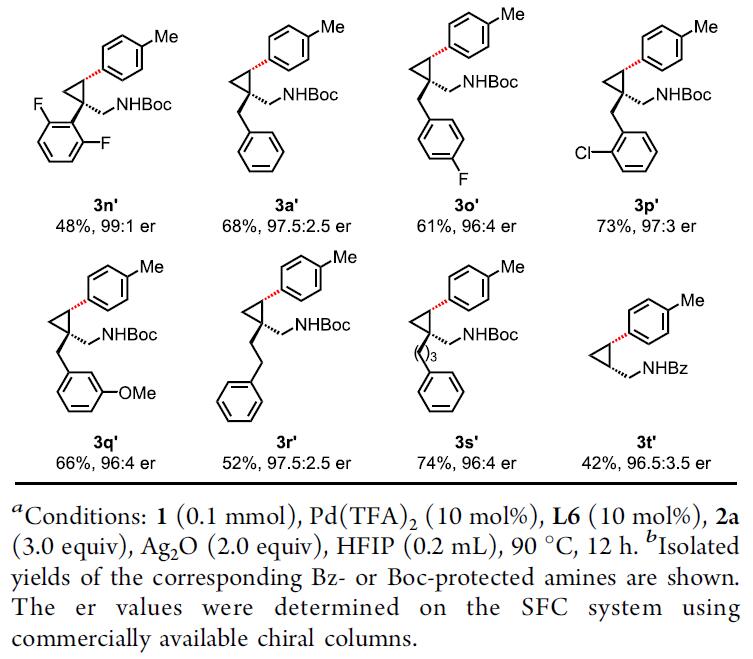
在获得上述最佳反应条件后,作者开始对脂肪胺底物1进行了扩展(Table 2)。为了方便纯化和分析,γ-芳基化产物中的氨基均以叔丁氧羰基(Boc)或苯甲酰基(Bz)保护。在β-位带有各种链状脂肪族烷烃,甚至环丁烷、环戊烷、环己烷等,均与体系兼容,从而获得相应的芳基化产物3b’–3g’。同时,具有氟、三氟甲基、四氢吡喃、苄基(Bn)保护的羟基、甲氧基和酚醚等基团,也可获得相应的产物3h’–3m’。此外,含有吸电子或给电子基团的苯基,反应也不受影响,从而获得产物3a’和3n’–3s’。对于反应性较低的未取代环丙基甲胺,也可合成相应的产物3t’。但是,对于环丁基甲胺底物,不适用于该体系。
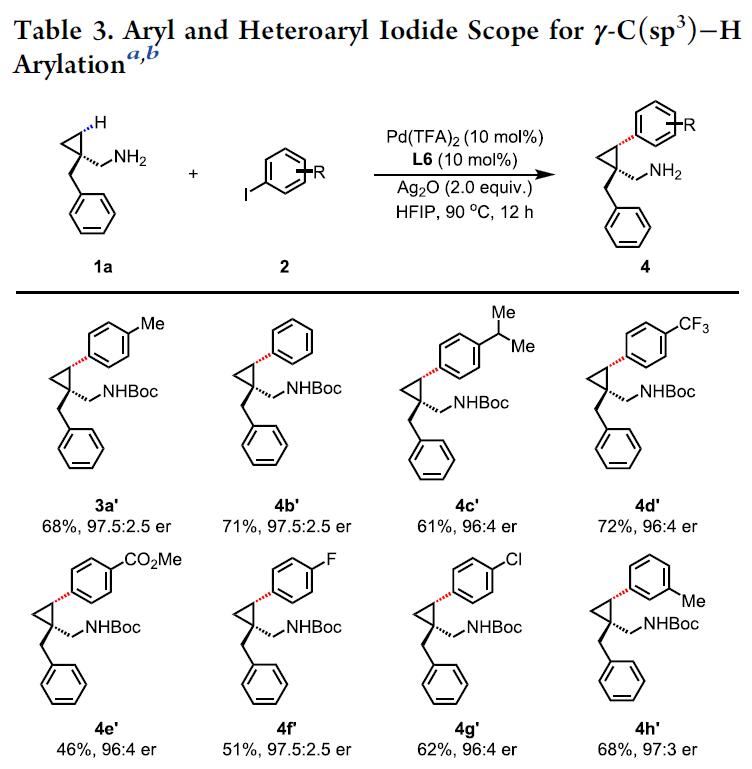
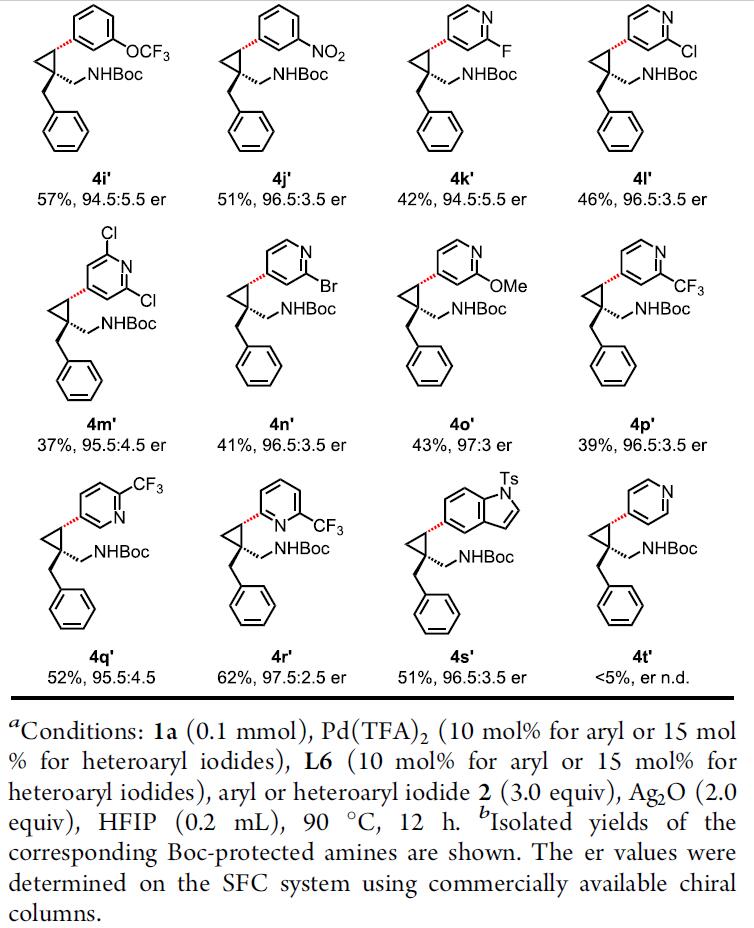
随后,作者对杂芳基碘的底物2范围进行了相关的扩展(Table 3)。带有给电子基团和吸电子基团的碘代苯底物,均与体系兼容,从而获得相应的产物4b’–4j’。值得注意的是,具有一些活性的基团(如酯、卤素等),可为后期修饰提供多种可能。同时,对于杂环底物(吡啶、吲哚),也同样具有良好的兼容性,从而获得相应的产物4k’-4t’。值得注意的是,由于硫配体与催化剂的强配位性,抑制了吡啶与钯的配位,从而使低活性的吡啶底物也适用于该体系。
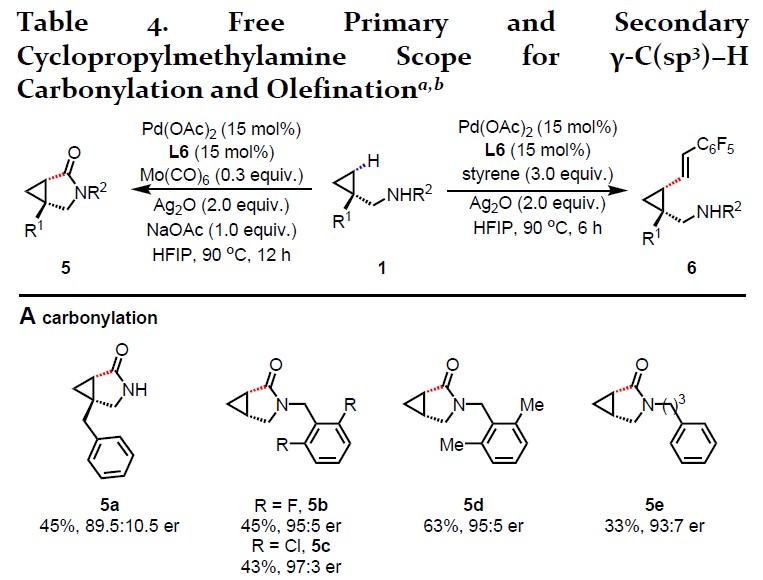
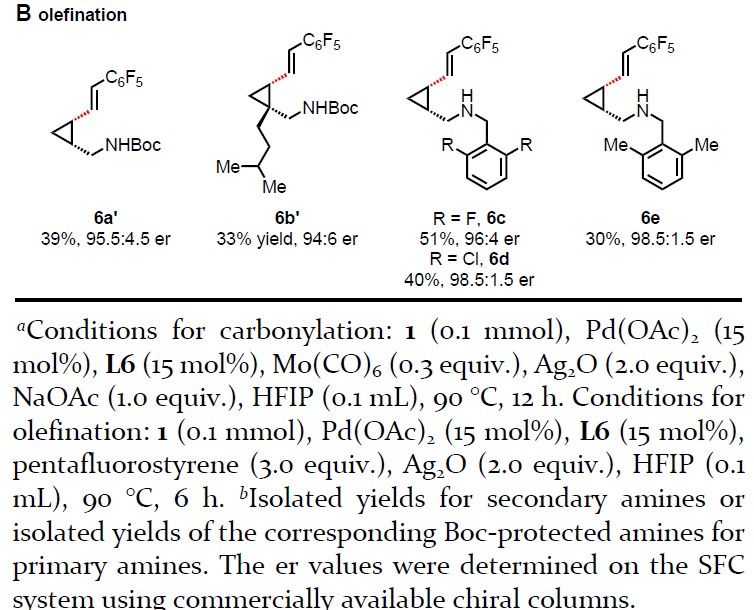
紧接着,作者对游离脂肪伯(仲)胺进行了不对称羰基化和烯化反应的研究(Table 4)。当使用Mo(CO)6(非危险性和空气中稳定)作为CO源时,可合成双环γ-内酰胺5a–5e。而使用五氟苯乙烯时,可顺利进行烯化反应,从而获得所需的γ-烯烃脂肪胺产物6a–6e。在目前的条件下,其他烯烃如丙烯酸酯和苯乙烯都不能得到理想的烯烃产物。
总结
余金权教授通过双齿手性硫醚配体设计和调控,在未使用导向基团的条件下,实现了的游离脂肪伯胺的对映选择性C(sp3)-H官能化反应。同时,Pd(II)/Pd(IV)和Pd(II)/Pd(0)催化循环均与此手性配体相兼容,从而实现了(杂)芳基化、羰基化和烯化反应。此外,无需引入导向基团即可实现了各种手性γ-(杂)芳基、γ-烯烃和γ-内酰胺等衍生物的高效合成,并为脂肪族伯胺的碳氢活化提供了新型策略。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.