概要
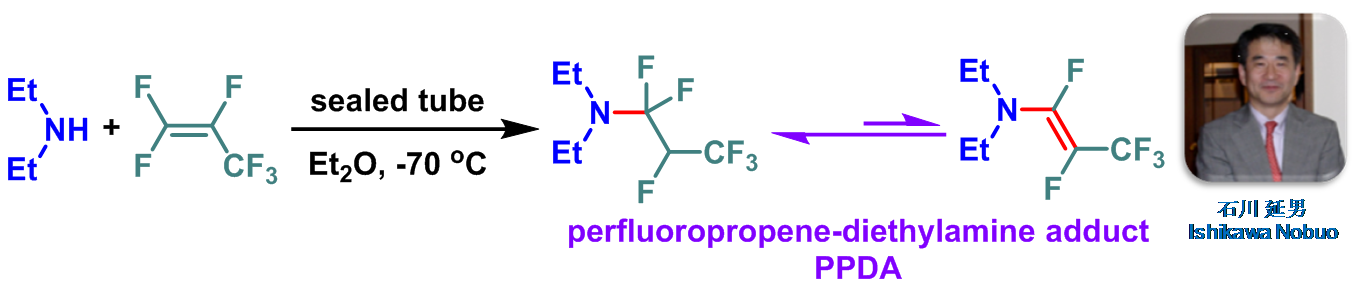
1979年,日本东京工业大学化工系 (東京工業大学化工学部, Department of chemical technology, Tokyo institute of technology)的石川延男 (石川 延男, Ishikawa Nobuo)研究室通过全氟丙烯与二乙胺反应,成功合成出新的氟化试剂全氟丙烯-二乙胺加合物(perfluoropropene-diethylamine adduct, PPDA,PPDA为N,N-二乙基-(1,1,2,3,3,3-六氟丙基)胺与(E)-氟乙胺的平衡混合物,二者平衡比为3:1) [1],并将其成功应用于各类醇(一级醇、二级醇及三级醇) [1]-[10]与羧酸[1], [11]的去氧氟化 (deoxyfluorination)。PPDA试剂与其它氟代二烷基氨基试剂 (fluoroalkyl amino reagent, FAR)相比,更易制备,并且稳定性更高[2]。同时,反应条件温和,具有优良的产率及官能团兼容性。文献中将PPDA试剂称为Ishikawa试剂 (Ishikawa reagent)。目前,该试剂已经广泛应用于各类有机氟化合物的构建[2]-[11]。 然而,该试剂的主要缺点是去氧氟化过程中伴随醚及酰胺等副产物的生成,并且该试剂不适用于烯丙醇与炔丙醇底物的去氧氟化[12]-[13]。
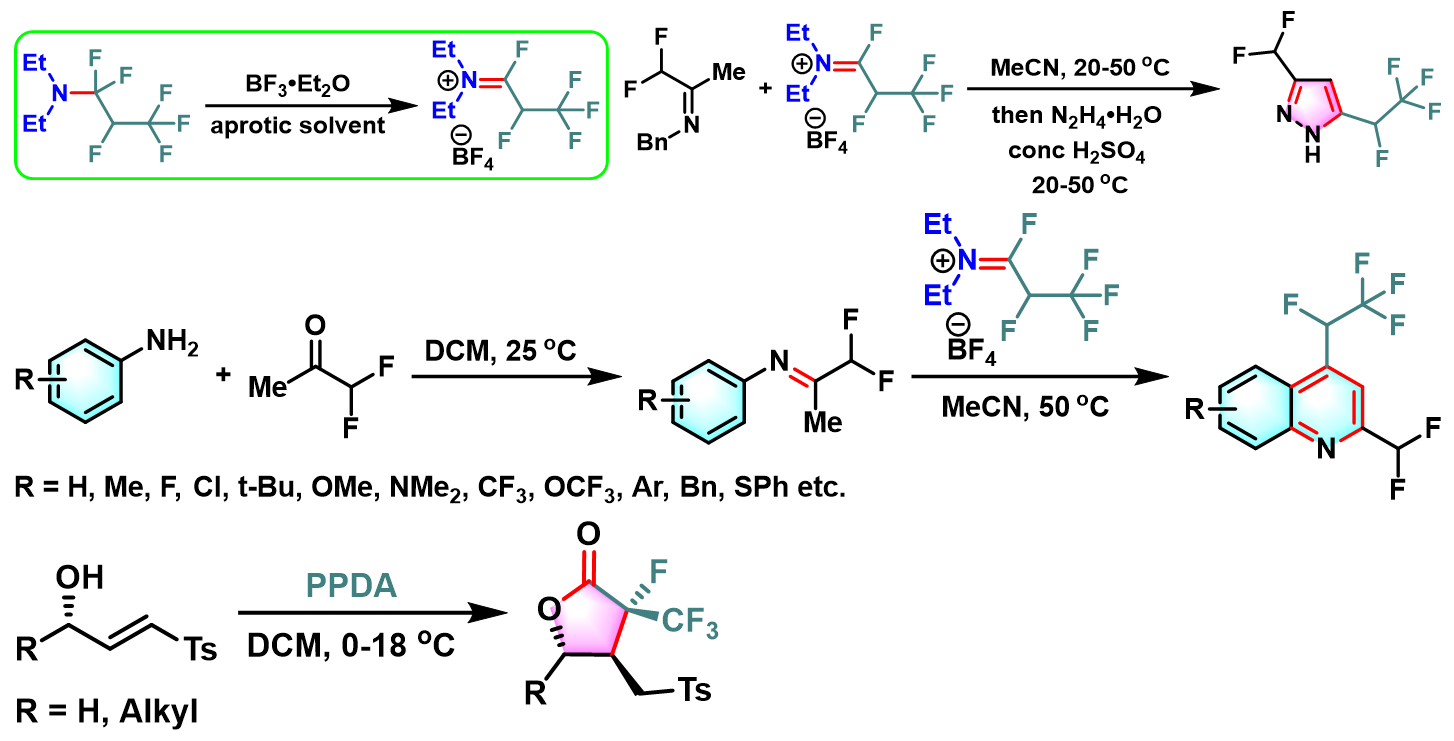
除上述的去氧氟化过程之外,近期的研究发现,Ishikawa试剂同样可以应用于各类含氟取代基的杂环化合物的构建[14]-[19]。
基本文献
- [1] N. Ishikawa, Bull. Chem. Soc. Jpn. 1979 , 52, 3377. doi: 10.1246/bcsj.52.3377.
- [2] N. Al-Maharik, D. O´ Hagan, Aldrichim. Acta. 2011, 44, 65. doi: https://chem.utah.edu/_documents/etc/medialib/docs/aldrich/acta/1/al_acta_v44n3-par-0001-file-tmp/al_acta_v44n3.pdf.
- [3] D. O’Hagan, J. Fluorine Chem. 1989, 43, 371. doi: 10.1016/S0022-1139(00)82723-2.
- [4] S. Watanabe, T. Fujita, Y. Usui, T. Kitazume, J. Fluorine Chem. 1986, 31, 247. doi: 10.1016/S0022-1139(00)81428-1.
- [5] S. Watanabe, T. Fujita, M. Sakamoto, T. Kuramochi, T. Kitazume, J. Fluorine Chem. 1987, 36, 361. doi: 10.1016/S0022-1139(00)82078-3.
- [6] S. Watanabe, T. Fujita, M. Sakamoto, H. Endo, T. Kitazume, J. Fluorine Chem. 1990, 47, 187. doi: 10.1016/S0022-1139(00)82371-4.
- [7] Z. H. Wang, C. Zheng, F. Li, L. Zhao, F. Chen, Q. He, Synthesis 2012, 44, 699. doi: 10.1055/s-0031-1289706.
- [8] G. L. Cantrell, R. F. Filler, J. Fluorine Chem.1985, 27, 35. doi:
- 10.1016/S0022-1139(00)80895-7.
- [9] I. I. Gerus, R.V. Mironets, E. N. Shaitanova, V. P. Kukhar, J. Fluorine Chem. 2010, 131, 224. doi: 10.1016/j.jfluchem.2009.11.014.
- [10] T. Kitamoto, T. Ozawa, M. Abe, S. Marubayashi, T. Yamazaki, J. Fluorine Chem. 2008, 129, 286. doi: 10.1016/j.jfluchem.2007.12.005.
- [11] D. G. Cox, L. G. Sprague, D. J. Burton, J. Fluorine Chem. 1983, 23, 383. doi: 10.1016/S0022-1139(00)81221-X.
- [12] K. Ogu, M. Akazome, K. Ogura, J. Fluorine Chem. 2003, 124, 69. doi: 10.1016/S0022-1139(03)00191-X.
- [13] K. Ogu, M. Akazome, K. Ogura, J. Fluorine Chem. 2004,125, 429. doi:
- 10.1016/j.jfluchem.2003.11.004.
- [14] E. Schmitt, G. Landelle, J. P. Vors, N. Lui, S. Pazenok, F. R. Leroux, Eur. J. Org. Chem.2015, 2015, 6052. doi: 10.1002/ejoc.201500920.
- [15] E. Schmitt, A. Panossian, J. P. Vors, C. Funke, N. Lui, S. Pazenok, F. R. Leroux, Chem. Eur. J. 2016, 22, 11239. doi: 10.1002/chem.201601621.
- [16] F. Aribi, E. Schmitt, A. Panossian, J. P. Vors, S. Pazenok, F. R. Leroux, Org. Chem. Front. 2016, 3, 1392. doi: 10.1039/C6QO00319B.
- [17] K. Ogura, K. Ogu, T. Ayabe, J. Sonehara, M. Akazome, Tetrahedron Lett. 1997, 38, 5173. doi: 10.1016/S0040-4039(97)01120-9.
- [18] A. Takaoka, M. K. Ibrahim, S. R. F. Kagaruki, N. Ishikawa, Nippon Kagaku Kaishi 1985, 1985, 2169. doi: 10.1246/nikkashi.1985.2169.
- [19] B. Commare, E. Schmitt, F. Aribi, A. Panossian, J. P. Vors, S. Pazenok, F. R. Leroux, Molecules 2017, 22, 977. doi: 10.3390/molecules22060977.
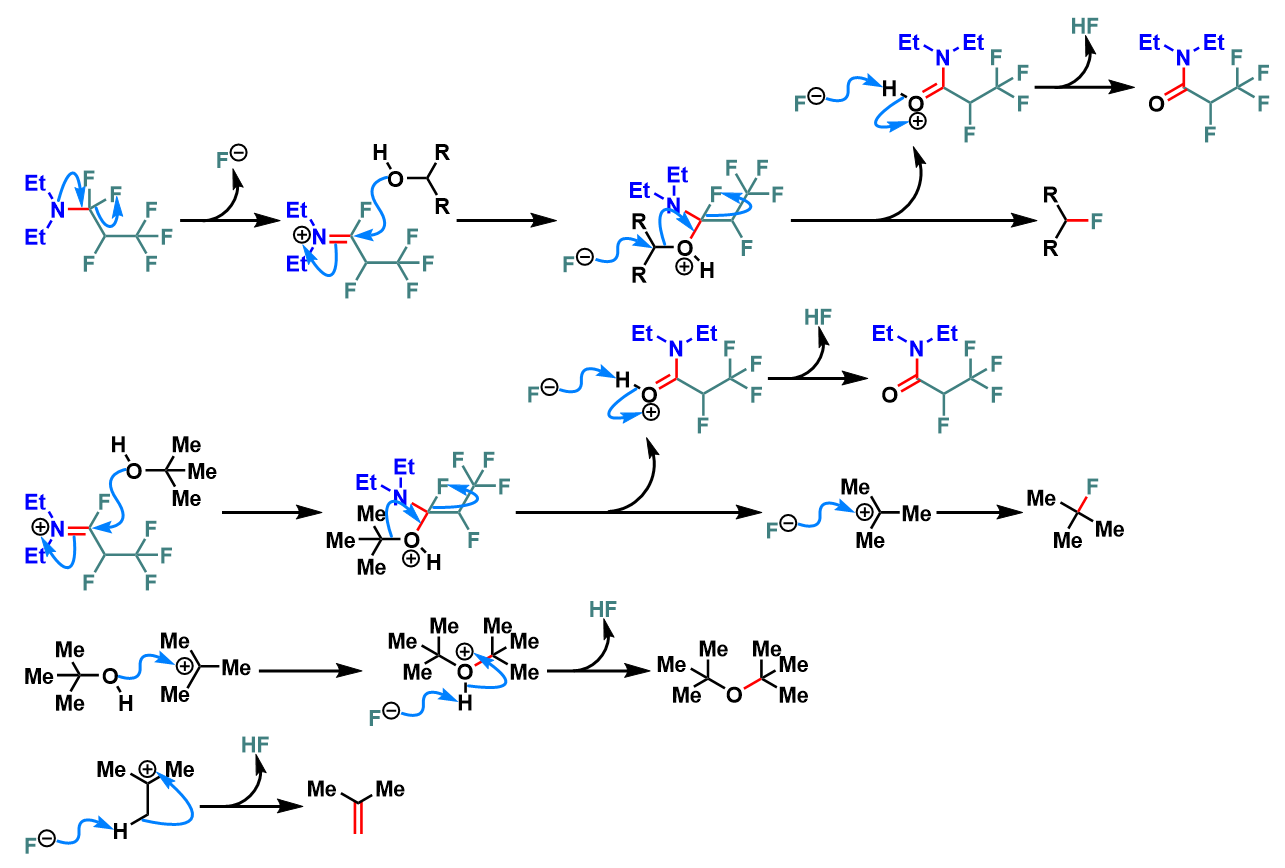
反应机理
醇的去氧氟化
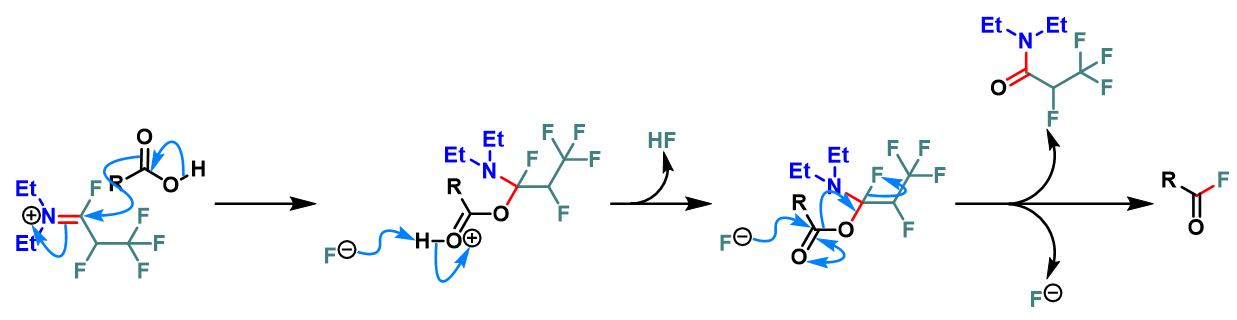
羧酸的去氧氟化
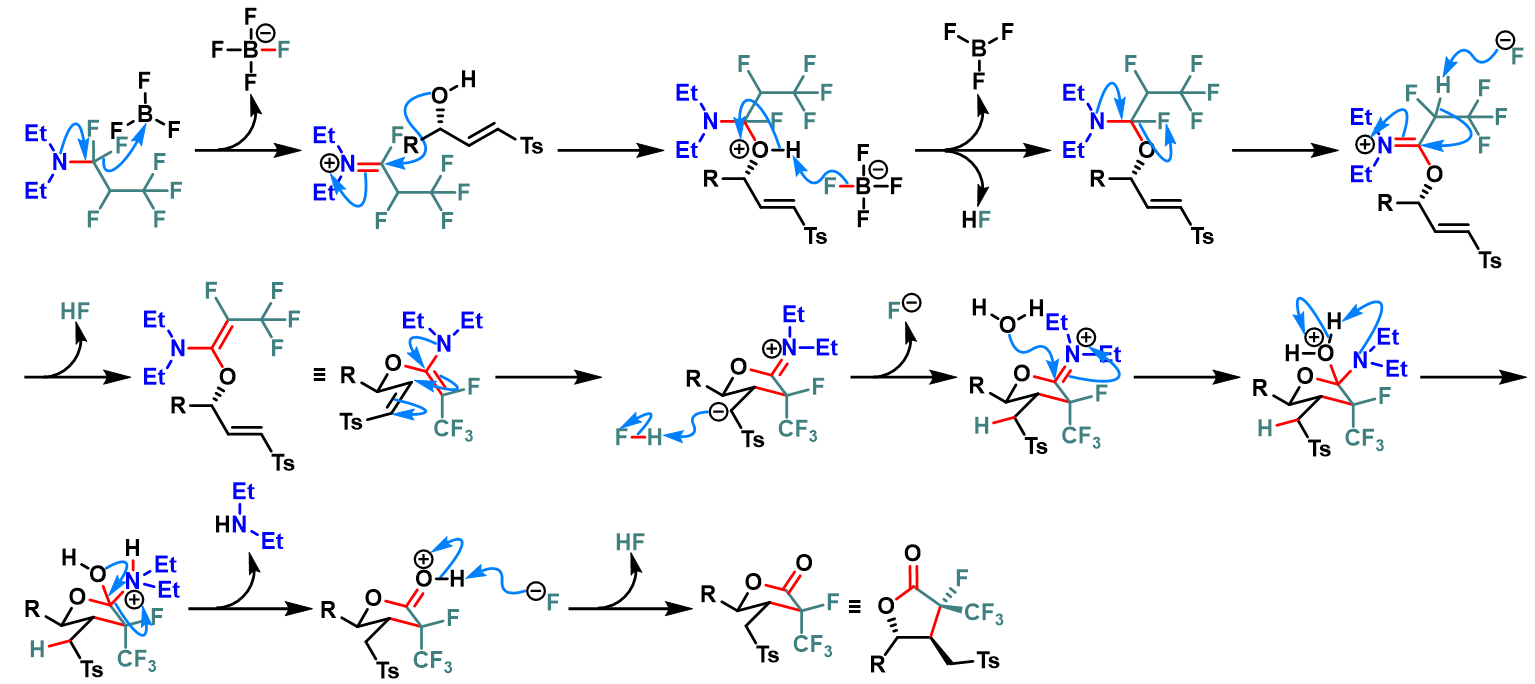
含氟取代基的戊内酯的合成
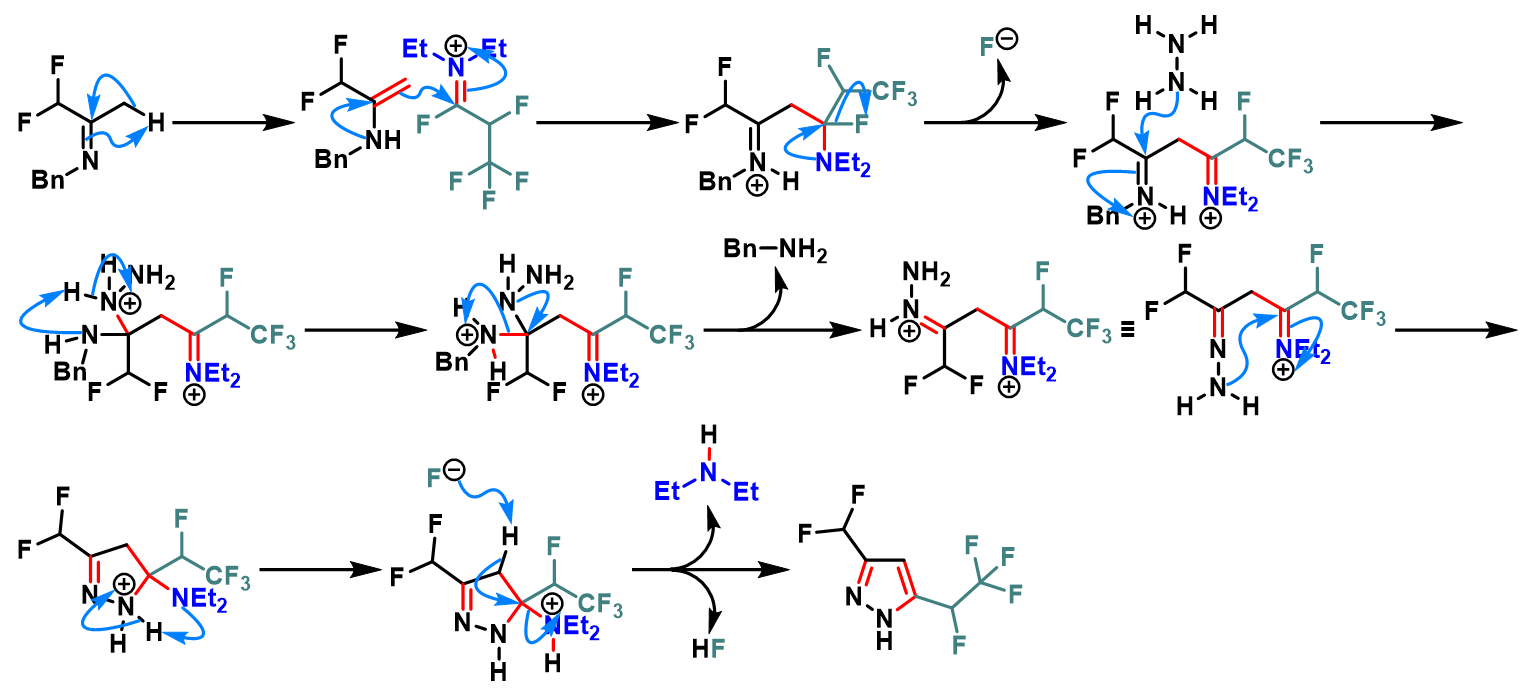
含氟取代基的吡唑环的构建
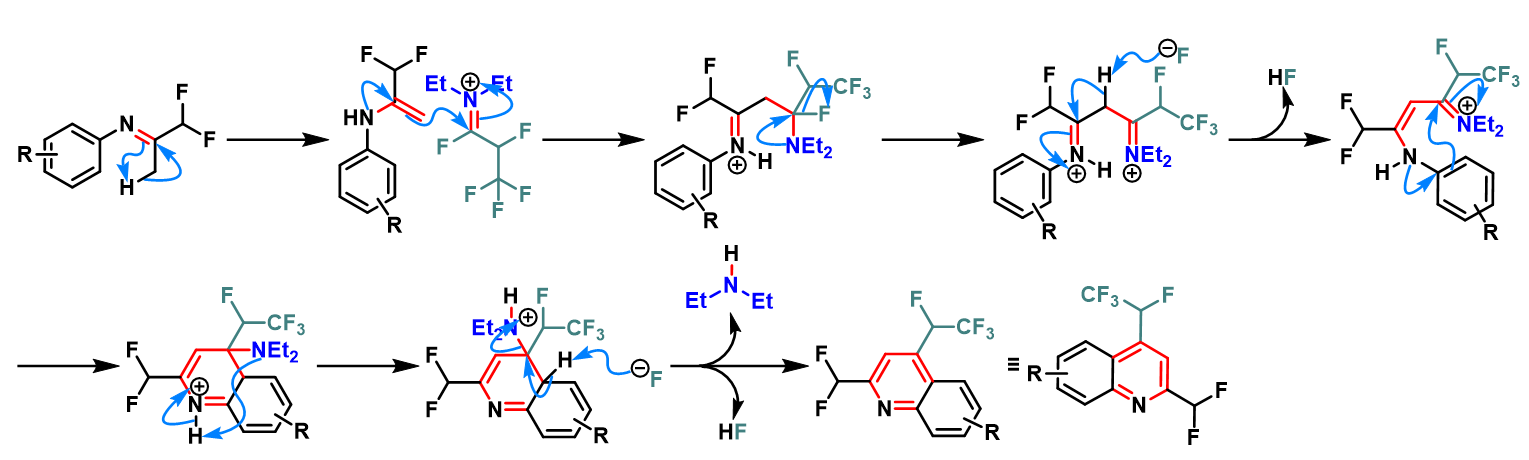
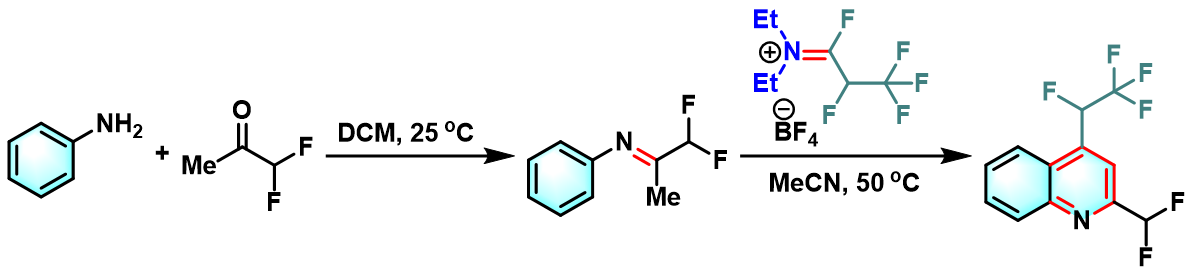
含氟取代基的喹啉环的构建
参考文献
- [1] L. A. F. Andrade, L. A. Zeoly, R. A. Cormanich, M. P. Freitas, Beilstein J. Org. Chem. 2019, 15, 506. doi: 10.3762/bjoc.15.44.
- [2] V. A. Petrov, S. Swearingen, W. Hong, W. C. Petersen, J. Fluorine Chem. 2001, 109, 25. doi: 10.1016/S0022-1139(01)00372-4.
反应实例
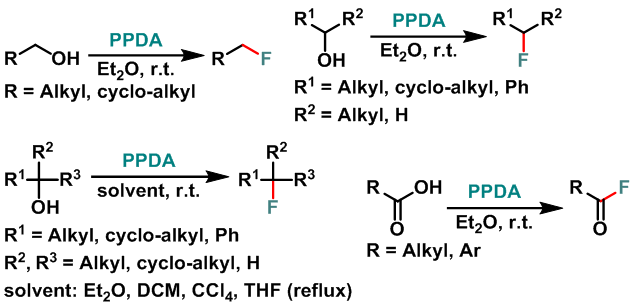
一级氟代烷的合成[1]-[2]
二级氟代烷的合成[1]
三级氟代烷的合成[1]
酰氟的合成[1]
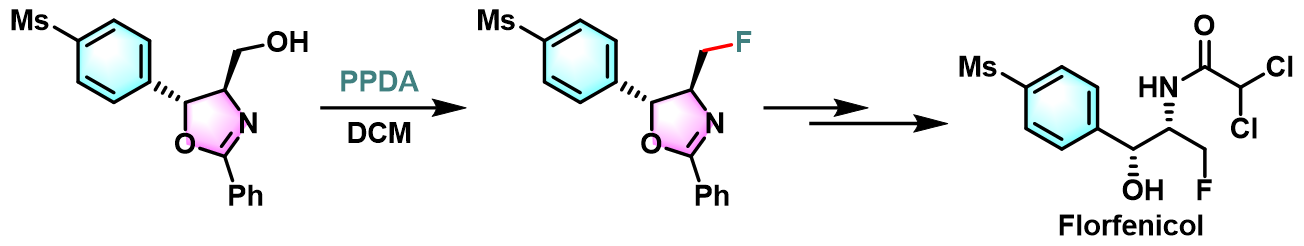
Florfenicol的合成[3]
含氟取代基的吡唑的合成[4]
含氟取代基的喹啉的合成[5]
实验步骤
PPDA的合成
将二乙胺 (1 eq.)与无水乙醚 (二乙胺浓度为0.005 M)置于封管中,并将上述混合物冷却至-70 oC。随后,加入液化的全氟丙烯 (1.1 eq.),并将封管进行密封。再将上述反应混合物升至室温,搅拌直至反应结束。反应结束后,将上述反应混合物进行过滤,除去生成的二乙胺氢氟酸盐晶体,再通过减压除去溶剂。最后,将残余物在减压下进行蒸馏,获得相应PPDA试剂。
醇的去氧氟化
0-5 oC下,将PPDA (1.2 eq.)的乙醚溶液 (浓度为1.2 M)滴加至醇 (1. eq.)的乙醚溶液(底物浓度为1.6 M)中。将上述反应混合物进行搅拌,直至反应结束。反应结束后,向上述反应混合物加入水进行稀释,同时,加入乙醚萃取有机相,合并的有机相依次进行水洗、无水硫酸镁干燥,再通过减压除去溶剂。最后,将残余物在减压下进行蒸馏,获得相应目标产物。
羧酸的去氧氟化
室温下,将PPDA (1.12 eq.)的乙醚溶液 (浓度为1.2 M)滴加至羧酸 (1. eq.)的乙醚溶液 (底物浓度为1.6 M)中。滴加完成后,将上述反应混合物升温至60 oC,在该温度下进行搅拌,直至反应结束。反应结束后,将上述反应混合物进行蒸馏,获得相应目标产物。
参考文献
- [1] N. Ishikawa, Bull. Chem. Soc. Jpn. 1979 , 52, 3377. doi: 10.1246/bcsj.52.3377.
- [2] O’Hagan, D. J. Fluorine Chem. 1989, 43, 371. doi: 10.1016/S0022-1139(00)82723-2.
- [3] D. P. Schumacher, J. E. Clark, B. L. Murphy, P. A. Fischer, J. Org. Chem.
- 1990, 55, 5291. doi: 10.1021/jo00305a027.
- [4] E. Schmitt, G. Landelle, J. P. Vors, N. Lui, S. Pazenok, F. R. Leroux, Eur. J. Org. Chem.2015, 2015, 6052. doi: 10.1002/ejoc.201500920.
- [5] F. Aribi, E. Schmitt, A. Panossian, J. P. Vors, S. Pazenok, F. R. Leroux, Org. Chem. Front. 2016, 3, 1392. doi: 10.1039/C6QO00319B.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






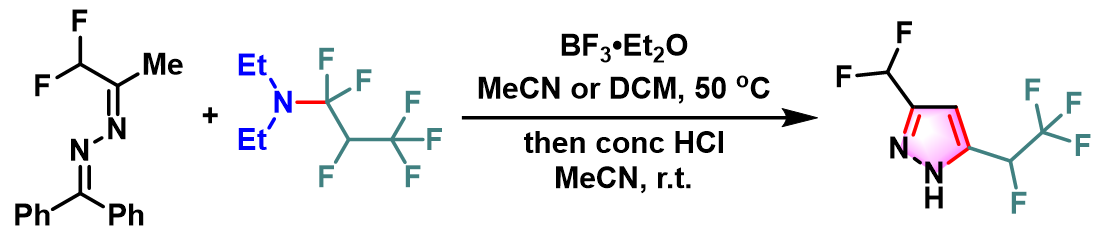















No comments yet.