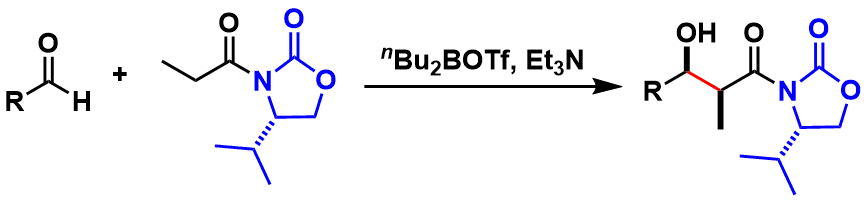最近在chem-station化学空间我们陆续介绍了有机界的明星反应-aldol reaction,不知道各位学有机的大哥们有什么建议与意见,可以点击联系我们提出宝贵意见。作为默默在撰写的小编们,肯定有很多不足,很希望能够通过与大家的交流丰富自己,也丰富chem-station化学空间。
chem-station化学空间是一个服务科研工作者的平台,我们的宗旨-做深入、原创的化学交流平台,在这里我们也真诚希望各位读者能够给我们提出宝贵意见,并且可以加入我们,一起传播化学的魅力。
在第2弹中我们主要介绍了下金属烯醇法对反应选择性的控制,从而大大改善了经典条件的各种问题(交叉反应化、立体选择性控制、不可逆反应化-这些潜在问题具体参照第1回记事),被认为是aldol反应的一大飞跃。
那么接下来的课题就是立体中心的控制,也就是不对称aldol反应的开发咯。
在这篇记事中,我们一起来看一下利用含有手性辅助基的烯醇进行的非対映异构控制的aldol反应吧。
手性辅助基的不对称aldol反应的代表:Evans Aldol反应
其实最开始使用手性辅助基法进行不对称aldol反应突破的是MIT的正宗悟等人,但是当时结果不是特别好。之后才是哈佛大学的David A. Evans等人利用氨基酸由来的恶唑烷酮辅助基,开发出了也就是现在知名的Evans Aldol反应。该方法条件很温和而且实用性很强,几乎可以应用于现有的aldol反应中,并且得到syn-aldol产物。(图1)
图1: Evans Alodol反应 (蓝色部分是手性辅助基)
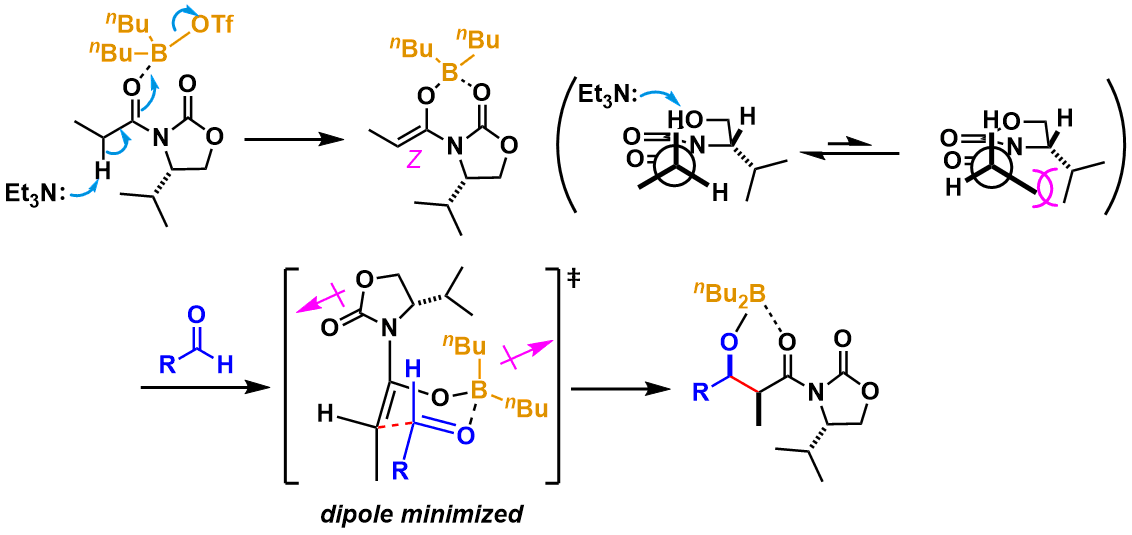
究竟为什么这个手性辅助基的引入能够得到高选择性的aldol反应产物呢?小编总结了下,大致有以下几点因素。首先在硼三氟甲磺酸酯(路易斯酸)的条件下活化羰基后,酰胺的α位的H被三乙胺(碱)拔去,形成Z-硼化烯醇,该烯醇再与另一羰基底物(acceptor)形成硼烯醇介导(第二弹中有介绍)的六元环过渡态进行aldol反应,最终得到syn产物。其中,对于六元环过渡态,为了避免底物羰基与羰基形成偶极子的碰撞,手性辅助基的羰基与烯醇的朝向正好相反,这样也导致作为acceptor的醛从相对于手性辅助基的异丙基的反方向接近(图中[ ]内)
图2:Evans Aldol反应的机理
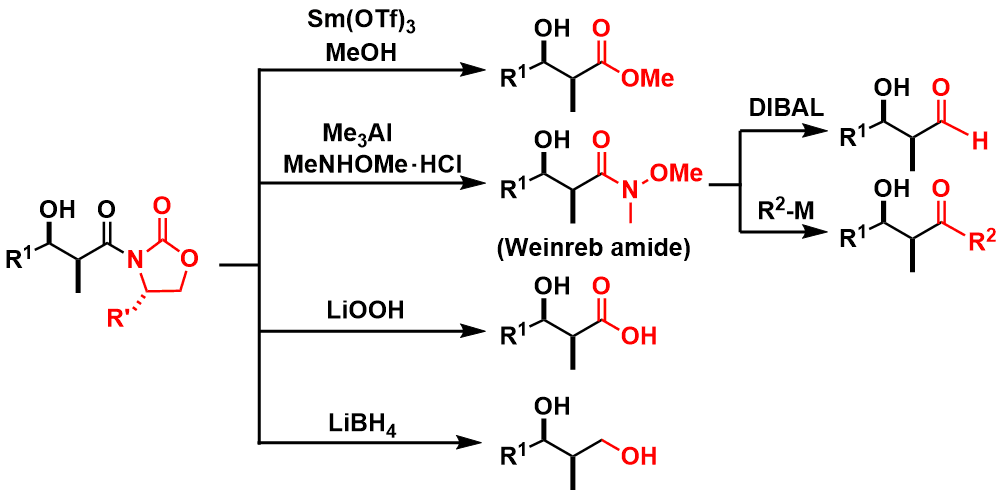
该手性辅助基还有一个最大的优点,就是可以后续转换成各种官能团,所以实用性很高(图3给出了实例)。
图3:手性辅助基的转换
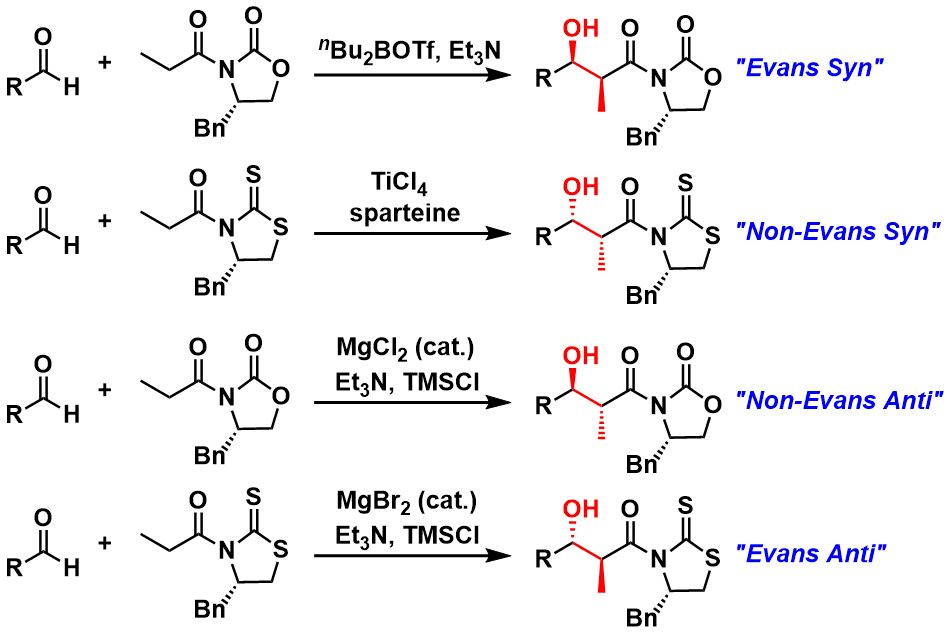
一开始,Evans aldol反应的经典条件一般被认为只能生成syn的产物,但是经过后续的研究,通过反应条件的改变,其产物的立体构型是可以扭转的。所以这也进一步扩大了该类反应的应用范围。
図4:Evans Aldol反应的各种变法
EVANS Aldol反应的应用实例
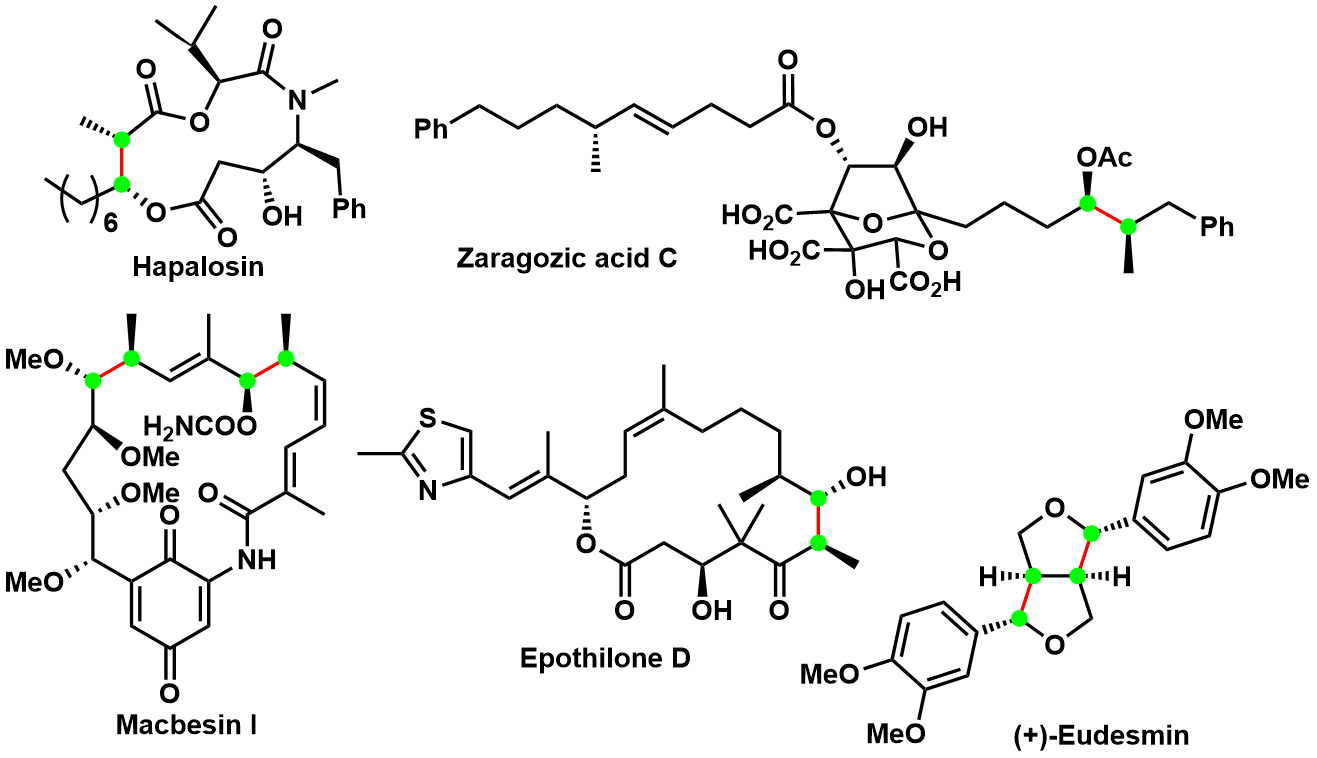
Evans Aldol反应从发现到现在,经过多年的实验论证发现其实用性特别广,反应的立体结构也很容易预测,并且近年来大量合成也得到实现。正由于这么多的特点,该反应也常被用于一些复杂的化合物的合成中。现在该反应与不对称烯丙基硼化一起联用,已经成为一些链状不对称化合物的骨架构建的必用方法。小编在图5中给出了其中一个应用实例,利用Evans Aldol法实现的一些全合成反应。
图5:Evans Aldol反应在全合成天然产物中的应用
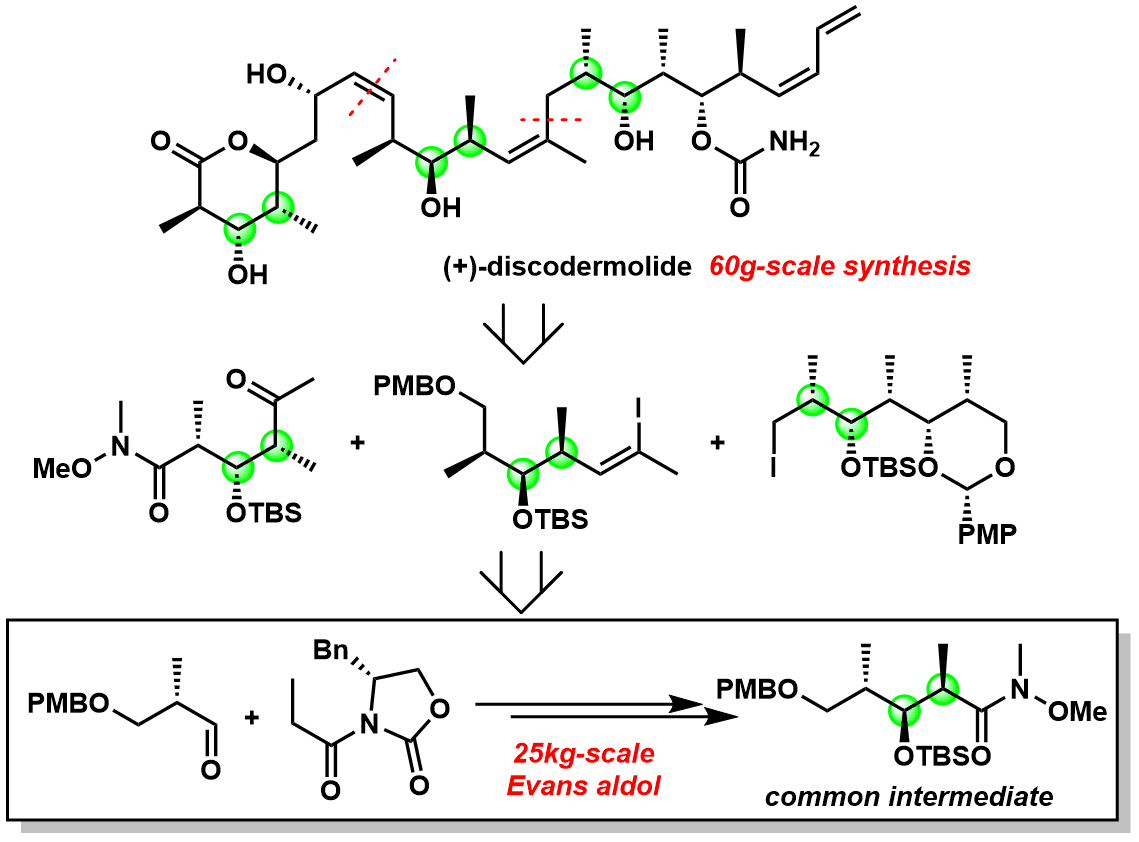
诺华工艺研究团队,利用Evans Aldol反应实现了60g级的抗肿瘤活性天然化合物Discodermolide(含有13个手性点)的合成,用于临床试验的供给。并且最终通过不断地优化实现了25kg级的大量合成。
图6:诺华使用的Discodermolide大量合成路线
硬是要指出此方法的缺陷的话,那就是最终产物中含有的手性辅助基在原子效率以及脱保护的层面上来说还是具有改善的余地吧。
本次主要介绍了手性辅助基在aldol反应中的价值,下次我们将从催化剂的视点来看一下不对称aldol反应的发展,第4弹,敬请期待!
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
关联文献
[1] Recent Review: Heravi, M. M.; Zadsirjan, V. Tetrahedron: Asymmetry 2013, 24, 1149.
[2] Mickel, S. J. et al. Org. Process Res. Dev. 2004, 8, 92, 101, 107, 113 and 122.