本文作者:杉杉
导读:
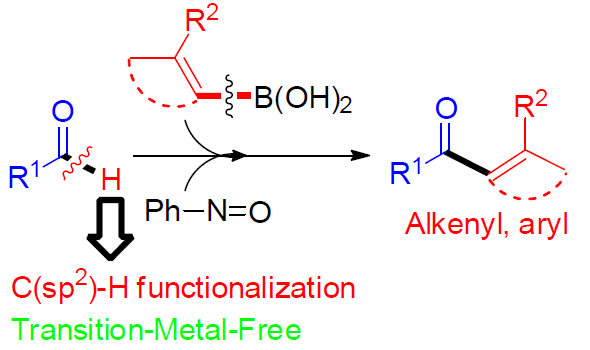
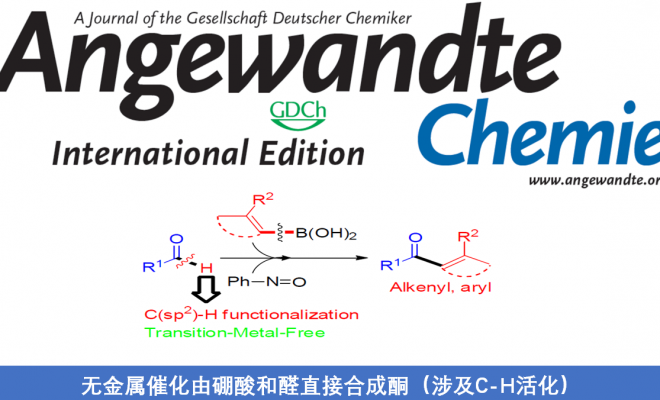
近日,马德里康普顿斯大学Aurelio G. Csáky课题组在Angew. Chem. Int. Ed.上发表论文,报道了在无过渡金属催化下,由醛和硼酸直接合成酮的方法,涉及C-H键的活化。值得注意的是,亚硝基苯的使用可驱动硼酸作为硼酸酯,同时活化醛的C-H键作为亚胺物种,从而实现分子内硼到碳键的迁移,以形成关键的C-C键。
Synthesis of Ketones by C-H Functionalization of Aldehydes with Boronic Acids under Transition-Metal-Free Conditions
Aurelio G. Csaky and Silvia Roscales*
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202015835
正文
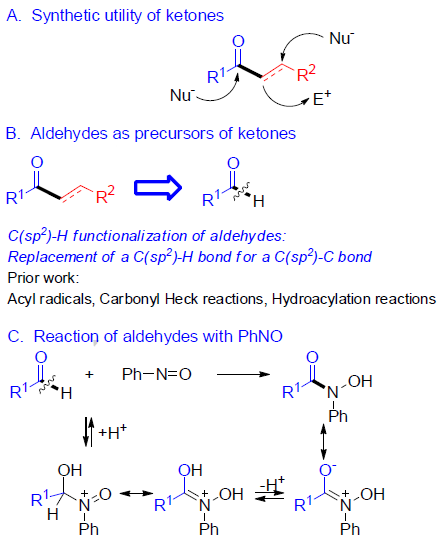
酮是有机化学中最常见的结构单元(Scheme 1a)。已实现多种合成方法来构建酮类化合物,如羧酸衍生物与有机金属试剂的反应、过渡金属催化的交叉偶联反应、Friedel-Crafts、Mannich反应等。对于使用廉价易得的起始原料,通过简便的方法直接合成酮类化合物,仍有待开发。其中,醛的C-H功能化备受关注,由于其可实现将C(sp2)-H键转变为C(sp2)-C键(Scheme 1b)。
醛作为合成酮常见的起始原料。除经典的两步法外,它可加入一个碳亲核试剂,如使用格氏试剂,然后将中间仲醇氧化,通过产生酰基阴离子的极性反转反应(umpolung reactions),可将醛转化为酮。最近,使用酰基自由基[1]、羰基Heck反应[2]、过渡金属催化加成反应[3]以及加氢酰化反应[4]等,可实现醛直接合成酮类化合物。但是,这些方法也存在一定的局限性,如使用强碱、过渡金属、辅助配体、苛刻的反应条件、有限的底物范围等。
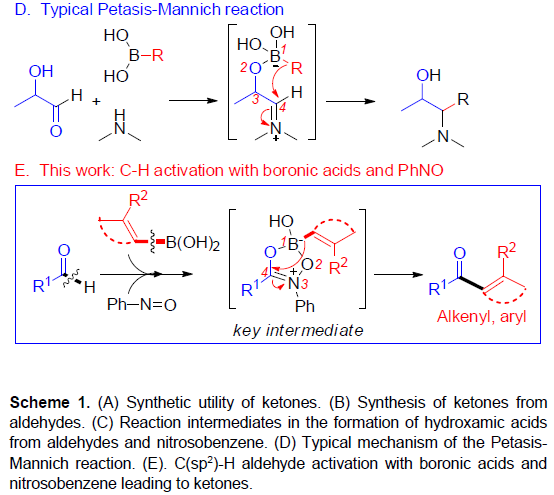
基于对醛与亚硝基苯反应 [5]以及硼酸和亚硝基化合物的反应的研究 [6] (Scheme 1c),作者发现,由于硼酸的低反应性,通常与过渡金属结合使用,但对于在无过渡金属的条件下,使用硼酸作为试剂进行C-C键的形成却很少被研究。在经典的Petasis-Mannich反应中,α-羟醛可转化为胺,其中乙烯基或芳基硼酸与羟基部分的配位产生了硼酸酯中间体,再将中间体的碳基转移到亲电子亚胺基团上(通过醛与伯胺或仲胺的相互作用形成)(Scheme 1d)。最近,已报道其他带有氧位点的硼酸和附近的具有亚胺基官能团的配位化合物,如杂环N-氧化物[7]或腈氧化物[8]的反应,都遵循相关途径[9]。作者设想,在硼酸存在下,醛与亚硝基苯的相互作用可形成具有硼酸酯特征的中间体,该中间体能够通过亚胺离子形成来活化醛的C-H键,再经关键1,4-迁移(硼到碳的迁移),则可实现由醛直接合成酮的策略(Scheme 1e)。
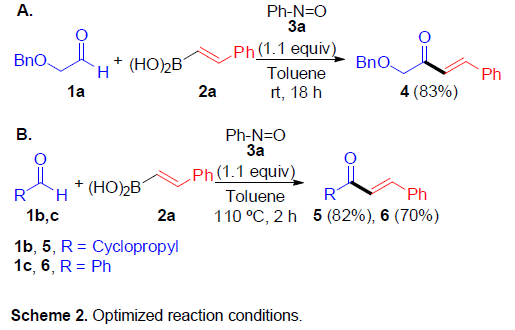
首先,作者以2-苄氧基乙醛(1a)与2-苯基乙烯基硼酸(2a)作为底物,同时加入1.1当量的亚硝基苯时,可在甲苯溶剂中室温反应,获得83%收率的产物4(Scheme 2A)。然而,当使用环丙烷甲醛(1b)或苯甲醛(1c)代替1a时,收率明显降低,但将温度升高至110 ℃时,可在较短的时间(2 h)获得较高的收率的产物5和6。
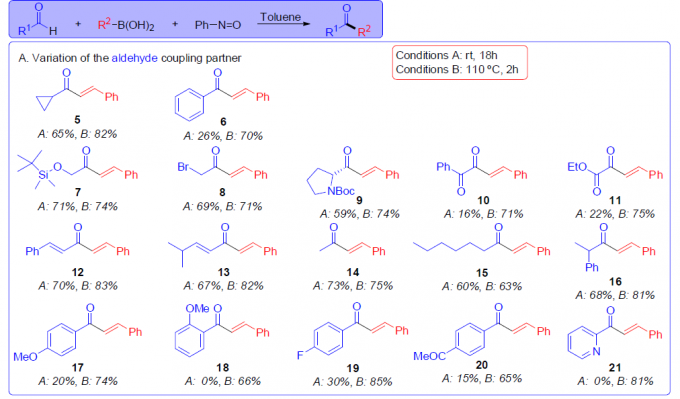
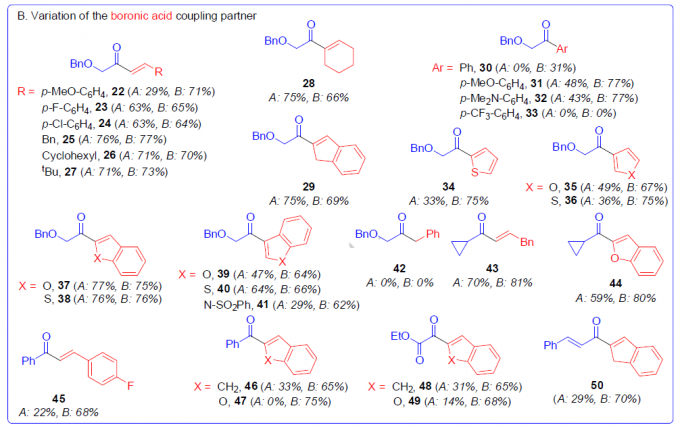
在获得上述最佳反应条件后,作者对醛和硼酸的底物进行了扩展(Scheme 3)。在对醛底物扩展时发现(Scheme 3A),一系列具有α-杂官能化醛(7–9)、1,2-二羰基衍生物(10,11)、α,β-不饱和醛(12、13)、脂族醛(14–16)和芳香醛(6、17–21),均可顺利进行反应,从而以较高的收率合成相应的酮。其次,在对硼酸底物扩展时发现(Scheme 3B),各种取代的烯基硼酸,均可顺利反应,获得相应的产物22–27、43和45。对于α-碳原子上具有位阻的取代基,也同样有效,获得相应的产物(28、29、46、48、50)。同时,苯硼酸(30)具有中等收率,但带有给电基的芳基硼酸(31、32)具有更高的收率。然而,具有吸电子基的芳基硼酸(33)与体系不兼容。此外,一系列杂环硼酸,如呋喃(35)、噻吩(34、36)、苯并呋喃(37、39、44、47、49)、苯并噻吩(38,40)和吲哚(41)衍生物,均与体系兼容。然而,对于烷基硼酸(42)未能进行反应。

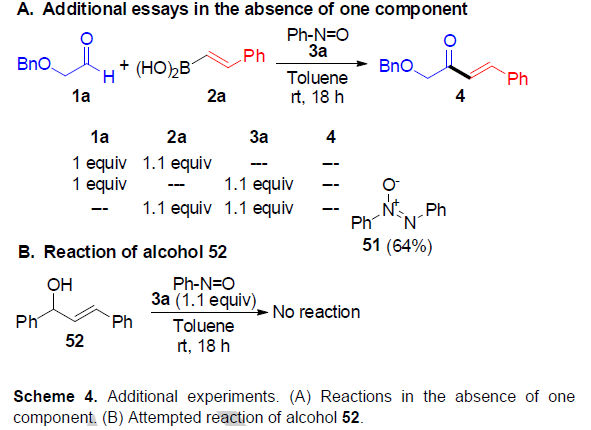
为了进一步了解反应的过程,作者进行了相关的对照实验(Scheme 4)。当体系中无亚硝基苯(3a)时,醛1a与硼酸2a未能发生反应。当体系中无硼酸(2a)时,醛1a与亚硝基苯(3a)发生相关的反应,并且在体系无醛时,3a与2a混合时观察到唯一反应,形成51。此外,使用醇52为底物时,未能进行相关的反应,从而排除了52为中间体的可能性。
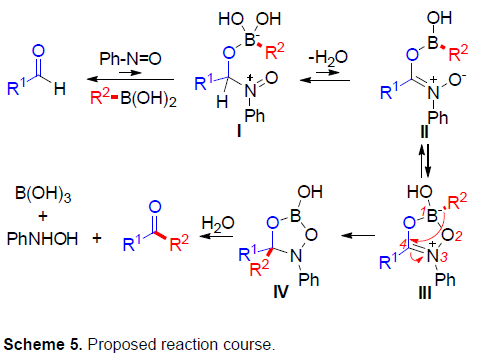
根据上述的实验和相关文献的查阅[5,10,11],作者提出了一种可能的反应机理(Scheme 5)。首先,醛中的氧与硼酸的配位可以引发亚硝基苯的亲核加成,生成不稳定中间体I。随后,通过脱水形成中间体II,再经环化获得中间体III。最后,通过1,4-迁移形成中间体IV,经水解即可获得目标产物酮。
总结
马德里康普顿斯大学Aurelio G. Csáky课题组报道了一种通过亚硝基苯促进硼酸与醛直接合成酮的策略。同时,该反应无需过渡金属催化剂,具有反应条件温和、底物范围广泛、官能团耐受性良好等特点。此外,该反应作为合成酮的一种实用且简单的方法。
参考文献
[1] a) L. Wang, T. Wang, G.-J. Cheng, X. Li, J.-J. Wei, B. Guo, C. Zheng, G. Chen, C. Ran, C. Zheng,
ACS Catal. 2020,
10, 7543-7551; b) A. Banerjee, Z. Lei, M.-Y. Ngai,
Synthesis 2019,
51, 303-333; c) L. Revathi, L. Ravindar, W.-Y. Fang, K. P. Rakesh, H.-L. Qin,
Adv. Synth. Catal. 2018,
360, 4652-4698; d) X. Zhang, D. W. C. MacMillan,
J. Am. Chem. Soc. 2017,
139, 11353-11356; e) H. Yi, G. Zhang, H. Wang, Z. Huang, J. Wang, A. K. Singh, A. Lei,
Chem. Rev. 2017,
117, 9016-9085; f) S. Tripathi, S. N. Singh, L. D. S. Yadav,
Tetrahedron Lett. 2015,
56, 4211-4214; g) X.-H.Ouyang, R.-J.Song, C.-Y.Wang, Y. Yang, J.-H. Li,
Chem. Commun.2015,
51, 14497-14500; h) J. Wang, C. Liu, J. Yuan, A. Lei,
Angew.Chem. Int. Ed. 2013,
52, 2256-2259;
Angew. Chem. 2013,
125, 2312-2315; i) C. Chatgilialoglu, D. Crich, M. Komatsu, I. Ryu,
Chem. Rev. 1999,
99, 1991-2069.
[2] a) J. Ruan, O. Saidi, J. A. Iggo, J. Xiao,
J. Am. Chem. Soc. 2008,
130, 10510–1051; b) J. K. Vandavasi, S. G. Newman,
Synlett2018,
29, 2081-2086; c) Z. Shi, N. Schroeder, F. Glorius,
Angew. Chem., Int. Ed. 2012,
51, 8092-8096;
Angew.Chem. 2013,
125, 5495-5499; d) T. Wakaki, T. Togo, D. Yoshidome, Y. Kuninobu, M. Kanai,
ACS Catal. 2018,
8, 3123-3128.
[3] a) M. Pucheault, S. Darses, J.-P. Genet,
J. Am. Chem. Soc. 2004,
126, 15356-15357; b) G. Mora, S. Darses, J.-P. Genet,
Adv. Synth. Catal. 2007,
349, 1180-1184; c) C. Qin, J. Chen, H. Wu, J. Cheng, Q. Zhang, B. Zuo, W. Su, J. Ding,
Tetrahedron Lett. 2008,
49, 1884-1888; d) P. Alvarez-Bercedo, A. Flores-Gaspar, A. Correa, R. Martin,
J. Am. Chem. Soc. 2010,
132, 466-467; e) M. Kuriyama, N. Hamaguchi, K. Sakata, O. Onomura,
Eur. J. Org. Chem. 2013,
2013, 3378-3385; f) B. Suchand, G. Satyanarayana,
J. Org. Chem. 2016,
81, 6409-6423; g) Y.-X.Liao, Q.-S. Hu,
J. Org. Chem. 2010,
75, 6986-6989; h) H. Li, Y. Xu, E. Shi, W. Wei, X. Suo, X. Wan,
Chem. Commun. 2011,
47, 7880-7882; i) H. Zheng, J. Ding, J. Chen, M. Liu, W. Gao, H. Wu,
Synlett 2011, 1626-1630; j) C. Lei, D. Zhu, V. I. I. I. T. Tangcueco, J. S. Zhou,
Org. Lett. 2019,
21, 5817-5822; k) R. A. Swyka, W. G. Shuler, B. J. Spinello, W. Zhang, C. Lan, M. J. Krische,
J. Am. Chem. Soc. 2019,
141, 6864-6868.
[4] a) P. Gandeepan, L. Ackermann,
Chem. 2018,
4, 199-222; b) A. Ghosh, K. F. Johnson, K. L. Vickerman, J. A. Walker, L. M. Stanley,
Org Chem Front 2016,
3, 639-644; c) M. C. Willis
, Vol. 4, Elsevier B.V.,
2014, pp. 961-994; d) M. C. Willis,
Chem. Rev. 2010,
110, 725-748; d) M. A. Garralda,
Dalton Trans. 2009, 3635-3645.
[5] a) O. Kronja, J. Matijevic-Sosa, S. Ursic,
J. Chem. Soc., Chem. Commun. 1987, 463-464; b) M. Strah, S. Ursic, B. Zorc,
Croat. Chem. Acta 1989,
62, 529-535; c) S. Ursic,
Helv.Chim.Acta1993,
76, 131-138; d) S. Ursic,
V. Pilepic, V. Vrcek, M. Gabricevic, B. Zorc,
J. Chem. Soc., Perkin Trans.
2 1993, 509-514.
[6] a) S. Roscales, A. G. Csaky,
Org. Lett. 2018,
20, 1667-1671; b) S. Roscales, A. G. Csákÿ,
J. Chem. Educ. 2019,
96, 1738-1744; c) S. Roscales, A. G. Csaky,
Acs Omega 2019,
4, 13943-13953.
[7] L. Bering, A. P. Antonchick,
Org. Lett. 2015,
17, 3134-3137.
[8] K. Yang, F. Zhang, T. C. Fang, G. Zhang, Q. L. Song,
Angew. Chem. int. Ed. 2019, 58, 13421-13426;
Angew. Chem. 2019,
131, 13555-13560.
[9] For the coordination of boronic acid derivatives to N-nucleophiles followed by C-migration, see: a) K. Livingstone, J. Mowat, C. Jamieson, S. Bertrand,
Chem. Sci. 2019,
10, 10412-10416; b) K. Livingstone, S. Bertrand, A. R. Kennedy, C. Jamieson,
Chem. – Eur. J. 2020, Ahead of Print, doi: 10.1002/chem.202001590.
[10] a) N. A. Petasis, I. Akritopoulou,
Tetrahedron Lett. 1993,
34, 583-586; b) N. R. Candeias, F. Montalbano, P. M. S. D. Cal, P. M. P. Gois,
Chem. Rev. 2010,
110, 6169-6193; c) P. Wu, M. Givskov, T. E. Nielsen,
Chem. Rev. 2019,
119, 11245-11290.
[11] Similarly to the transformation reported herein, electron-rich boronic acids are more reactive in Petasis-Mannich reactions. See for example: a) M. Follmann, F. Graul, T. Schaefer, S. Kopec, P. Hamley,
Synlett 2005, 1009-1011; b) M. V. Shevchuk, A. E. Sorochinsky, V. P. Khilya, V. D. Romanenko, V. P. Kukhar,
Synlett 2010, 73-76.



























No comments yet.