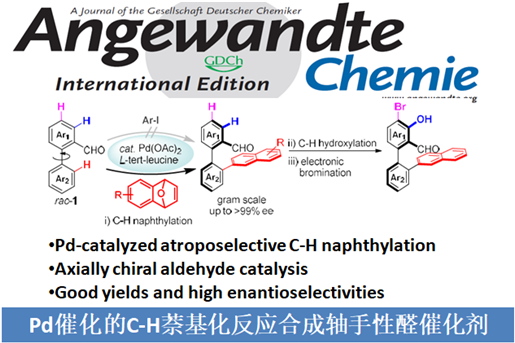
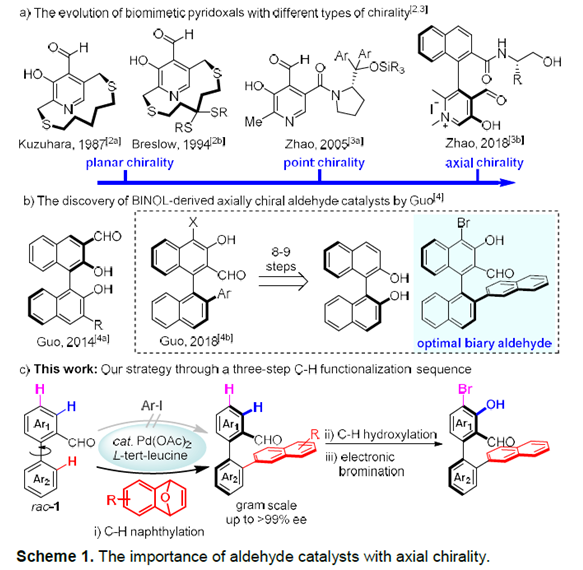
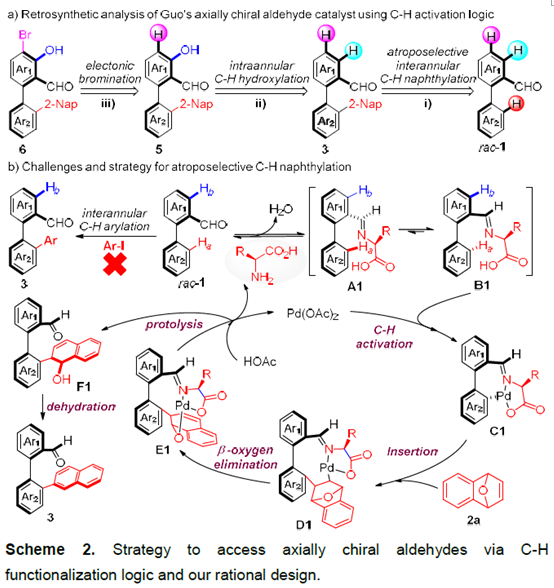
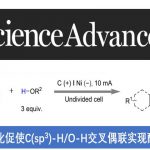
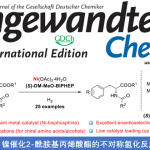
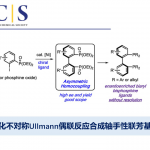
手性醛催化剂被认为是不对称合成中强有力的催化剂,因此合成手性醛催化剂已经受到化学家们的广泛关注。过去的几十年里,合成的手性醛催化剂主要局限于平面手性和手性位点(Scheme 1a),直到2014年,Guo[1]和Zhao[2]课题组成功的开发出了轴手性醛催化剂,这为不对称催化提供了一类新型强有力的催化剂(Scheme 1b)。但该类轴手性醛催化剂的合成步骤冗长、种类单一、活化效率不够高等问题严重阻碍了该类催化剂在不对称合成中的应用。基于上述研究背景,浙江大学史炳锋课题组设想通过三步C-H官能团化反应合成郭氏轴手性醛的理想策略:i)C-H键萘基化;ii)环内C-H键羟基化;iii)C-H键溴化(Scheme 2a)。为了实现这个策略,作者需要解决以下问题:首先,二芳基醛1的C-Ha或C-Hb是否会发生C-H芳基化反应(Scheme 2b)。其次,是否能找到合适的瞬态导向基能使产物具有良好的区域选择性和对映选择性。第三,醛方向的C(sp2)-H羟基化较难。
起初,作者使用rac–1a和2-碘萘在各种条件下反应,但均无产物生成。受到Li课题组开发的Rh(III)催化的2-芳基吡啶和1,4-二氢-1,4-环氧基萘的C-H萘基化反应的启发,作者报道了Pd催化二芳基醛与1,4-二氢-1,4-环氧基萘的不对称C-H萘基化反应。同时,作者推测可能的机理:rac–1与手性氨基酸TDG发生可逆反应,生成亚胺A1和B1。由于空间位阻的相互作用,B1会优先与Pd(OAc)2作用下生成中间体。紧接着,2a插入到C1中并发生β-氧消除反应生成中间体E1。在HOAc的作用下,E1的Pd-O键断裂释放二氢萘酚F1,同时,Pd(OAc)2和手性氨基酸TDG再生。最后,F1脱水得到萘基化产物3。3再经历两次C-H键官能团化得到轴手性醛催化剂(Scheme 2b)。相关研究成果发表于
Synthesis of Chiral Aldehyde Atroposelective C−H NaphthylCaatitoanly sts via Pd-Catalyzed”
Liao, G.; Chen, H.-M.; Xia, Y.-N.; Li, B.; Yao, Q.-J.; Shi, B.-F.* Angew. Chem. Int. Ed. 2019, Just Accepted Manuscript
DOI: 10.1002/anie.201906700
论文作者介绍:
论文作者:史炳锋教授
研究经历:
- 1997/09-2001/07:学士,南开大学化学系 (导师:孟继本教授)
- 2001/09-2006/07:博士,中科院上海有机所生命有机国家重点实验室 (导师: 俞飚研究员)
- 2006/10-2007/08:博士后,加州大学圣迭戈分校化学系 (导师:Prof. Michael S. VanNieuwenhze)
- 2007/08-2010/4:研究助理,The Scripps Research Institute化学系 (导师:Prof. Jin-Quan Yu)
- 2010/4-2014/12:浙江大学化学系特聘研究员 、博导、独立PI
- 2015/01-至今:浙江大学化学系 教授、博导、独立PI
- 2017/08-至今:兼任化学系副系主任、有机与药物化学研究所所长
研究方向:
1.过渡金属催化的碳氢键活化
2.天然产物多样性合成及其化学生物学研究
奖励荣誉:
- 明治乳业生命科学奖
- 2006,Roche Creative Chemistry Award
- 2008,Gordon Research Conference (GRC) Chair’s Award
- 2013,钱江人才
- 2015,Thieme Chemistry Journal Award
- 2015,Distinguished Lectureship Award from Chemical Society of Japan
- 2016,浙江省杰出青年基金
- 2016,浙江省151人才
- 2018,药明康德生命化学研究奖
论文概要:
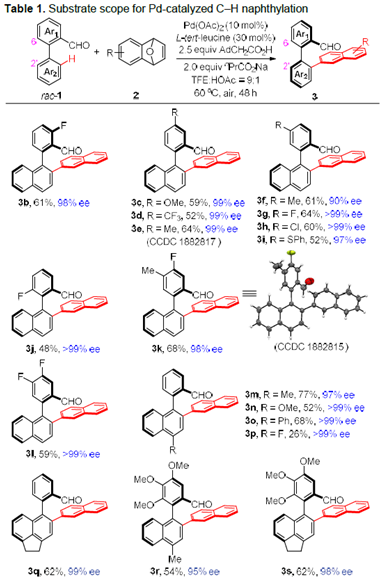
以2-芳基醛rac–1a和1,4-二氢-1,4-环氧基萘2a作为模板底物,作者对各种反应条件进行反复筛选,确定最佳条件为(Table S1):10 mol% Pd(OAc)2和30 mol%L-叔亮氨酸为催化剂,2.5 equiv AdCH2CO2H和2.0 equiv nPrCO2Na为添加物,TFE/HOAc 为溶剂,在60℃条件下反应48小时,能以71%的收率和> 99%的对映选择性得到相应产物。
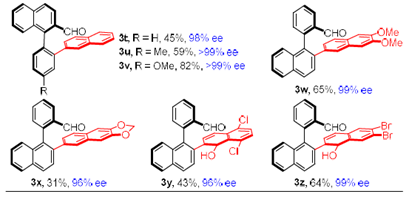
在最优反应条件下,作者考察了该反应的底物范围(Table 1)。各种OMe, CF3, Me, F, Cl, -SPh取代的2-芳基醛均能较好的适应反应条件,能以中等至良好的收率和优秀的对映选择性得到相应产物。而萘部分带有氟取代基的二芳基醛的反应非常缓慢,只能以26%的收率得到相应产物。另外,各种取代的1,4-二氢-1,4-环氧基萘也具有良好的耐受性,能以中等的收率和优异的对映选择性得到相应产物。
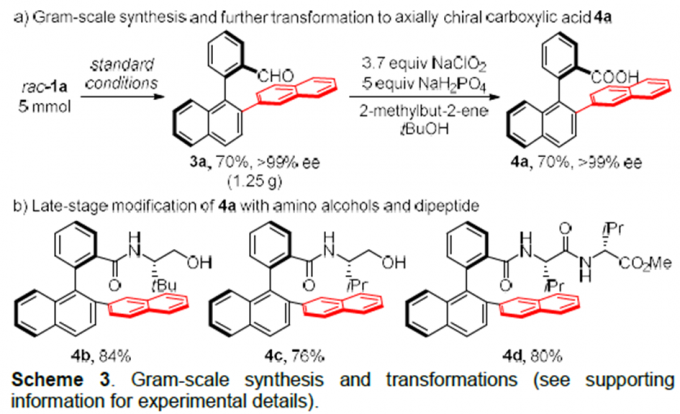
为了证明该反应的应用潜力,作者又进行了克级反应及衍生反应(Scheme 3)。将rac–1a的量增至5 mmol,在标准条件下反应,该反应的收率和对映选择性与模板保持一致。得到的产物3a可被氧化成相应的羧酸4a。4a可以进一步转化为带氨基醇和二肽的轴手性二芳基化合物。
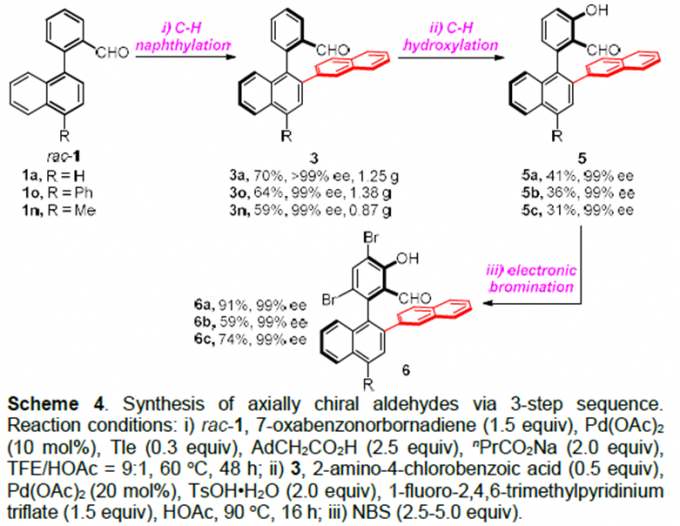
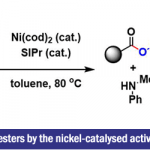
在成功的获得产物3后,作者经过条件筛选,最终通过3步C-H官能团化反应,能以良好至优秀的收率和优秀的对映选择性得到郭氏轴手性醛(Scheme 4)。
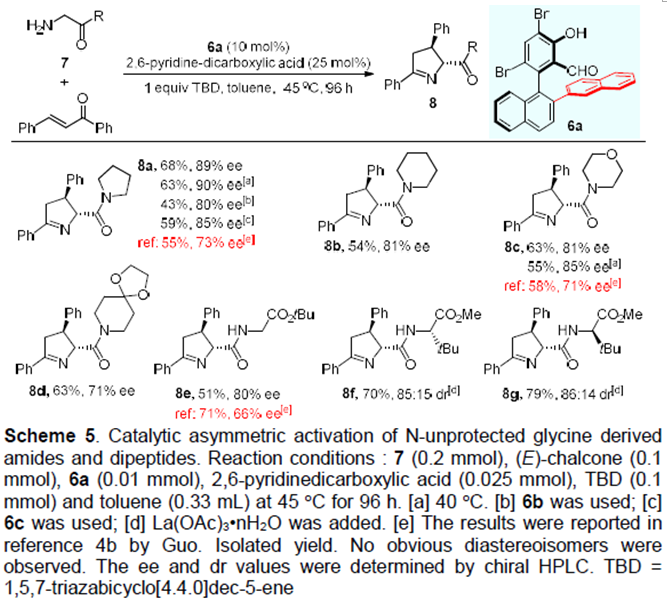
上述步骤中得到的手性醛催化剂6可用于催化(E)-查尔酮和甘氨酸衍生的酰胺或二肽7的不对称反应(Scheme 5)。其中,6a的催化效果最好。同时,在该催化体系下,哌啶,吗啉,1,4-二氧杂-8-氮杂螺[4.5]癸烷衍生的甘氨酰胺具有良好的耐受性,均能以良好的收率和对映选择性得到相应的产物8。
论文总结评价:
浙江大学史炳锋课题组课题组报道了Pd催化2-芳基醛和1,4-二氢-1,4-环氧基萘的不对称C-H萘基化反应,能以中等至良好的收率和优异的对映选择性得到相应产物3。3再通过环内C-H键羟基化和C-H键溴化反应可以得到郭氏轴手性醛6。手性醛催化剂6a可用于催化(E)-查尔酮和甘氨酸衍生的酰胺或二肽7的不对称反应,能以良好的收率和对映选择性得到相应产物。
参考文献:
- Chen, ; Luo, M.-J.; Zhu, F.; Wen, W.; Guo, Q.-X. J. Am. Chem. Soc. 2019, 141, 5159. DOI: 10.1021/jacs.9b01910
- Chen, J.; Gong, X.; Li, J.; Li, Y.; Ma, J.; Hou, C.; Zhao, G.; Yuan, W.; Zhao, B. Science, 2018, 360, DOI: 10.1126/science.aat4210
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.