概要
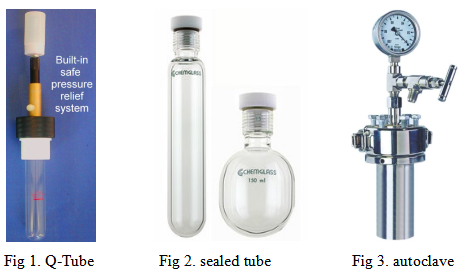
Q-Tube又称为Q-Tube反应器 (Q-Tube reactor)或Q-Tube压力反应器 (Q-Tube pressure reactor)[1],是美国Q Labtech公司设计的一种用于实验室高压化学 (High Pressure Chemistry, HPC)研究的反应装置(Fig 1.)。该装置价格低廉,具有压力释放系统 (pressure-release system)与再密封系统 (reseal system) [1]。同时,与高压反应实验中常用的封管 (sealed tube, Fig 2.)以及反应釜 (autoclave, Fig 3.)相比,能够有效避免因反应装置超压而产生的爆炸事故,因此,操作更加安全[1]。
同时,研究表明,Q-tube能够有效地完成一些在微波条件下速率较慢甚至无法进行的反应。而且,该反应器尤其适用于溶剂无法吸收微波的情况,并能够加快反应进行,减少副反应发生,极大提高反应收率与反应过程的原子经济性[1]-[25]。因而,与微波合成仪 (microwave synthesizer)相比,Q-tube更加高效,并符合绿色化学的设计理念。之后,Q Labtech公司将Q-Tube与Fisher-Porter反应器 (Fisher-Porter reactor, Fig 4.)以及Fisher-Porter型充气体系 (Fisher-Porter type purging system, Fig 5.)结合,对Q-Tube装置进行进一步改进 (Fig 6.),从而顺利将Q-tube反应器应用于氢化反应以及需要充入其它气体的高压反应 (gas-filled pressurized reaction, Fig 7.)。
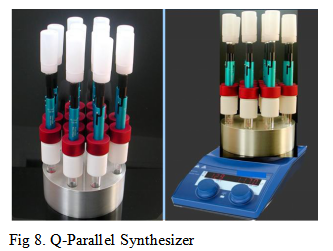
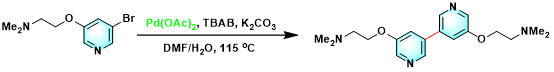
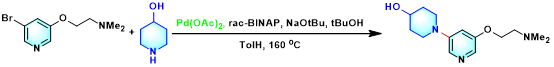
此外,Q Labtech公司开发出Q-平行合成仪 (Q-Parallel Synthesizer, Fig 8.),进而使相关反应条件的优化筛选变得更加便捷。目前,Q-Tube反应器已经广泛应用于一系列相关有机合成方法学的实验室研究[1]-[25],主要涉及氢气[1]、乙烯[2]-[3]、氨[4]、氧气[5]等气体参与的有机合成转化、过渡金属试剂参与的相关反应方法学[1]-[3], [5]-[9]、MCR (multi-component reaction)[4], [9]-[15]、各类杂环体系的构建[4]-[22]、芳香酮的合成[23]、聚合反应[24]以及与药物分子构筑 [6]-[7], [16], [25]等方面。 本期小编主要介绍Q-Tube反应器的基本组成部件与该反应器在有机合成方法学中的应用实例。而Q-Tube反应器中,每一部件的具体作用以及Q-Tube反应器的实验操作步骤,小编将在下期详细介绍。
基本文献
[1] F. G. Nacca, O. Merlino, F. Mangiavacchi, D. Krasowska, C. Santi, L. Sancineto, Curr. Green Chem. 2017, 4, 58. doi: 10.2174/2213346104666170908160741. [2] F. Mo, G. Dong, Science, 2014, 345, 68. doi: 10.1126/science.1254465. [3] J. Kwak, Y. Ohk, Y. Jung, S. Chang, J. Am. Chem. Soc. 2012, 134, 17778. doi: 10.1021/ja308205d. [4] P. Costanzo, C. Calandruccio, M. L. D. Gioia, M. Nardi, M. Oliverio, A. Procopio, J. Clean. Prod. 2018, 202, 504. doi : 10.1016/j.jclepro.2018.08.120. [5] H. M. Ibrahim, H. Behbehani, J. Org. Chem. 2020, 85, 23, 15368. doi: 10.1021/acs.joc.0c02186. [6] M. Pieroni, S. Girmay, D. Sun, R. Sahu, B. L. Tekwani, G. T. Tan, Chem. Med. Chem. 2012, 7, 1895. doi: 10.1002/cmdc.201200346. [7] I. Tomassoli, D. Gündisch, Bioorg. Med. Chem. 2015, 23, 4375.doi: 10.1016/j.bmc.2015.06.034.
[8] M. Taddei, M. G. Mura, S. Rajamäki, Adv. Synth. Catal. 2013, 355, 3002. doi: 10.1002/adsc.201300559. [9] M. Oliverio, P. Costanzo, M. Nardi, I. Rivalta, A. Procopio, ACS Sustain.Chem. Engin. 2014, 2, 1228. doi: 10.1021/sc5000682. [10] K. M. Alzaydia, N. S. Abojabala, M. H. Elnagdib, Tetrahedron Lett. 2016, 57, 3596. doi: 10.1016/j.tetlet.2016.05.035. [11] M. A. AL-Johani, K. M. Al-Zaydi, S. M. Mousally, N. F. Alqahtani, N. H. Elnagdi, M. H. Elnagdi, Molecules 2017, 22, 2114. doi: 10.3390/molecules22122114. [12] M. S. Moustafa, S. M. Al-Mousawi, Curr. Org. Chem. 2018, 22, 268. doi: 10.2174/1385272821666170817105019. [13] K. U. Sadek, M. A. Selim, A.-A. Alnajjar, M. Atallah, M. H. Elnagdi, Eur. J. Chem. 2016, 7, 468. doi: 10.5155/eurjchem.7.4.468-472.1508. [14] M. S. Moustafa, S. Mohammed Al-Mousawia, M. H. Elnagdibm, RSC Adv. 2016, 6, 90840.doi: 10.1039/C6RA19535K. [15] L. Sancineto, B. Monti, O. Merlino, O. Rosati, C. Santib. Arkivoc 2018, Part III, 270. doi: 10.24820/ark.5550190.p010.506. [16] H. M. Ibrahim, H. Behbehani, Sci. Rep. 2020, 10, 6492. doi: 10.1038/s41598-020-63453-2. [17] D. S. AlMarzouq, O. S. Zaky, A. A. AlNajjar, K. U. Sadek, Eur. J. Chem. 2016, 7, 347. doi: 10.5155/eurjchem.7.3.347-351.1473. [18] M. Jha, M. Edmunds, K. Lund, A. Ryan. Tetrahedron Lett. 2014, 55, 5691.doi: 10.1016/j.tetlet.2014.08.100.
[19] S. Sreekumar, M. Balakrishnan, K. Goulas, G. Gunbas, A. Gokhale, L. Louie, A. Grippo, C. Scown, A. T. Bell, F. D Toste, Chem. Sus. Chem. 2015, 8, 2609. doi: 10.1002/cssc.201500754. [20] D. Blanchard, T. S. Cameron, M. Jha, Mol. Diver. 2013, 17, 827. doi: 10.1007/s11030-013-9470-x. [21] A. M. Abdelkhalik, N. K. Paul, A. Jha, Steroids. 2015, 98, 107. doi: 10.1016/j.steroids.2015.03.010. [22] D. S. AlMarzouq, N. M. H. Elnagdi, Molecules, 2019, 24, 1806. doi: 10.3390/molecules24091806. [23] M. Oliverio, M. Nardi, P. Costanzo, L. Cariati, G. Cravotto, S. V. Giofrè, A. Procopio, Molecules, 2014, 19, 5599. doi: 10.3390/molecules19055599. [24] M. Shibata, N. Tetramoto, A. Imada. React. Funct. Polym. 2013, 73, 1086. doi: 10.1016/j.reactfunctpolym.2013.05.002. [25] J. Andrés, J. Alcázar, J. M. Cid. J. Med. Chem. 2012, 55, 8685. doi:实验装置介绍
目前,商品化的Q-Tube反应器主要有以下两种类型:(1) 常规Q-Tube 反应器( Fig 9.): 无法连接高压气体填充装置,因此不能用于高压气体参与的反应 (2) Fisher-Porter型Q-Tube反应器 (Fig 10.): 该反应器连接有高压气体填充装置与压力表,因此,能够适用于一系列高压气体参与的反应。
实验室应用实例
环酮的α-乙基化[1]
呋喃醛的去氧氢化 (hydrodeoxygenation) [2]
乙烯气体参与的C-H键官能团化[3]
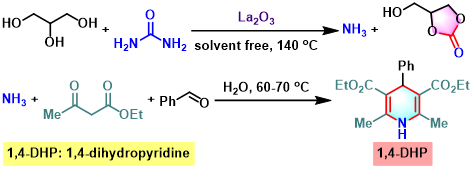
1,4-DHP的合成[4]
咔唑的合成[5]
Ullmann反应[6]
Buchwald-Hartwig反应[6]
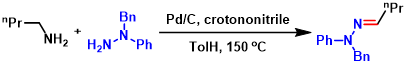
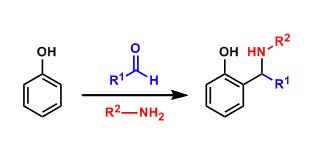
亚胺的合成[7]
CDC (cross dehydrogenative coupling)反应[8]
Biginelli反应[9]
四组分反应[10]
吡嗪并[5,4,3-de][1,6]萘啶的合成[11]
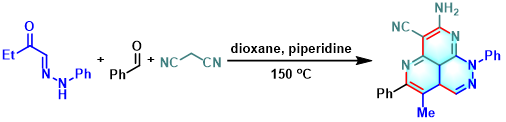
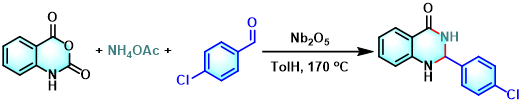
2,3-二氢喹唑啉-4(1H)-酮的合成[12]
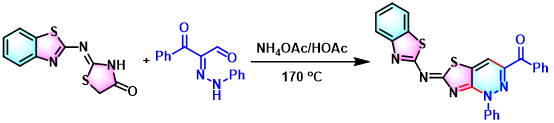
噻唑并[4,5-c]吡嗪的合成[13]
吡咯并[1,5-a]嘧啶衍生物的合成[14]
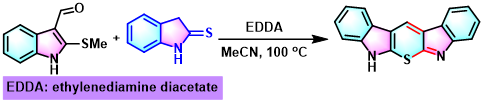
取代噻喃并[2,3-b:6,5-bʹ]双吲哚的合成[15]
呋喃醛与醇的烯基化[16]
烯醇醚的合成[17]
Bucherer反应[18]
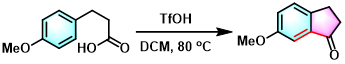
茚酮的合成[19]
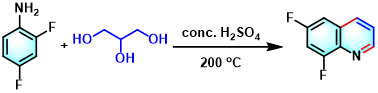
Skraup喹啉合成[20]
参考文献
[1] F. Mo, G. Dong, Science, 2014, 345, 68. doi: 10.1126/science.1254465. [2] F. G. Nacca, O. Merlino, F. Mangiavacchi, D. Krasowska, C. Santi, L. Sancineto, Curr. Green Chem. 2017, 4, 58. doi: 10.2174/2213346104666170908160741. [3] J. Kwak, Y. Ohk, Y. Jung, S. Chang, J. Am. Chem. Soc. 2012, 134, 17778. doi: 10.1021/ja308205d. [4] P. Costanzo, C. Calandruccio, M. L. D. Gioia, M. Nardi, M. Oliverio, A. Procopio, J. Clean. Prod. 2018, 202, 504. doi : 10.1016/j.jclepro.2018.08.120. [5] M. Pieroni, S. Girmay, D. Sun, R. Sahu, B. L. Tekwani, G. T. Tan, Chem. Med. Chem. 2012, 7, 1895. doi: 10.1002/cmdc.201200346. [6] I. Tomassoli, D. Gündisch, Bioorg. Med. Chem. 2015, 23, 4375.doi: 10.1016/j.bmc.2015.06.034.
[7] M. Taddei, M. G. Mura, S. Rajamäki, Adv. Synth. Catal. 2013, 355, 3002. doi: 10.1002/adsc.201300559. [8] H. M. Ibrahim, H. Behbehani, J. Org. Chem. 2020, 85, 23, 15368. doi: 10.1021/acs.joc.0c02186. [9] M. Oliverio, P. Costanzo, M. Nardi, I. Rivalta, A. Procopio, ACS Sustain.Chem. Engin. 2014, 2, 1228. doi: 10.1021/sc5000682. [10] K. M. Alzaydia, N. S. Abojabala, M. H. Elnagdib, Tetrahedron Lett. 2016, 57, 3596. doi: 10.1016/j.tetlet.2016.05.035. [11] M. A. AL-Johani, K. M. Al-Zaydi, S. M. Mousally, N. F. Alqahtani, N. H. Elnagdi, M. H. Elnagdi, Molecules 2017, 22, 2114. doi: 10.3390/molecules22122114. [12] L. Sancineto, B. Monti, O. Merlino, O. Rosati, C. Santib. Arkivoc 2018, Part III, 270. doi: 10.24820/ark.5550190.p010.506. [13] H. M. Ibrahim, H. Behbehani, Sci. Rep. 2020, 10, 6492. doi: 10.1038/s41598-020-63453-2. [14] D. S. AlMarzouq, O. S. Zaky, A. A. AlNajjar, K. U. Sadek, Eur. J. Chem. 2016, 7, 347. doi: 10.5155/eurjchem.7.3.347-351.1473. [15] M. Jha, M. Edmunds, K. Lund, A. Ryan. Tetrahedron Lett. 2014, 55, 5691.doi: 10.1016/j.tetlet.2014.08.100.
[16] S. Sreekumar, M. Balakrishnan, K. Goulas, G. Gunbas, A. Gokhale, L. Louie, A. Grippo, C. Scown, A. T. Bell, F. D Toste, Chem. Sus. Chem. 2015, 8, 2609. doi: 10.1002/cssc.201500754. [17] D. Blanchard, T. S. Cameron, M. Jha, Mol. Diver. 2013, 17, 827. doi: 10.1007/s11030-013-9470-x. [18] A. M. Abdelkhalik, N. K. Paul, A. Jha, Steroids. 2015, 98, 107. doi: 10.1016/j.steroids.2015.03.010. [19] M. Oliverio, M. Nardi, P. Costanzo, L. Cariati, G. Cravotto, S. V. Giofrè, A. Procopio, Molecules, 2014, 19, 5599. doi: 10.3390/molecules19055599. [20] D. S. AlMarzouq, N. M. H. Elnagdi, Molecules, 2019, 24, 1806. doi: 10.3390/molecules24091806.






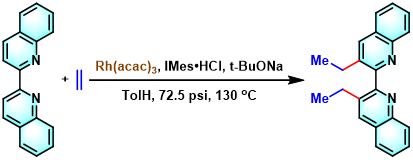
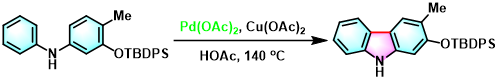


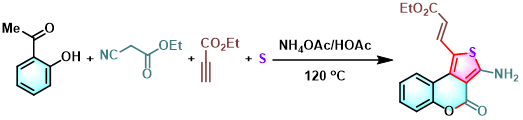

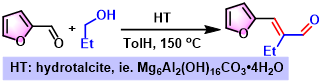






















No comments yet.