本文作者:杉杉
导读
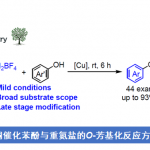
近日,美国斯克利普斯研究所(The Scripps Research Institute,TSRI)Keary M. Engle 教授课题组在ACS Catal.上发表论文,报道了一种镍催化体系,可实现烯基胺(芳基磺酰基保护)与芳基碘化物和芳基硼酸酯的1,2-二芳基化反应。同时,该反应具有广泛的底物范围、良好的官能团耐受性、优异的区域和非对映选择性等特点。此外,通过N-官能团化以及脱保护步骤,可合成具有价值的仲胺化合物。
Sulfonamide Directivity Enables Ni-Catalyzed 1,2-Diarylation of Diverse Alkenyl Amines
Omar Apolinar, Van T. Tran, Nana Kim, Michael A. Schmidt, Joseph Derosa, and Keary M. Engle*
ACS Catal. ASAP DOI:10.1021/acscatal.0c03857
正文
过渡金属催化烯烃的1,2-二芳基官能团化已被广泛的研究,如Pd、Ni、Co、Cu、Fe等。其中,镍催化具有独特的优势,如易进行氧化加成和1,2-迁移插入等。同时,烯基胺底物的1,2-二碳官能团化反应,可快速合成官能团化的烷基胺产物,其中受保护的胺导向基团对于催化循环至关重要。Zhang[1]和Giri[2]等分别报道了活化的酰胺和邻乙烯基苯胺衍生物的1,2-(氟烷基)芳基化和1,2-二芳基化反应(Scheme 1)。2018年,Zhao课题组[3]报道了使用不可去除的嘧啶辅助剂,通过Ni与N(sp2)原子中心的配位,促进非共轭末端烯烃的1,2-二芳基化反应。近期,本课题组[4]分别报道了烯基酰胺和N-烯丙基杂环的1,2-二芳基化和1,2-烯丙基甲基化反应。此外,其他课题组[5]也已报道通过不同的机理实现镍催化非共轭烯烃的交叉偶联反应。然而,该类反应仍然存在很大的局限性,如底物的局限性以及导向基团的使用影响进一步功能化。在此,美国斯克利普斯研究所Keary M. Engle 教授课题组报道了镍/富马酸二甲酯(DMFU)催化下,实现烯烃1,2-二芳基化反应,其中磺酰胺作为有效且通用导向基团,可进一步进行相关的N-官能团化反应。
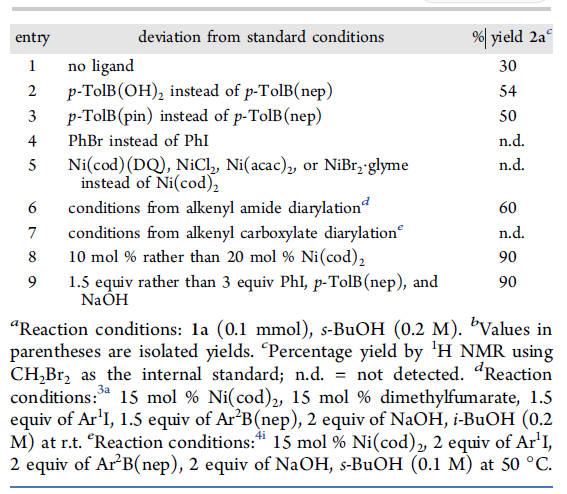
首先,作者以1、碘苯和p-TolB(nep) 作为底物,对导向基团以及反应条件进行了筛选(Table 1)。反应的最佳条件为:使用具有磺酰胺导向基团的底物,以20 mol % Ni(cod)2为催化剂, 15 mol %DMFU为配体,NaOH为碱,可在s-BuOH溶剂中室温反应,即可获得90%收率的目标产物2a。
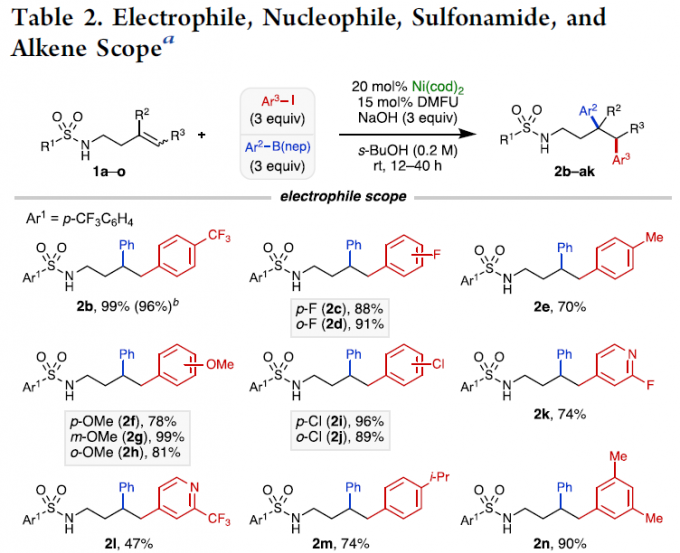
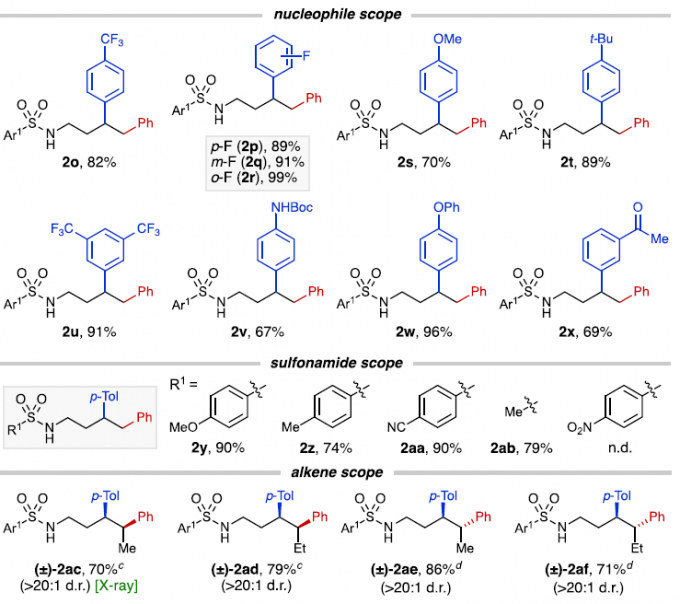
在获得上述最佳反应条件后,作者对底物进行了扩展(Table 2)。首先,在对芳基碘化物的扩展时发现,芳基碘化物的对位具有吸电子基团(如2b,2c,2i)比具有电中性和给电子基团(2e,2f,2m)的收率高。但对于甲氧基取代时,间位(2g)收率高达99%。同时,缺电子的2-氟-4-碘吡啶(2k)产率良好,而4-碘-2-(三氟甲基)吡啶(2l)产率中等。其次,在对硼酸酯的亲核范围扩展时发现,对位(2o–2p,2t)上具有吸电子基团和弱供电子基团的产率很高。同时,对位上给电子基团的改变,对收率影响很大,如2s,2v,2w。而在间位和邻位(2q,2r,2u,2x)带有吸电子基团的芳基硼酸酯,也能获得中等至极好的收率。随后,在对磺酰胺的底物范围扩展时发现,对位含有甲基、甲氧基、氰基的苯磺酰胺(2y–2aa)以及甲基磺酰胺(2ab)均可顺利进行反应。然而,对于对位含有硝基的苯磺酰胺却未发生反应,可能是由于硝基对Ni催化剂活性存在潜在的抑制作用。此外,在对烯烃底物扩展时发现,(Z)-和(E)-构型的内烯烃均与体系兼容,从而获得相应的产物(±)-2ae–2af。
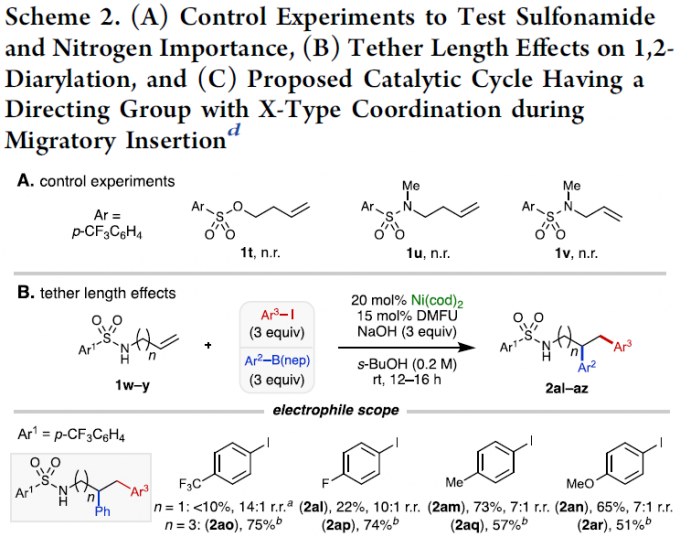
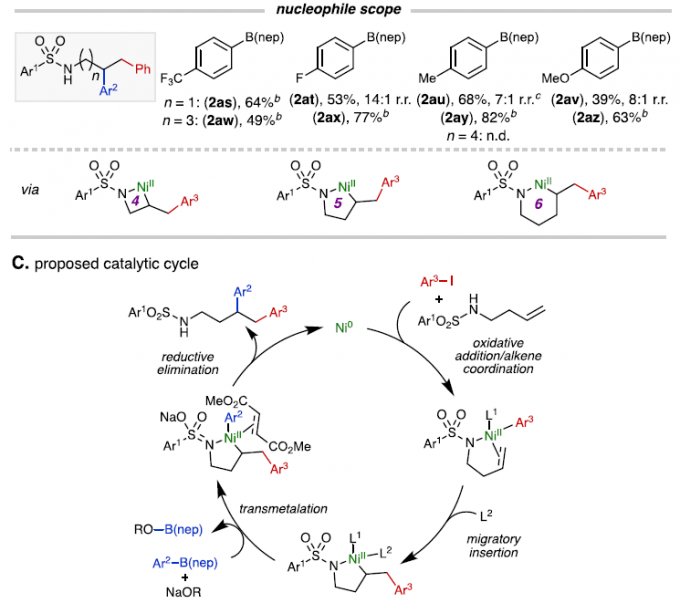
紧接着,以芳基磺酸酯1t和N-甲基磺酰胺1u和1v进行相关的对照实验时,反应均未发生,从而表明NH部分对于转化至关重要(Scheme 2A)。其次,在对于具有不同链长度的烯烃与不同亲电试剂和亲核试剂反应时发现,缺电子的芳基碘化物收率低但区域选择性好(2al),电中性和给电子的芳基碘化物收率高但区域选择性低(2am和2an)。对于受保护的戊烯基胺底物(2ao–2ar),缺电子和给电子的芳基碘化物均能给出中等至良好的产率,并具有极好的区域选择性。同时,对于缺电子的硼酸酯(2as和2at)具有更高的收率和区域选择性。而用受保护的戊烯基胺底物(2aw–2az),可获得中等至优异的产率和出色的区域选择性。然而,对于己烯基胺底物,未能发生反应,可能是由于形成不利的七元镍环导致(Scheme 2B)。此外,作者提出了一种可能的反应机理(Scheme 2C)。首先,镍(0)氧化加成到芳基碘键,再与烯基胺中的烯烃配位,形成NiII配合物。随后,L2经迁移插入形成五元镍环配合物。最后,经转金属化和还原消除,即可获得目标1,2-二芳基化产物。
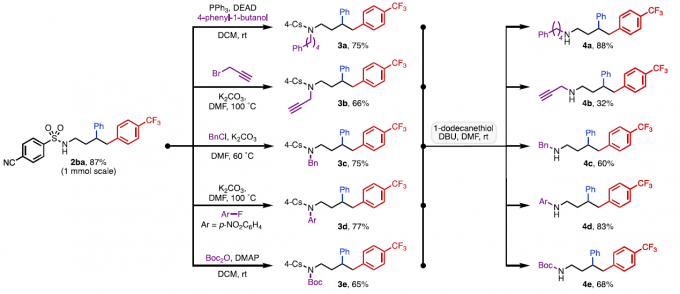
为了进一步证明反应的实用性,作者进行了相关的后期修饰(Scheme 3)。首先,将二芳基化产物2ba放大量进行实验,获得87%的收率,与预期一致。其次,二芳基化产物可进行多种N-官能化反应,如Mitsunobu偶联、炔丙基化、苄基化、SNAr和Boc保护反应,从而获得以中等至良好收率的N-功能化的产物3a–3e。然后经脱保护后,可以形成相应的仲胺化合物4a-4e。
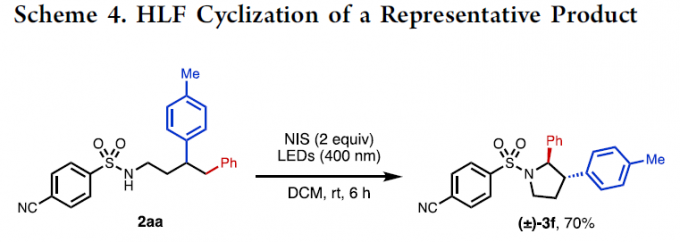
此外,紫光引发的Hofmann-Löffler-Freytag(HLF)环化反应,以良好的收率获得受保护的吡咯烷(±)-3f,并且两个芳基处于反式构型(Scheme 4)。
总结
美国斯克利普斯研究所Keary M. Engle 教授课题组报道了通过Ni催化,实现烯基胺(芳基磺酰基保护)与芳基碘化物和芳基硼酸酯的1,2-二芳基化反应,具有广泛的底物范围、高收率、优异的区域和非对映选择性等优点。同时,游离磺酰胺的NH对于反应至关重要。此外,作者通过相关的N-官能团化以及脱保护步骤,可以合成出具有价值的仲胺化合物,进一步证明了反应的实用性。



















No comments yet.