本文作者:孙苏赟
第八部分 脱羧反应,Ni/Pt催化,Mo/W催化和Fe/Ru催化
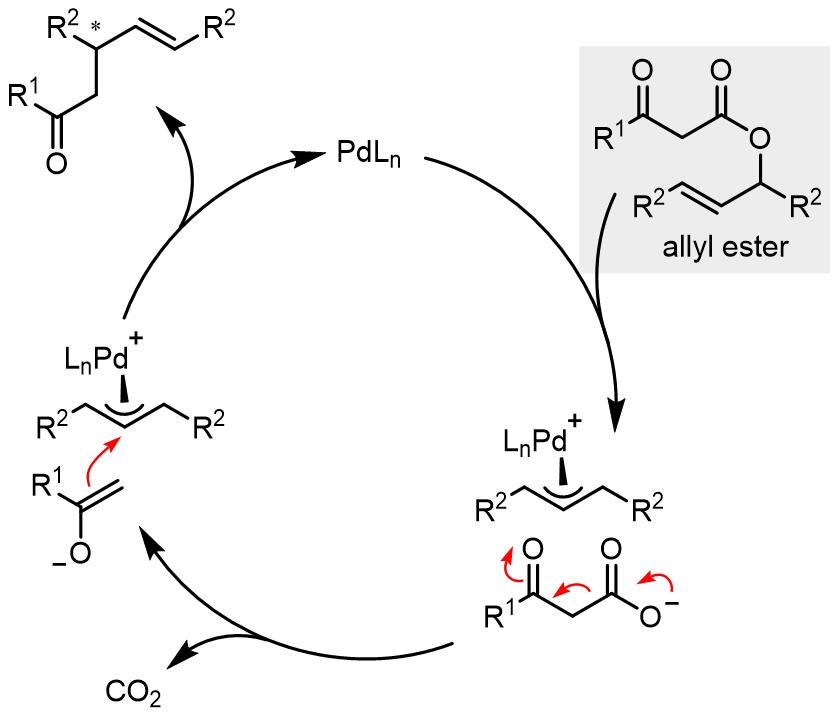
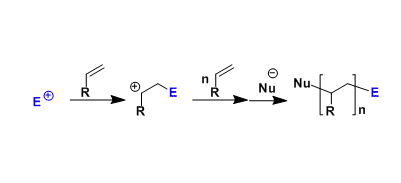
1. 烯丙醇酯的脱羧–烷基化反应
由于烯丙醇酯结构的的特殊性,在底物氧化加成后,会得到烯丙基-过渡金属配合物和一个可以发生CO2挤出的负离子,在CO2脱离反应体系后会产生具有亲和性的烯醇负离子进攻烯丙基而完成烯丙基上的C-C键形成的过程:
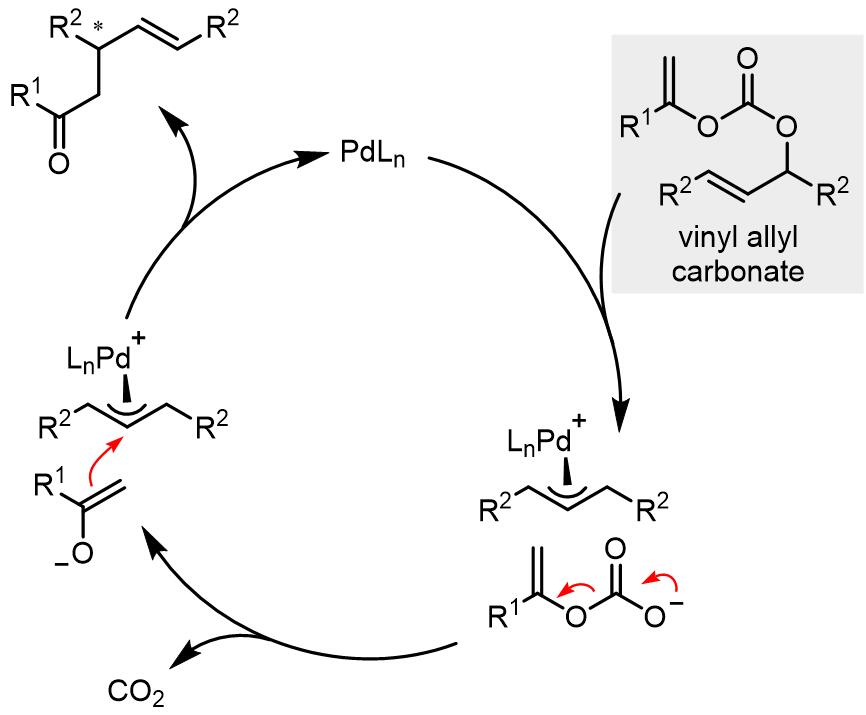
乙烯基烯丙基草酸酯也可以完成类似的转化:
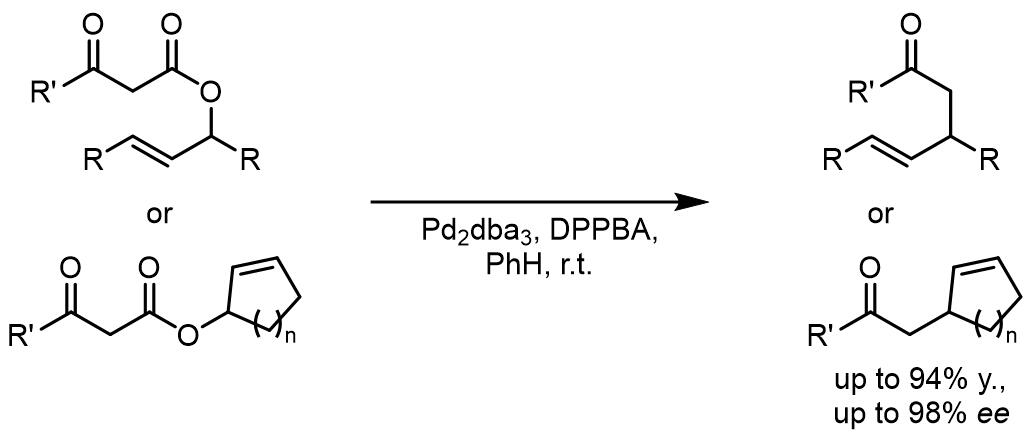
类似的,DPPBA类配体是最早开发的配体,它们作用下的反应立体化学选择性也不错,这也是第一例报道的烯丙基醇酯的脱羧-烷基化反应[1]。反应中发现,脱羧过程可能发生在亲核试剂加成之前,并且亲核试剂的加成会发生在过渡金属络合的异侧。
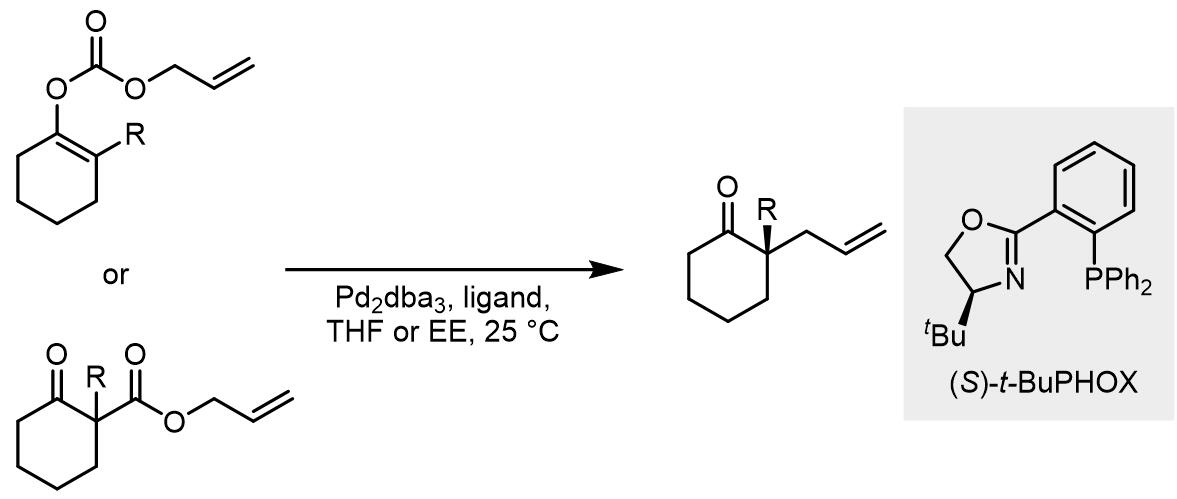
第一例烯丙醇碳酸酯的不对称脱羧-烷基化反应中使用的配体则是PHOX类配体,PHOX类配体对此类反应的效果极好,反应适用于多种α-取代的环酮,生成一个季碳手性中心[2]。此反应体系也适用于β二羰基化合物的转化[3]:
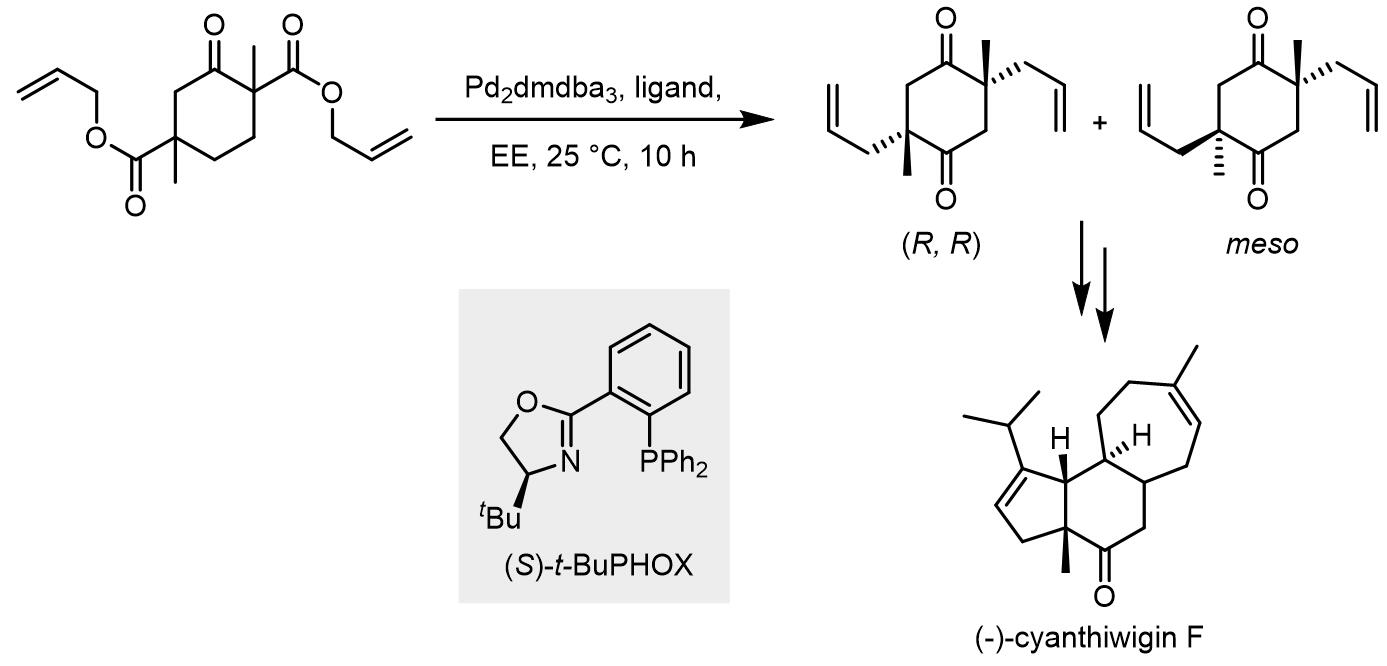
基于此转化,Enquist和Stoltz将此作为(–)-cyanthiwigin F的全合成中的关键步骤,并且进行了双位点的脱羧-烷基化[4]:
2. 镍催化的环状烯丙基化合物的Tsuji-Trost烷基化
对于环状烯丙基化合物,如果使用β-二羰基作为软亲核试剂,镍催化可以实现转化,但是立体化学选择性不是很好[5]。
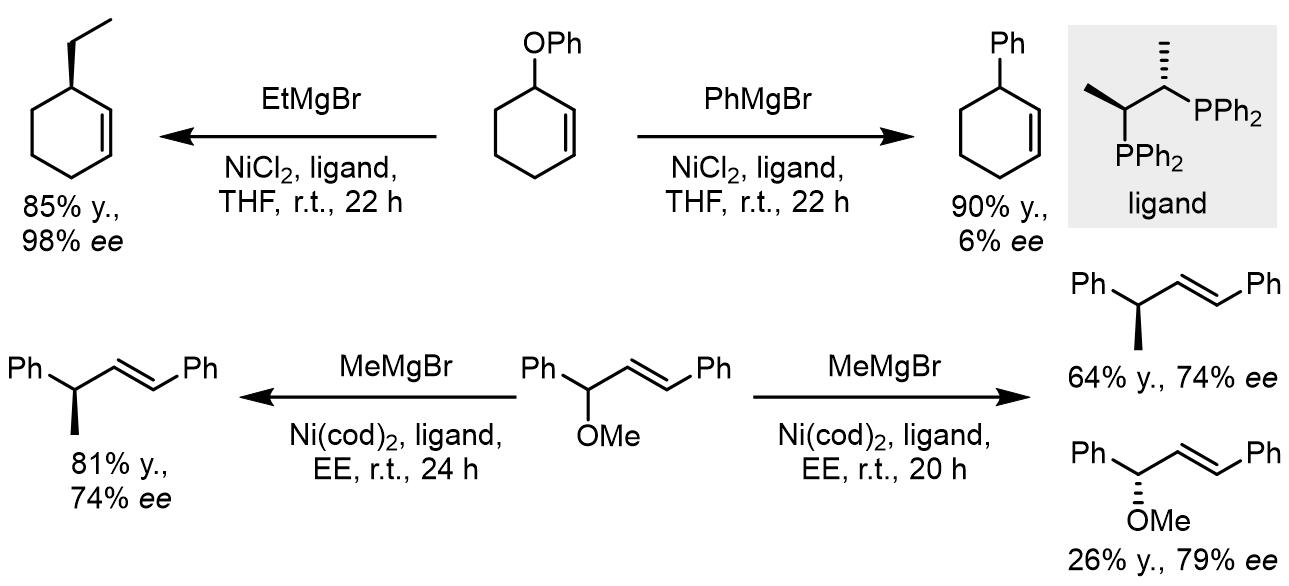
而对于镍催化,可以使用一些有机金属催化剂作为硬亲核试剂,但是这里反应底物中的离去基团可以使用OPh, OMe等结构[6]:
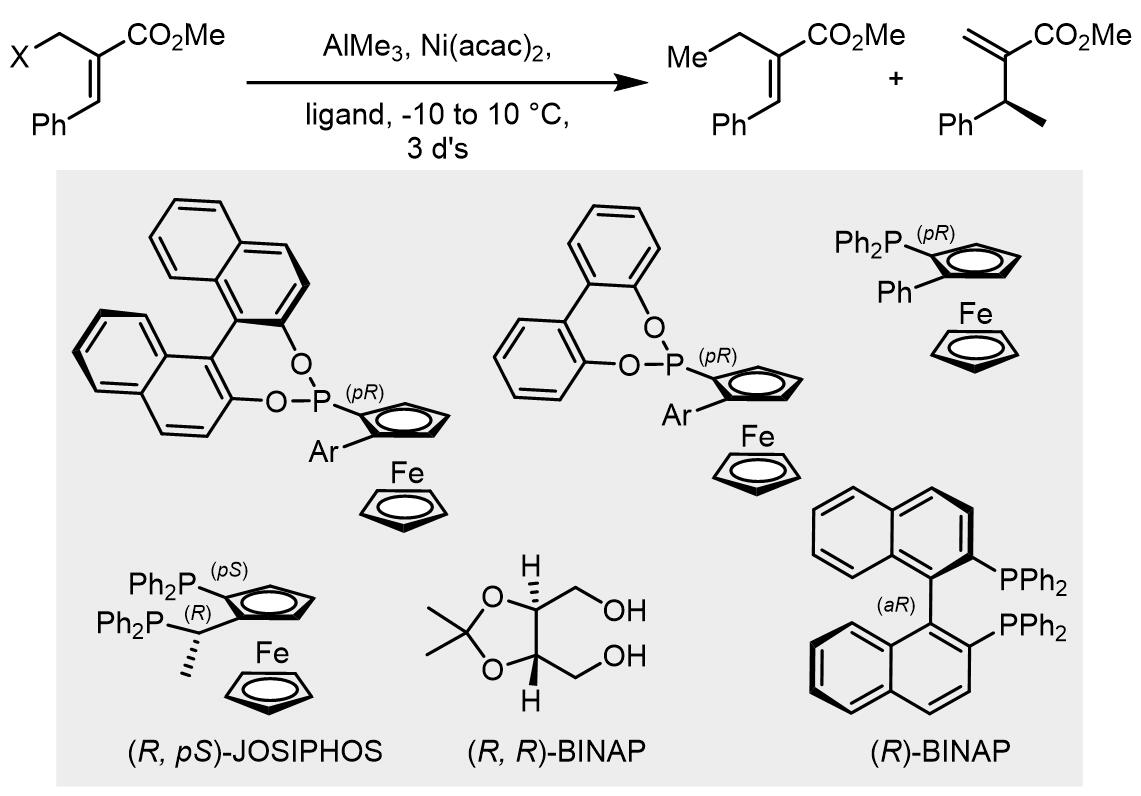
烷基铝试剂作为亲核试剂:
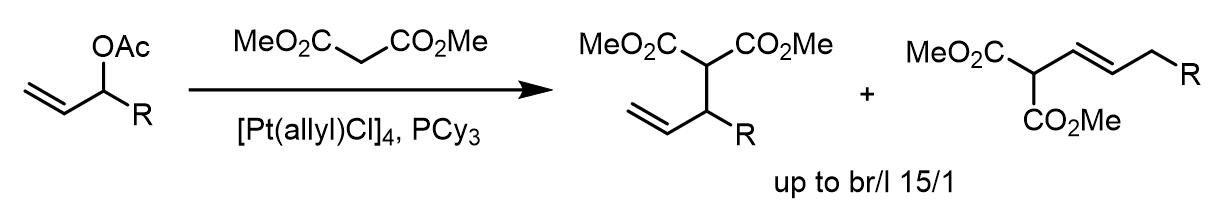
3. 铂催化的Tsuji-Trost烷基化
相比于Pd催化,Pt催化的研究和报道就非常少了。但是Pt的烯丙基配合物显示出和Pd烯丙基配合物不同的性质,Pd-烯丙基配合物中亲核试剂在大多数情况下会进攻位阻更小的端位碳源自,而Pt-烯丙基配合物则是倾向于生成枝状产物。
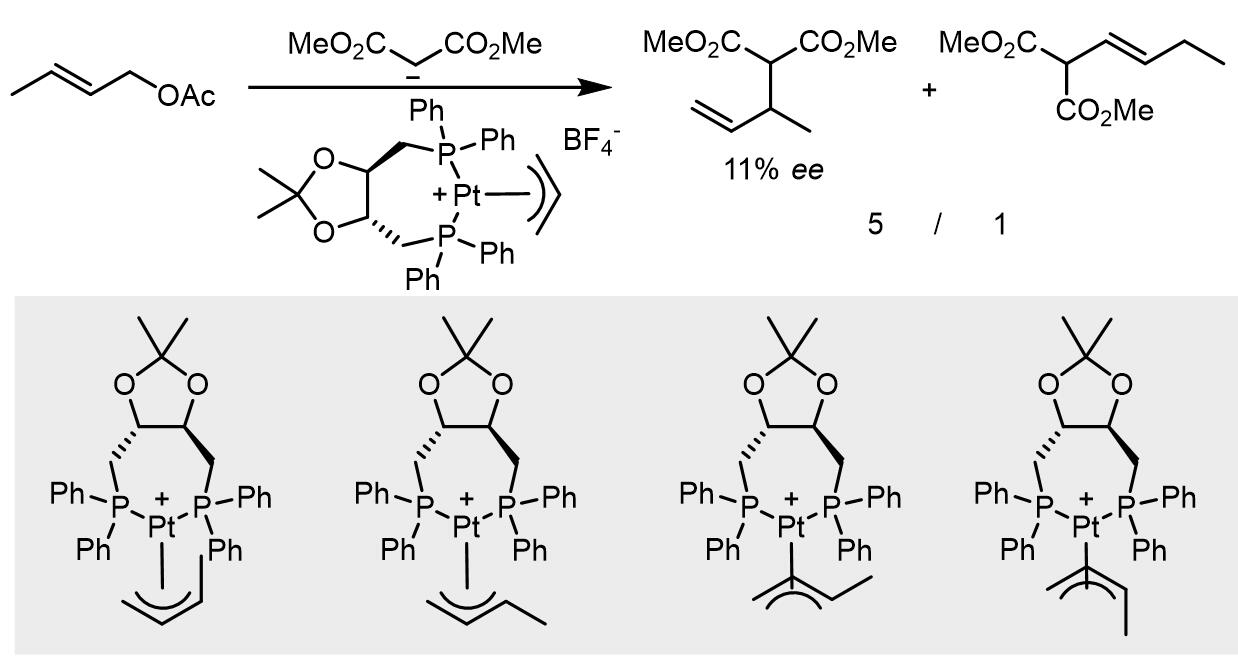
Brown和McIntyre发现DIOP类配体可以很好的用于Pt催化的反应[7],原位核磁研究发现中间体可以有四种不同的形式,并且这四种配合物都可以和亲核试剂反应,但是速率会有所不同,这也可以解释br/l和ee值都不高的原因:
4. 钼催化和钨催化的Tsuji-Trost烷基化
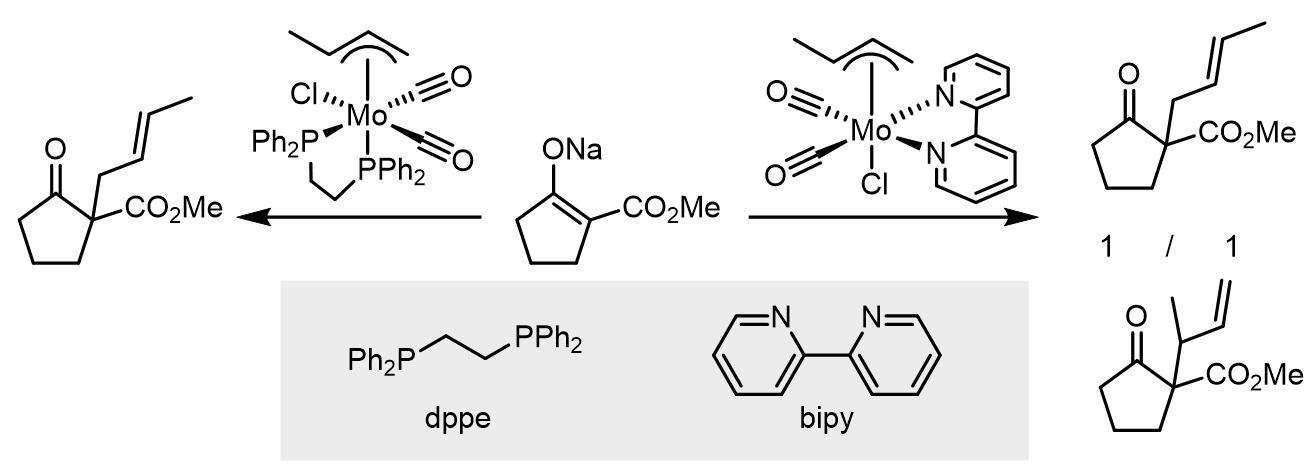
Mo-烯丙基配合物是最一开始显示出区域选择性的催化剂之一。Mo元素的功能非常广,其价态可以从-4到+6,配合物配位数也从4到8不等。早期的研究中使用的配体是dppe和bipy类,这两个配体一个是供电一个吸电,这样导致了两个反应的区域选择性不同。
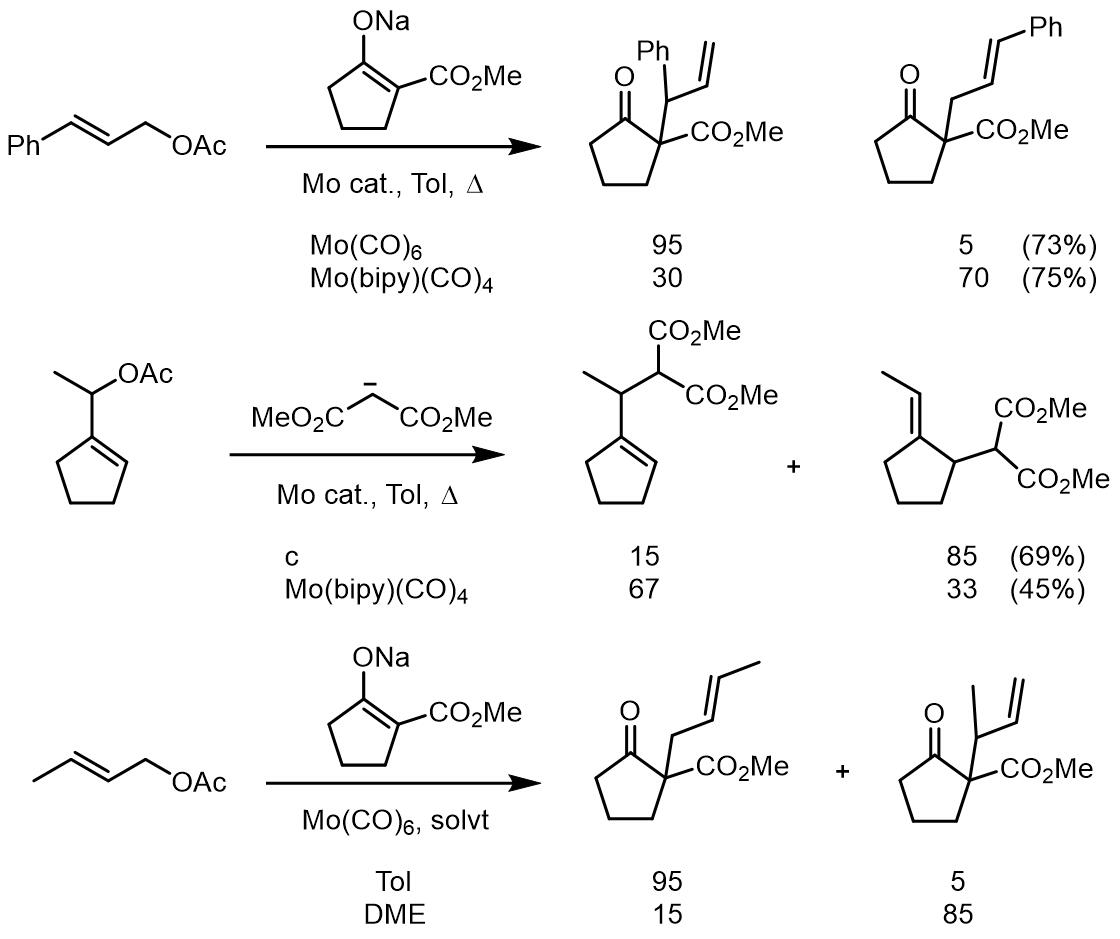
后来,一些Mo配合物,例如Mo(dppe)(CO)4, Mo(TMEDA)(CO) 4,被证明在Tsuji-Trost反应中的表现并不好,但是发现Mo(CO)6和Mo(bipy)(CO) 4的效果却很好,并且在反应中是需要5-20 mol%的当量即可。
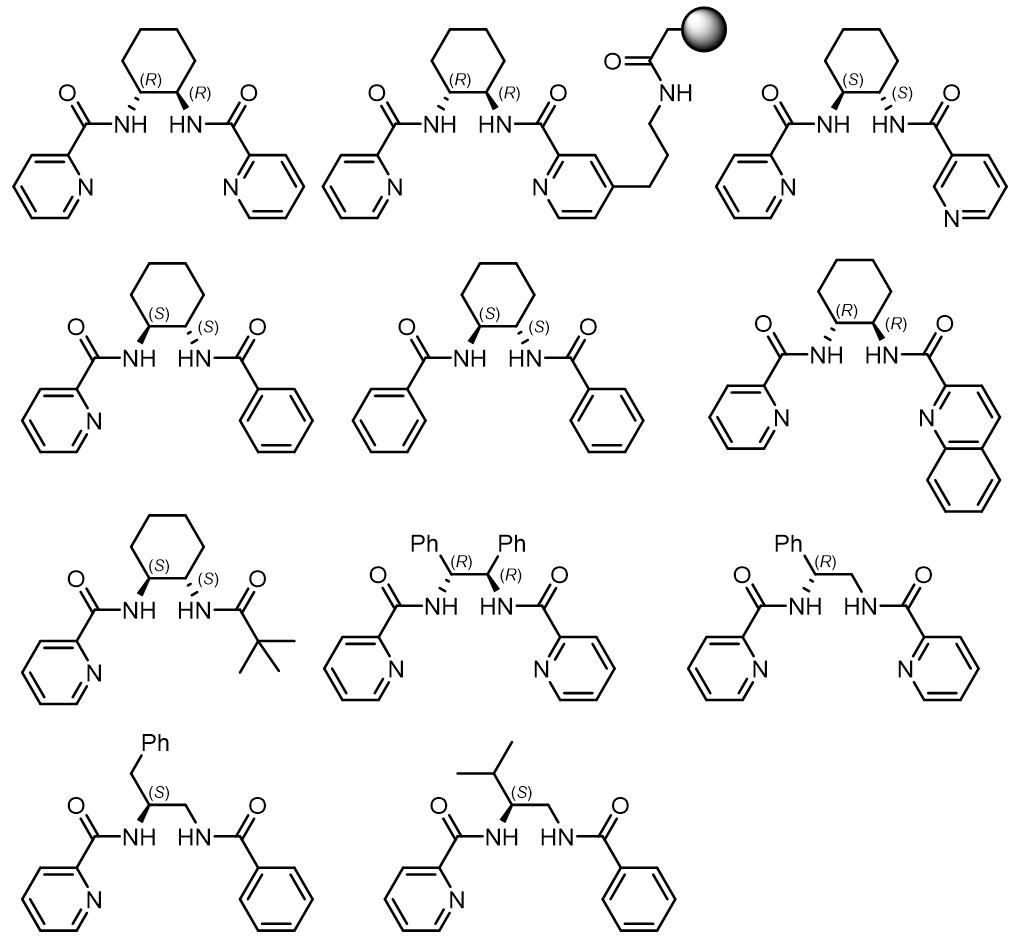
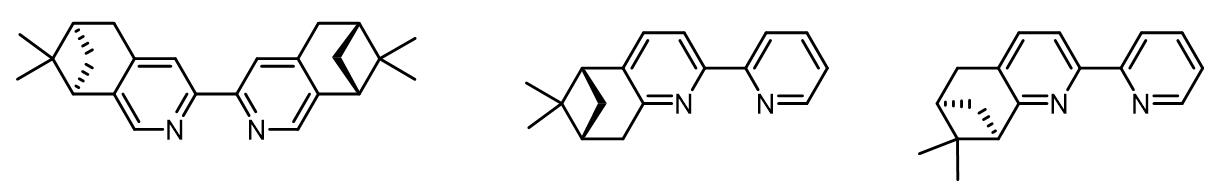
对于不对称的Mo催化烯丙基烷基化反应,常用的配体有以下几种:
(1) 吡啶酰胺类
(2) 二噁唑啉类
(3) bipy类配体
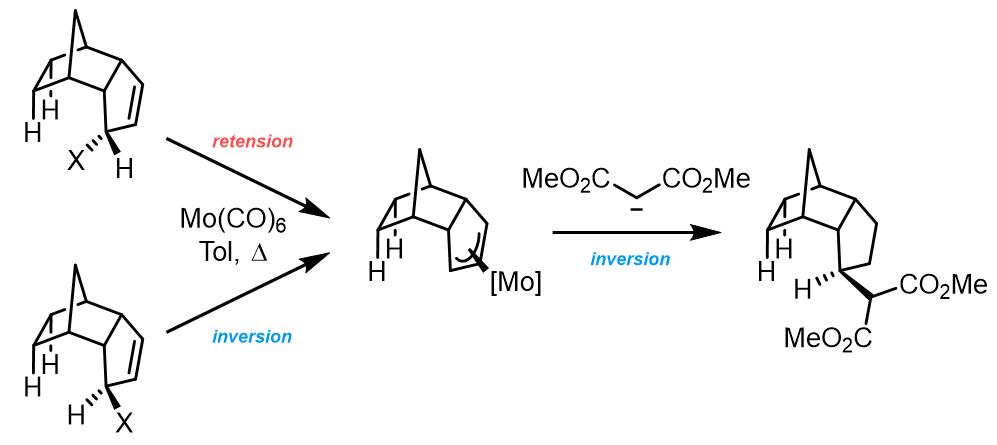
和Pd催化相比,Mo催化的研究比较少,又因为Mo具有更高的配位数,因此机理也就更复杂。和Pd-烯丙基配合物相似,Mo-烯丙基配合物也可以实现之前所说的σ-π-σ异构化。比较特殊的是Mo-烯丙基配合物在亲核试剂进攻时,会发生过渡金属中心的翻转[8]:
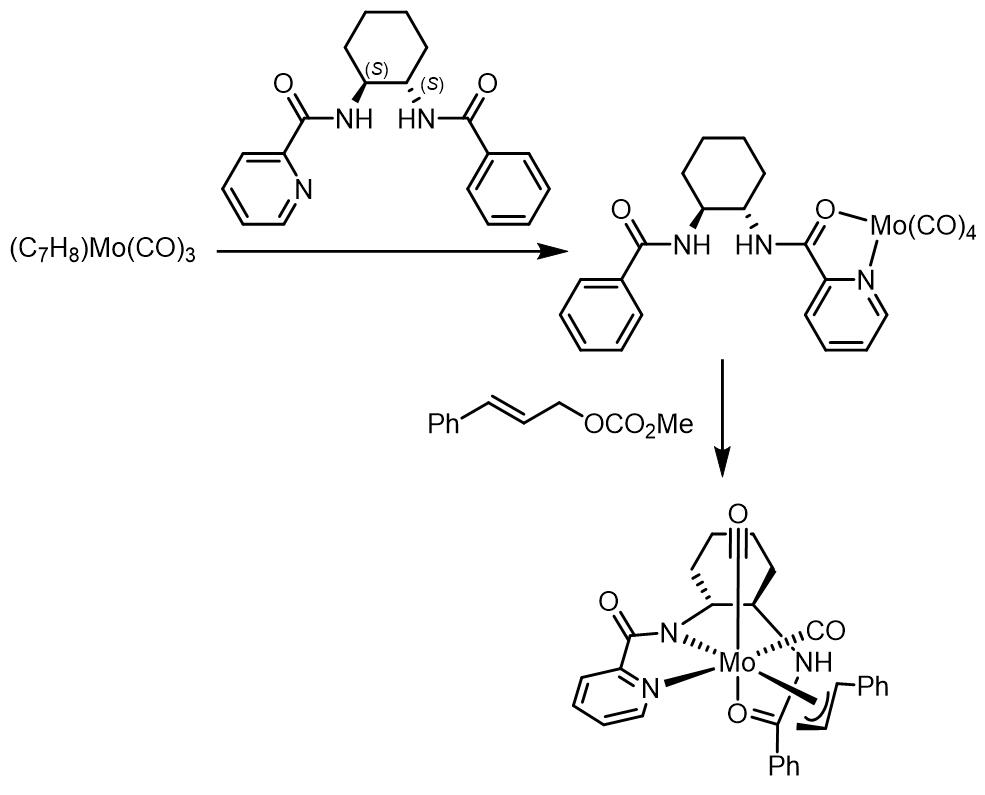
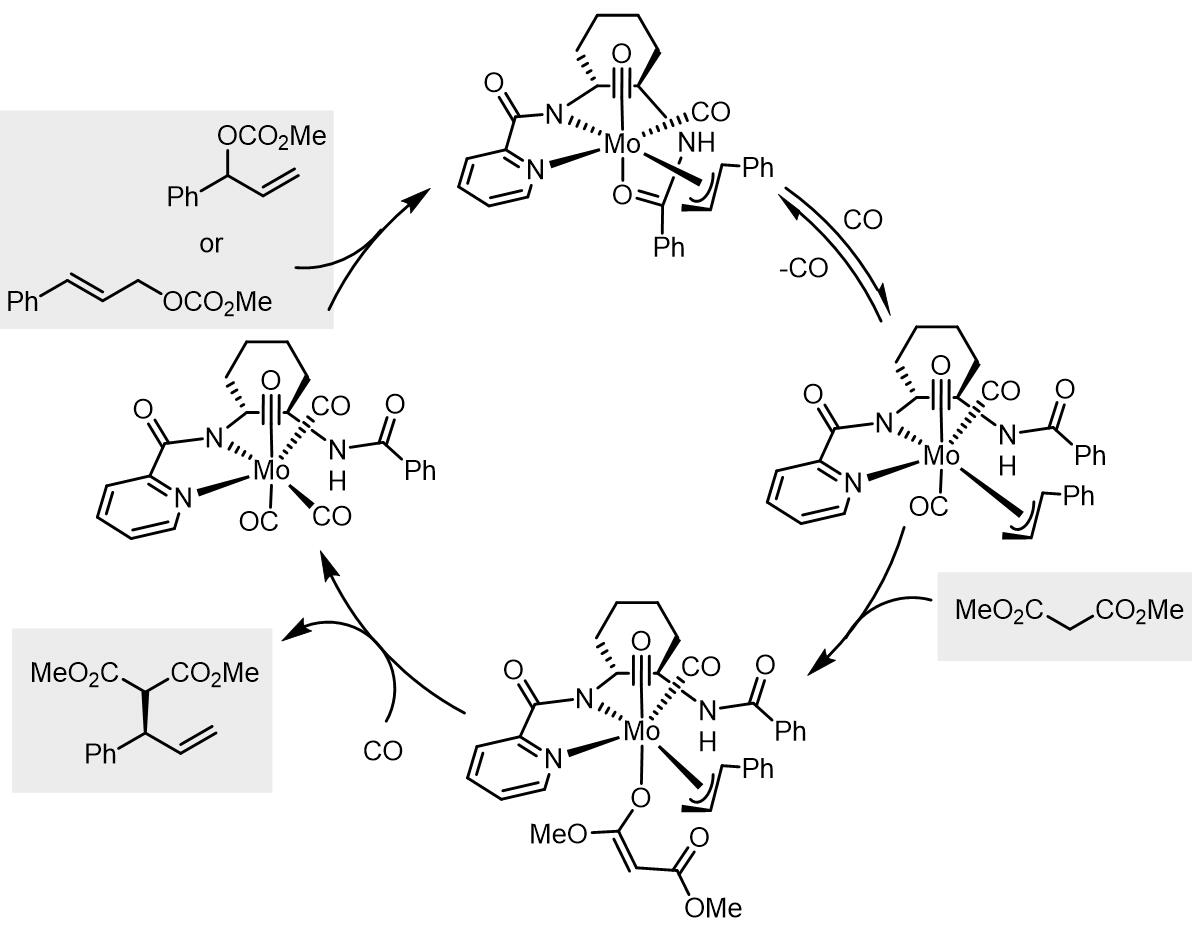
在bipy配体下,Trost通过单晶结构确认了Mo-烯丙基-吡啶酰胺类配体配合物的结构[9]:
因此给出了以下的循环催化过程:
如果使用二噁唑啉类配体,活性催化物种的结构有所不同:
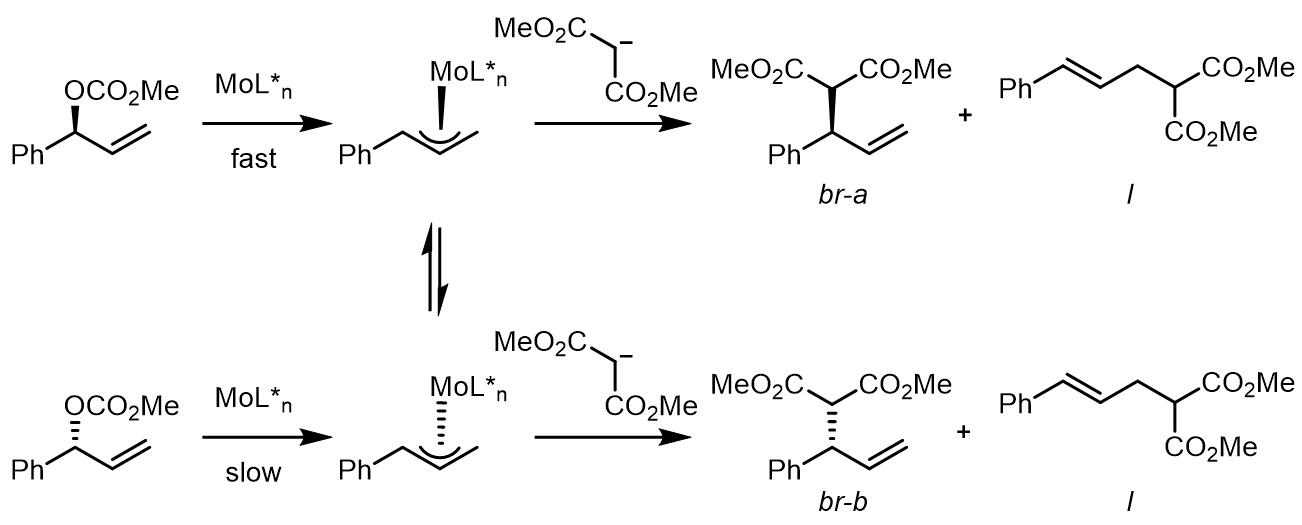
另外,Mo催化的反应体系中存在平衡[10],在动态动力学拆分中,一对对映异构体都可以参与反应而转化成产物,但Mo催化得到的产物一般也是枝状产物居多,但是反应具体的对映异构选择性有会随着配体的使用而有所不同。
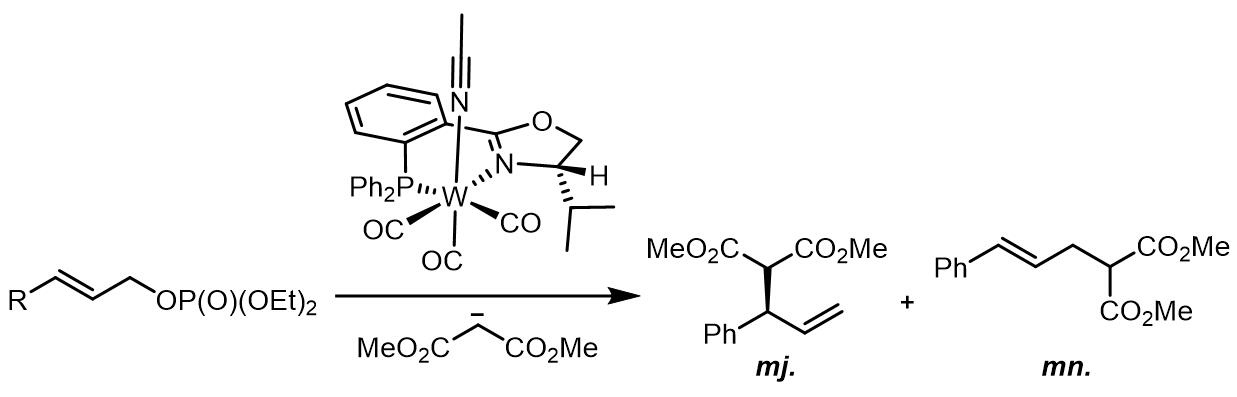
同在VI族的元素W催化的Tsuji-Trost反应性质也是类似的,反应倾向于得到枝状产物。但是产物的效率和离去基团的关系比较大,一般使用的是碳酸酯和磷酸酯作为离去基团。如果使用PHOX类配体,也可以实现不错的不对称烯丙基烷基化。
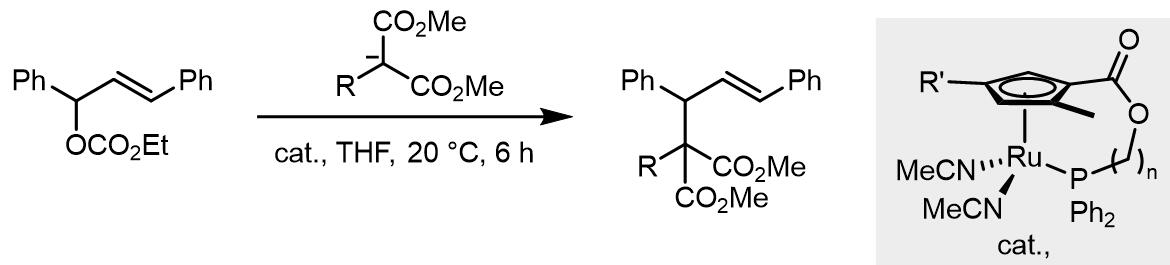
5. 铁催化和钌催化的Tsuji-Trost烷基化
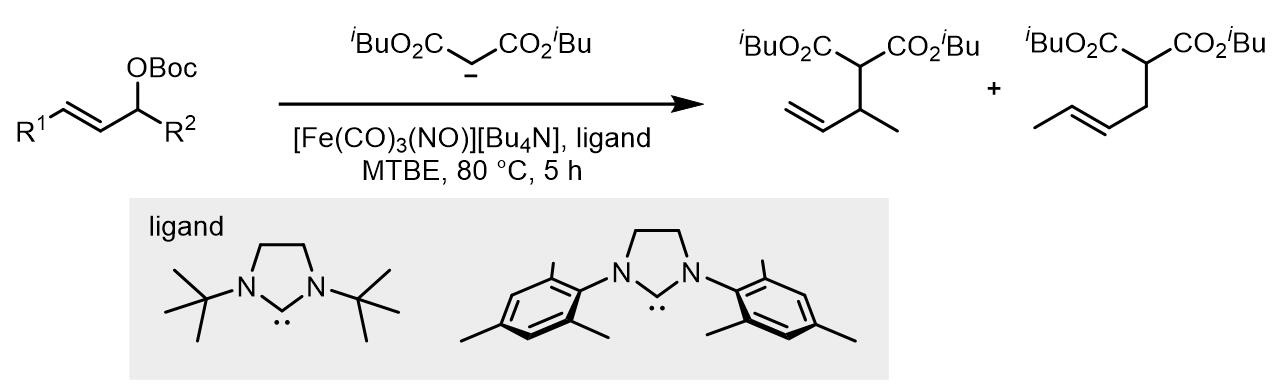
Fe元素因为其低廉的价格和很小的毒性深受催化领域的喜爱。在贴催化的Tsuji-Trost反应中,膦配体的效果不太理想,更常使用NHC类配体以大幅改变中心金属上的电子密度。
而钌催化使用的则是另外一种配体[11]:
References
- [1] Org. Lett. 2004 , 6 , 4113 – 4115. DOI: 10.1021/ol048149t
- [2] J. Am. Chem. Soc. 2004 , 126 , 15044 – 15045. DOI: 10.1021/ja044812x
- [3] Angew. Chem. Int. Ed. Engl. 2005 , 44 , 6924 – 6927. DOI: 10.1002/anie.200502018
- [4] Nature 2008 , 453 , 1228 – 1231. DOI: 1038/nature07046
- [5] Tetrahedron Lett. 1996 , 37 , 6105 – 6108. DOI: 1016/0040-4039(96)01302-0
- [6] Tetrahedron Lett. 1997 , 38 , 1713 – 1716. DOI: 1016/S0040-4039(97)00178-0
- [7] J. Chem. Soc. Perkin Trans. 2 1985 , 961 – 970. DOI: 10.1039/P29850000961
- [8] J. Org. Chem. 1987 , 52 , 1907. DOI: 10.1021/jo00386a004
- [9] Angew. Chem. Int. Ed. Engl. 2002 , 41 , 1929 – 1932. DOI: 10.1002/1521-3773(20020603)41:11<1929::AID-ANIE1929>3.0.CO;2-O
- [10] Chem. Pharm. Bull. 2002 , 50 , 1 – 14. DOI: 10.1248/cpb.50.1
- [11] J. Am. Chem. Soc. 2001 , 123 ,10405 – 10406. DOI: 10.1021/ja016334l
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.