本文作者:孙苏赟
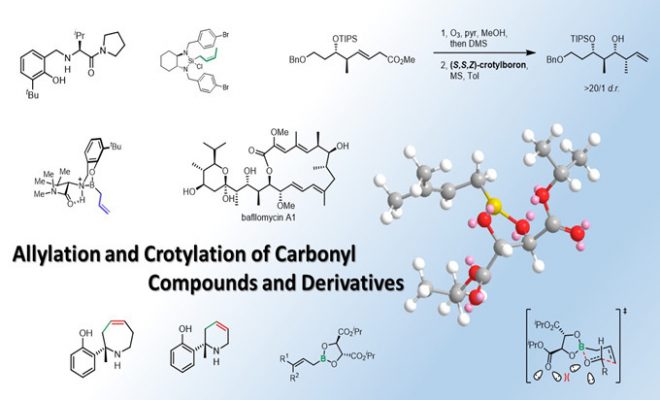
第六部分 硅试剂的烯丙基化和巴豆基化
1. Leighton烯丙基化和巴豆基化
在2000年,Leighton课题组报道了一例分子内连续两次的烯丙基化反应,并且反应具有较高的立体化学选择性:[1]
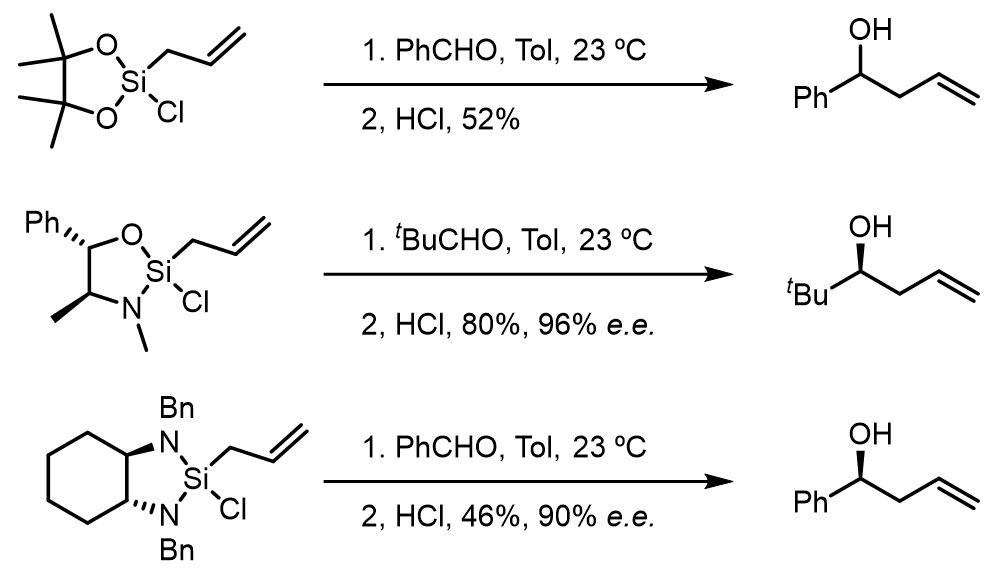
之后硅试剂中引入了电负性较大的元素后,反应可以在常温下自发的进行,且可以在硅试剂中引入手性片段而实现反应的对映异构选择性:
硅试剂的制备也非常方便,一种是伪黄麻碱作为手性官能团,但是硅的d.r.值只有2/1,另一种是使用C2-轴对称的二胺作为手性配体:
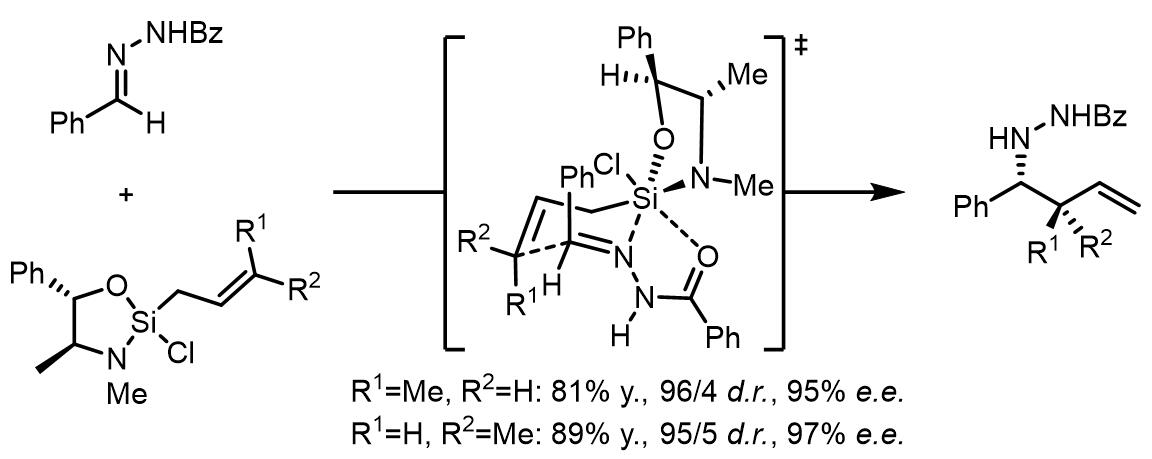
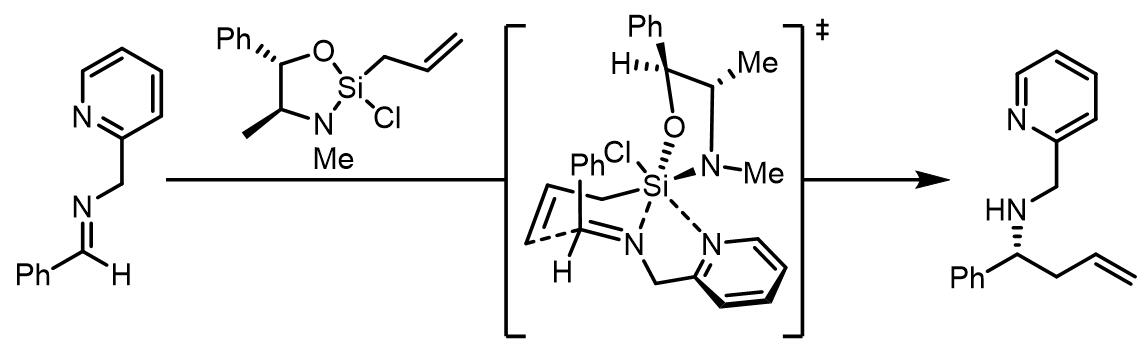
合成中腙类和肟类化合物的烯丙基化:[3]
腙的烯丙基化的立体选择性比较好,但是可以发生类似过渡态的腙衍生物的立体化学选择性却很差,只有50% e.e.:
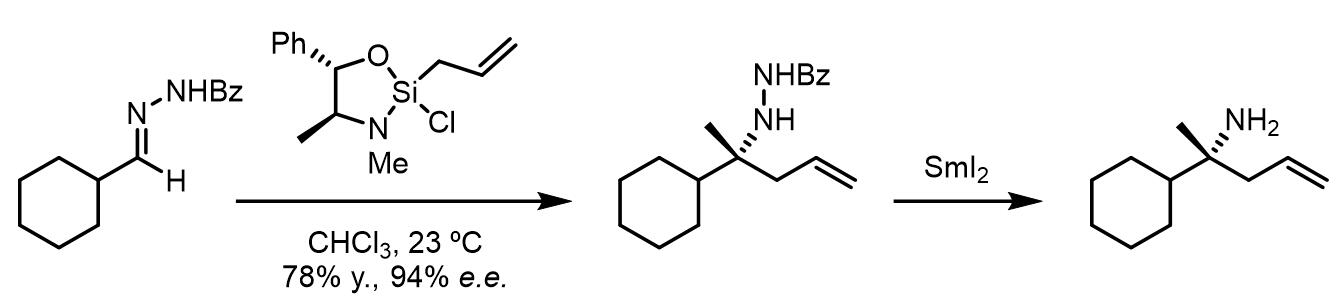
反应在脂肪酮腙底物上也可以不错的立体选择性,反应的产物经过SmI2还原即可得到胺:[4]
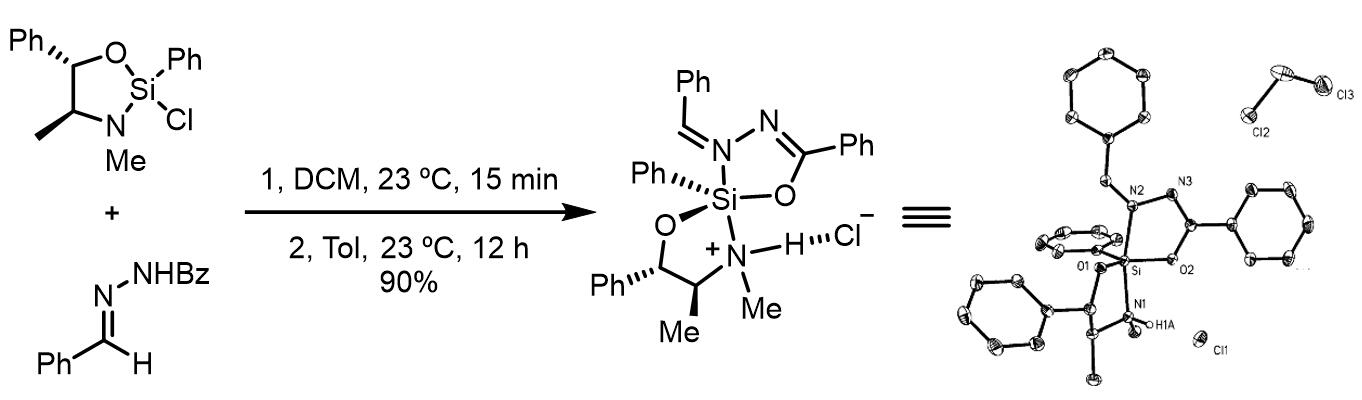
除了六元环过渡态,还有另外一种过渡态:
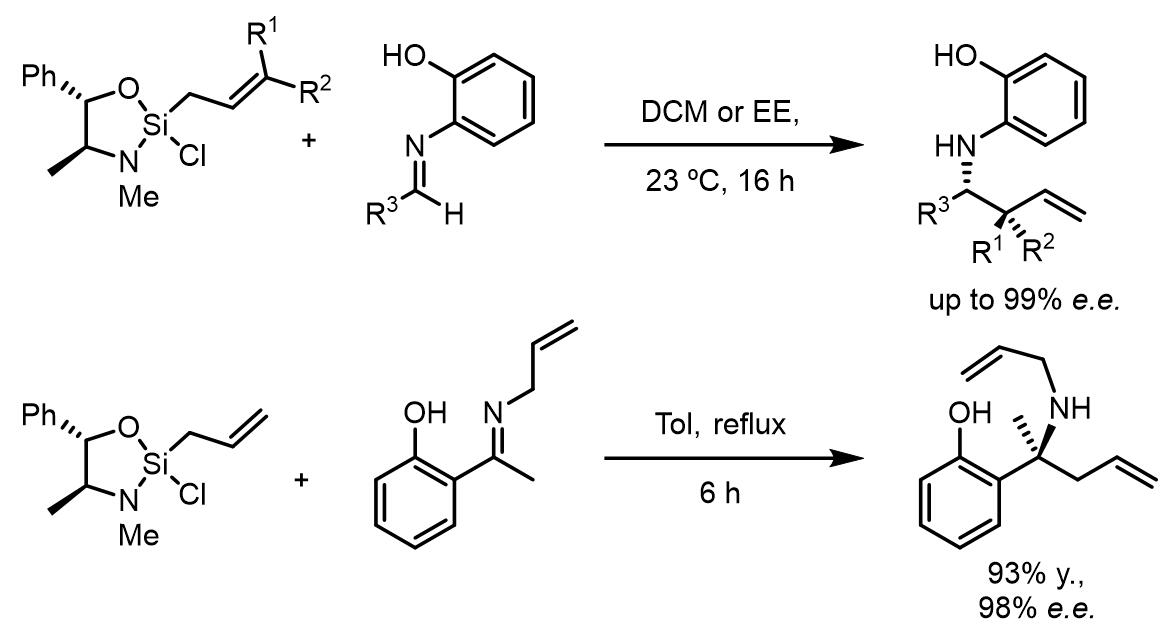
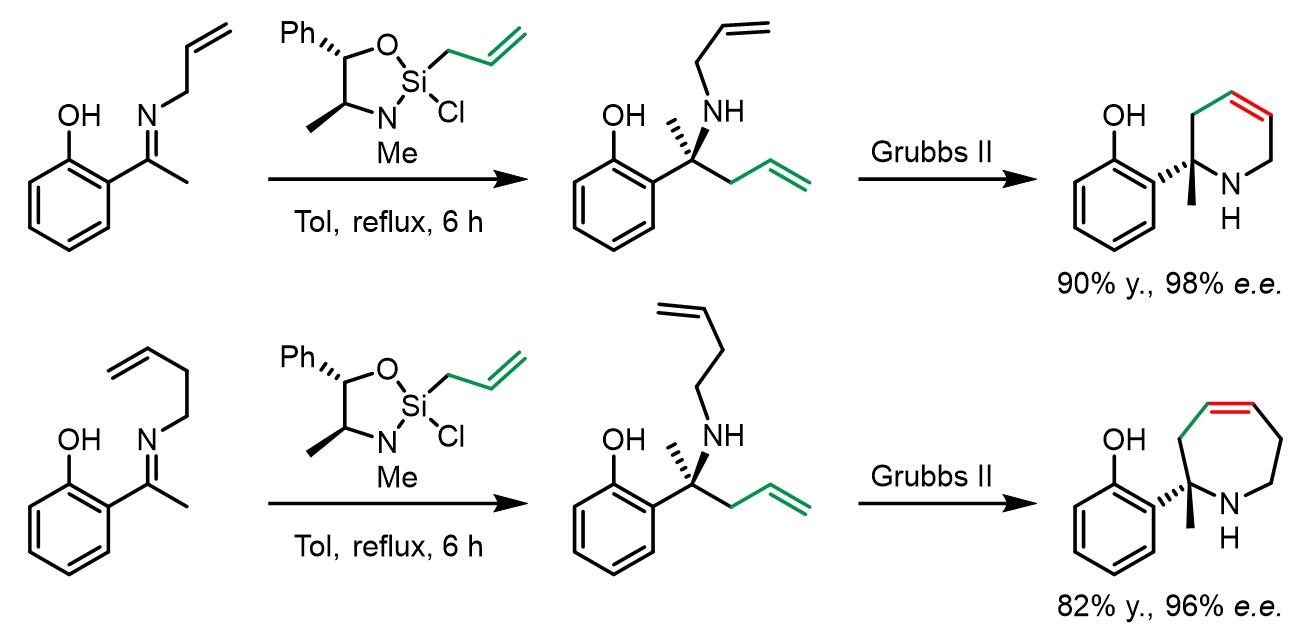
当邻苯酚基作为活化基团,也可以高效的实现对亚胺的烯丙基化:[5]
这个方法可以高效地、高对映异构选择性地用于合成含氮的杂环结构:
2. C2-对称的手性硅试剂烯丙基化和巴豆基化[6, 7]
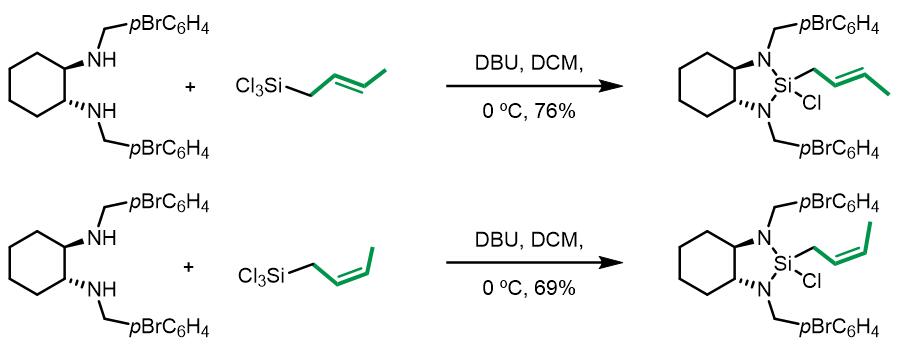
基于上述C2对称的手性二胺合成的手性硅试剂,后续又开发出了具有更好立体选择性用于烯丙基化和巴豆基化的手性硅试剂:
此类手性硅试剂的制备也是从手性二胺出发:
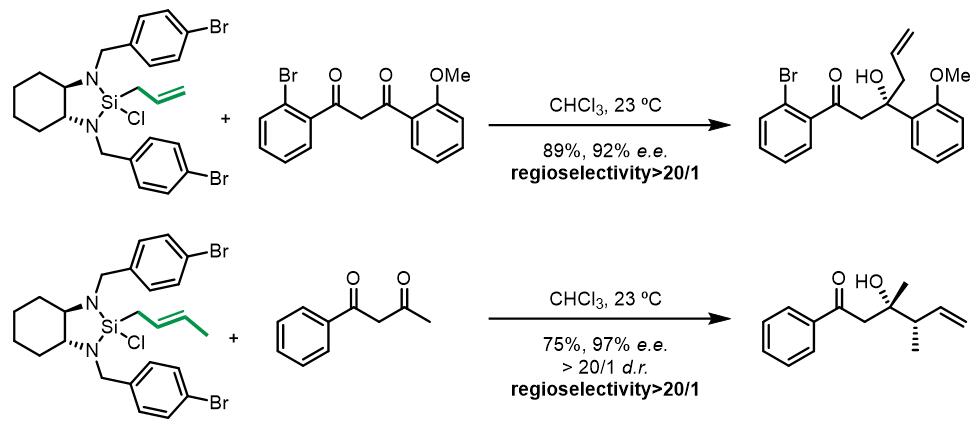
这类硅试剂也可以用于β-二羰基化合物的烯丙基化:[8]
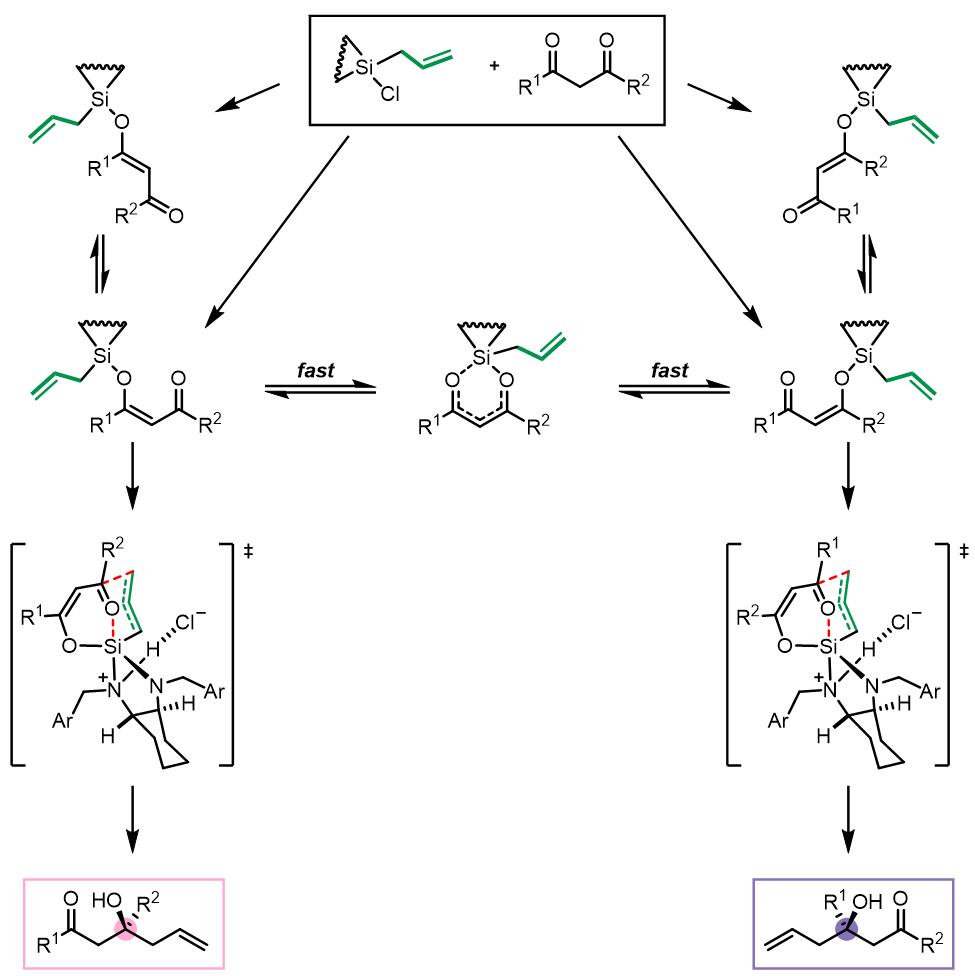
因为β-二羰基的结构,反应的两种区域选择性和两个面选择性使得中间体可能有四种可能的中间体:
由于底物的基团不同,反应会有些许不同:
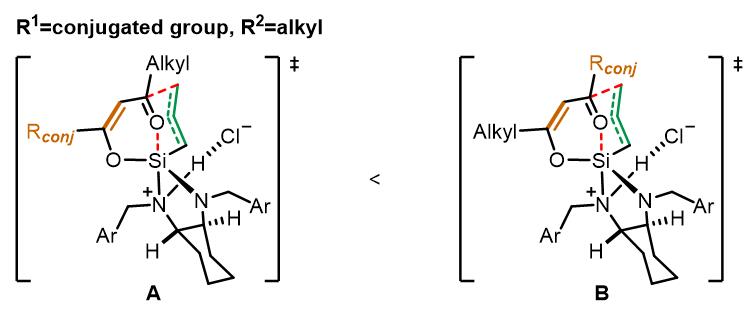
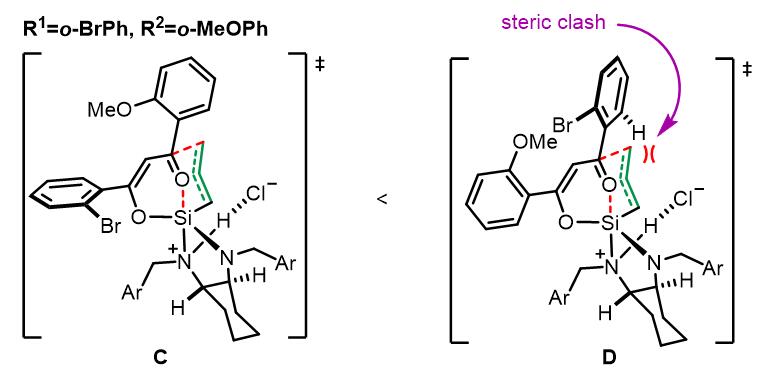
当底物中是共轭基团和烷基时,位阻效应不足以控制反应的区域选择性。由于共轭基团的作用,过渡态A的能量要比B低,因此反应主要由第二种过渡态进行。当底物均为芳基时候,位阻效应占主导。以邻溴苯基和邻甲氧基苯基为例:
References
- [1] J. Am. Chem. Soc. 2000, 122, 35, 8587-8588. Doi: 10.1021/ja002425r
- [2] J. Am. Chem. Soc. .2002, 124, 27, 7920-7921 Doi: 10.1021/ja0264908
- [3] J. Am. Chem. Soc. 2003, 125, 32, 9596-9597 Doi: 10.1021/ja035001g
- [4] J. Am. Chem. Soc. .2003, 125, 32, 9596-9597 Doi: 10.1021/ja035001g
- [5] Org. Lett. .2006, 8, 26, 6119-6121 Doi: 10.1021/ol062589y
- [6] Angew. Chem., Int. Ed. 2003, 42, 946–948. Doi: 10.1002/anie.200390252
- [7] Org. Lett. 2004, 6, 23, 4375-4377 Doi: 10.1021/ol0480731
- [8] Org. Lett. 2006, 8, 26, 6119-6121 Doi: 10.1021/ol062589y
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


























No comments yet.