本文作者 孙苏赟
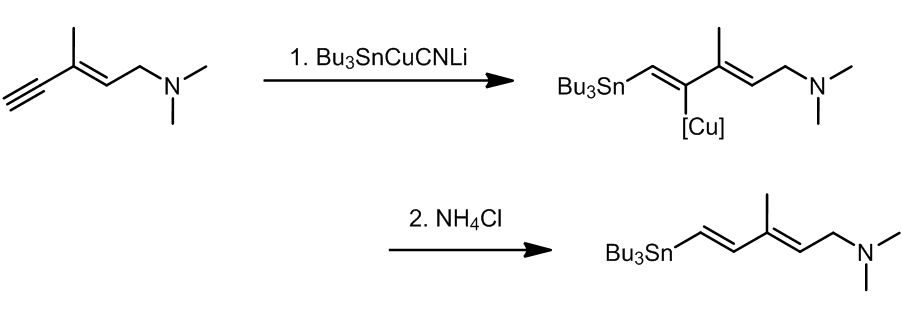
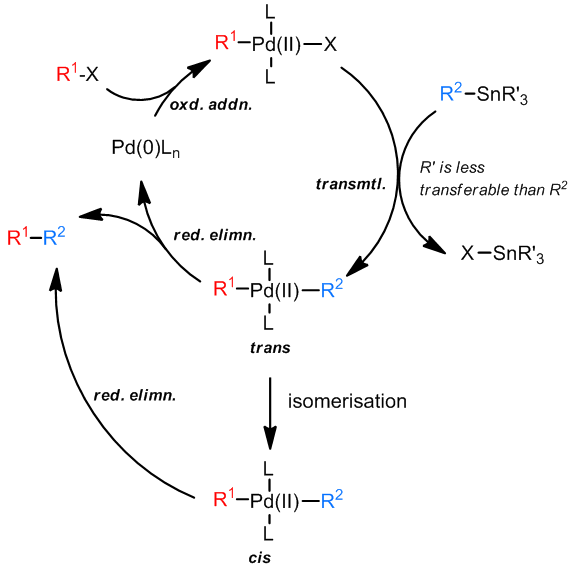
X为卤素或是磺酸酯类;对于底物的选择性,R1可以是芳基,烯基,但是苄基和烯丙基也是可以的,R2对于底物活性:炔基 > 烯基 > 芳基 > 苄基 > 甲基 > 烷基;作为稀释剂来说,R’应该是一个转移性较差的基团,以使得R2可以顺利的和金属发生相互作用;反应中也可以添加Cu+,LiCl以加速反应的发生。
在Stille反应中,有很多种可以使用的溶剂,并且反应中不需要碱的参与!对于锡试剂来说,即使是四烷基锡,例如Me4Sn或Bu4Sn,在反应中都会向催化剂金属转移烷基,即使是在高温也是如此,并且Pd(II)几乎不发生β-消除,并且Stille反应对于底物中官能团的忍耐性也很好。值得注意的一点是锡试剂的毒性大都很高,这在制备和使用锡试剂的过程中需要格外注意,甚至是在反应后期的提纯和处理工作中也是如此,对于含有-SnMe3的化合物尤是如此,-SnBu3化合物则相对较安全。
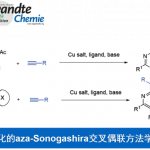
Stille反应的介绍:
施蒂勒反应(Migita-Kosugi-Stille Cross Coupling)
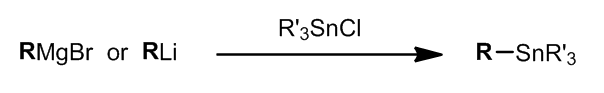
- 烷基锡试剂的制备
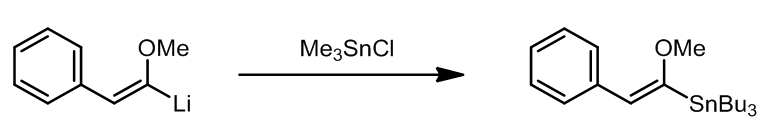
其中,R就是需要转移并且可以发生转移的基团。
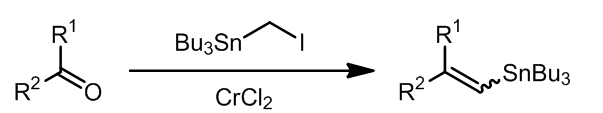
Takai反应是从醛酮化合物制得双键的方法,这个反应我在《碳碳双键的形成》中有详细的描述,请参见:XXXXXXXXXXXXXXXXXXXXX
几个例子:
这个反应中,因为三键的两侧链接的是不同的基团造成了选择性的差异。Joc 1990 1857
(6)Pattenden在后期对此类的反应进行了改进:Ref. 7
这个方法中,产生的中间体使得第二步的区域选择性和立体选择性非常好,这个步骤叫做Pattenden的改进,产生的乙烯基溴可以在原位转化成锡烷化合物: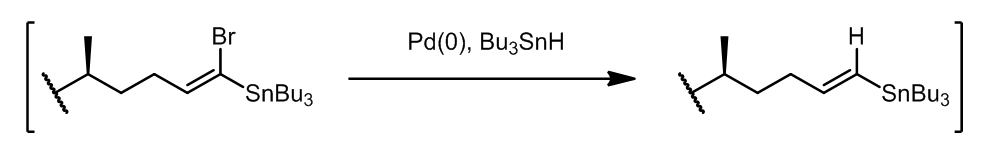
- 有机锡化物的偶联
有机锡试剂的偶联反应中,钯试剂作为催化剂也有着很广泛的应用。Farina对于配体在反应中的作用做了很深入的研究,得知三呋喃基磷 (tris(2-furyl)phosphine, TFP),或Ph3As类软碱化合物作为配体参与反应的效果最佳,因为他们可以加速中间体的转金属化过程。此外,碱,LiCl和CuI有时是反应中不可少的添加剂。总的来看,添加剂和配体在反应中的作用尚不十分清楚,反应的条件也没有较为统一的标准需要具体问题具体分析,需要根据实际情况进行调整。
对于这个反应的过程中,一般认为转金属化过程是没有Pd(IV)中间体参与的,因为这个氧化态的Pd元素是很不常见的,从机理上也可以看出反应不需要碱来帮助发生还原消除步骤。
此外,CuCl可以加速Stille偶联,特别是对于大位阻的锡烷化合物,可能的原因是因为反应中发生了烷基锡到烷基铜的转金属化过程,一次来加速ArPd(II)X的转金属化过程。Ref. 9
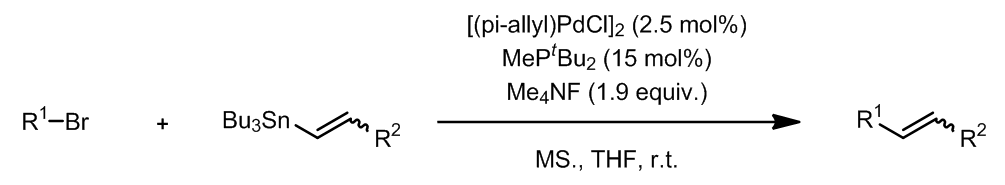
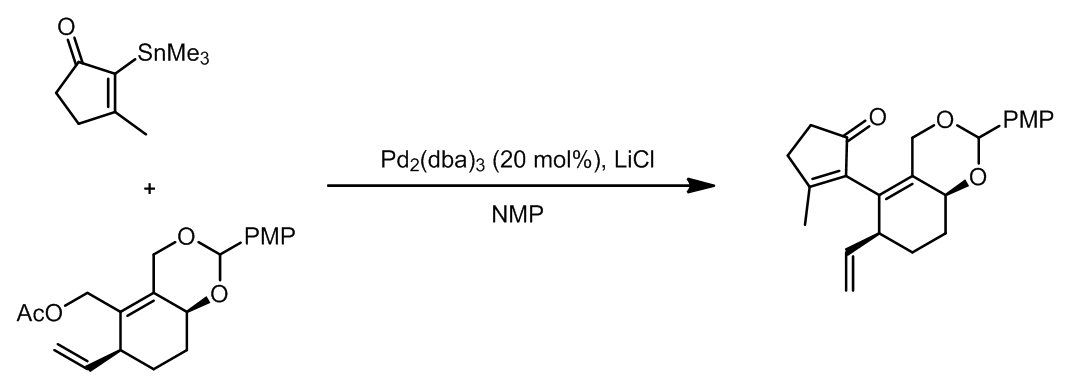
- Stille偶联的应用
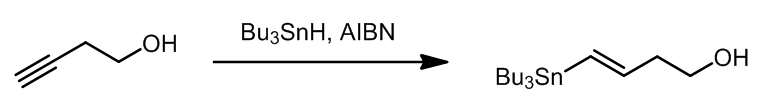
底物中虽然有羟基,但是这是不需要进行保护的,它不会影响反应的结果,并且底物和产物中双键的构型是一致的。
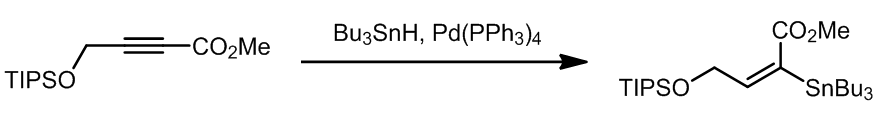
事实证明苯磺酸酯底物也是可以进行交叉偶联的,其中磺酸酯可以从酮经过烯醇变换再磺化得到。
(4)使用CuCl和DMSO作为溶剂在这个反应中是至关重要的,如果没有CuCl的加入,那么这个反应就不能发生: 13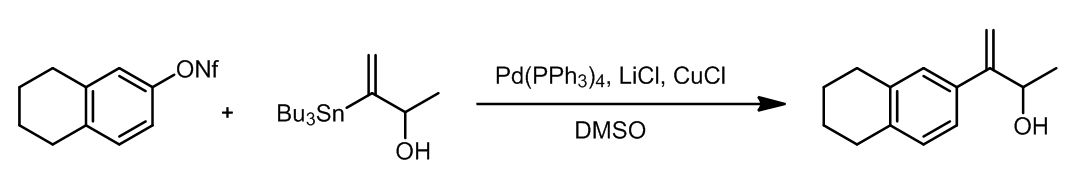
其中,配体也可是Cy3P,其他的配体也有测试,但是效果普遍不如这两种配体。
值得注意的是,磺酸酯在这个反应是不会受到影响的。
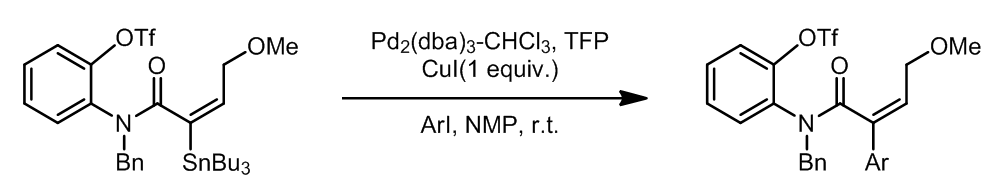
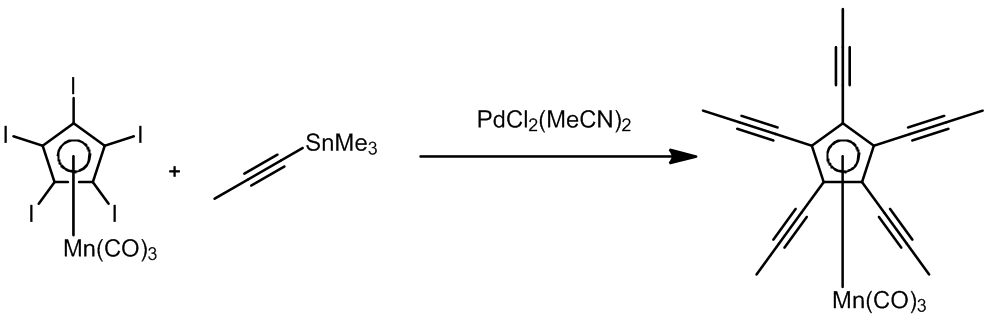
烯丙基卤代烃是一个参与Stille偶联很好的反应底物,这个条件中使用了Ph3As作为配体,也叫作Farina的改进条件。
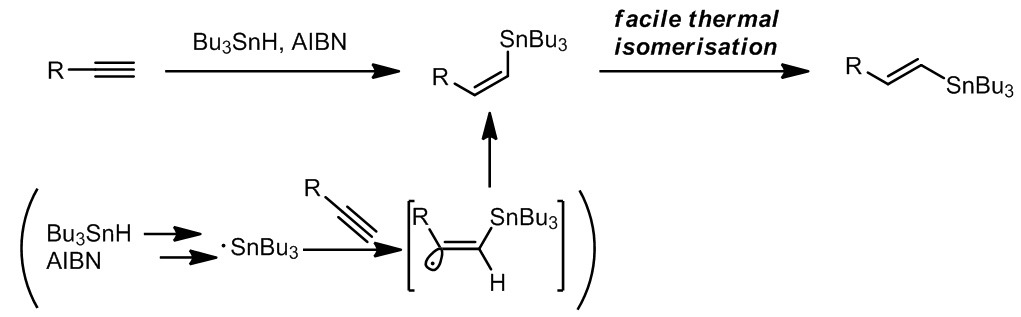
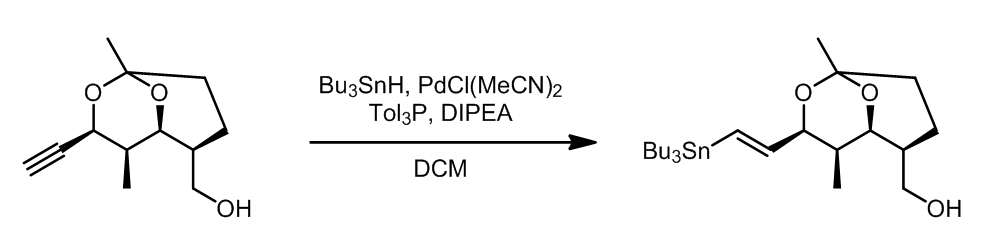
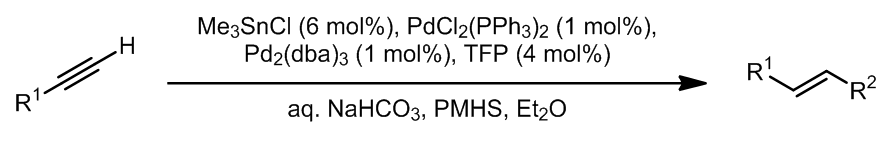
这是一个一步法将端炔转化成偶联的烯烃产物的方法,是一个钯催化的锡氢化反应-Stille偶联串联反应,其中锡氢化合物可以进行循环催化,总的来看这个步骤中有94%的锡元素可以重复利用。
在Stille欧联中,酰氯也是一个备选的底物,反应的机理也是类似的,酰氯先经过氧化加成和Pd发生相互作用,之后发生分子间的偶联过程。此外,CO也同样可以参与类似的反应。
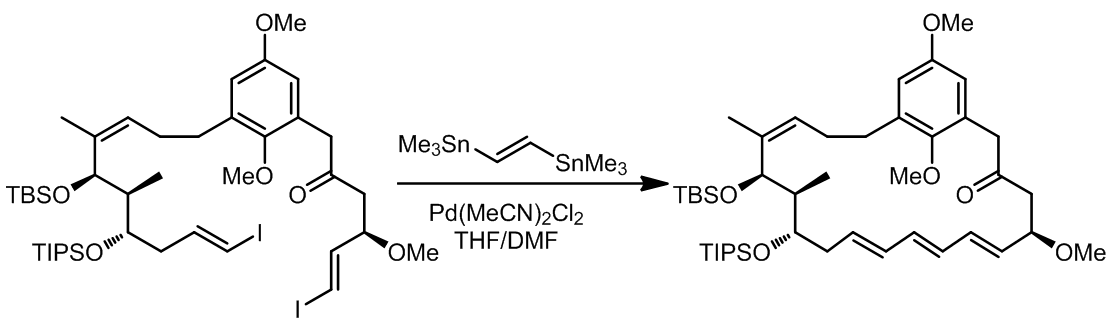
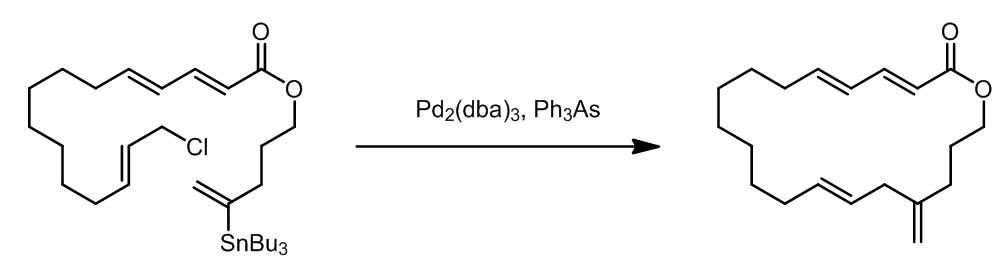
(13)在rapamycin的全合成中的应用:(not published yet)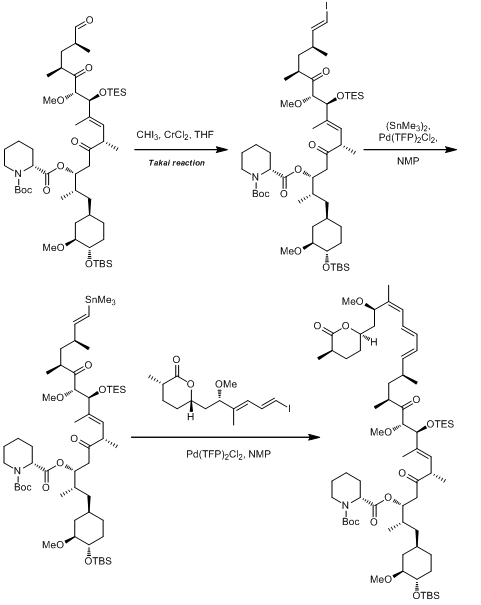
这个例子中,使用了两次Stille偶联,第一次是用于合成锡烷,第二次是用于偶联形成新的碳碳键。
REFERENCES
- Chem. Rev., 2000, 100 (8), pp 3257–3282, DOI: 10.1021/cr9902695
- Angew. Chem. Int. Ed. Engl., 1993, 1653, DOI:10.1002/anie.199316531
- Org. Lett., 1999, 1 (7), pp 1137–1139, DOI: 10.1021/ol990967b
- J. Am. Chem. Soc., 1998, 120 (47), pp 12237–12254, DOI: 10.1021/ja981846u
- J. Am. Chem. Soc., 1998, 120 (26), pp 6477–6487, DOI: 10.1021/ja980786p
- J. Am. Chem. Soc., 2000, 122 (16), pp 3830–3838, DOI: 10.1021/ja994285v
- J. Am. Chem. Soc., 2000, 122 (16), pp 3830–3838, DOI: 10.1021/ja994285v
- J. Am. Chem. Soc., 2001, 123 (14), pp 3194–3204, DOI: 10.1021/ja0035295
- J. Am. Chem. Soc., 1999, 121 (33), pp 7600–7605, DOI: 10.1021/ja991500z
- J. Am. Chem. Soc., 1987, 109 (3), pp 813–817, DOI: 10.1021/ja00237a029
- J. Am. Chem. Soc., 1984, 106 (16), pp 4630–4632, DOI: 10.1021/ja00328a063
- J. Org. Chem., 1997, 62 (24), pp 8290–8291, DOI: 10.1021/jo971793j
- J. Am. Chem. Soc., 1999, 121 (33), pp 7600–7605, DOI: 10.1021/ja991500z
- J. Am. Chem. Soc., 2003, 125 (13), pp 3718–3719, DOI: 10.1021/ja0344563
- J. Am. Chem. Soc., 2002, 124 (10), pp 2259–2262, DOI: 10.1021/ja011931t
- Org. Lett., 2002, 4 (12), pp 2063–2066, DOI: 10.1021/ol0259342
- J. Am. Chem. Soc., 2003, 125 (20), pp 6261–6271, DOI: 10.1021/ja034525d
- Synlett 1994; 1994(3): 181-182, DOI: 1055/s-1994-22785
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






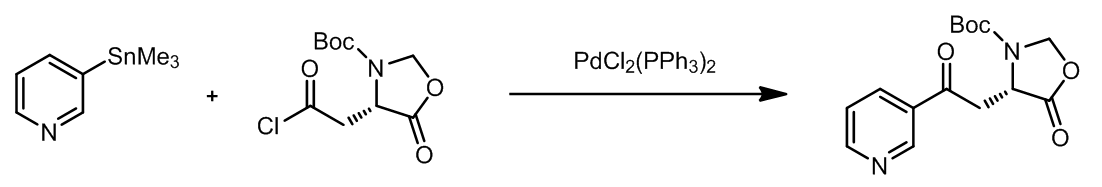


















No comments yet.