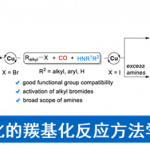
概要
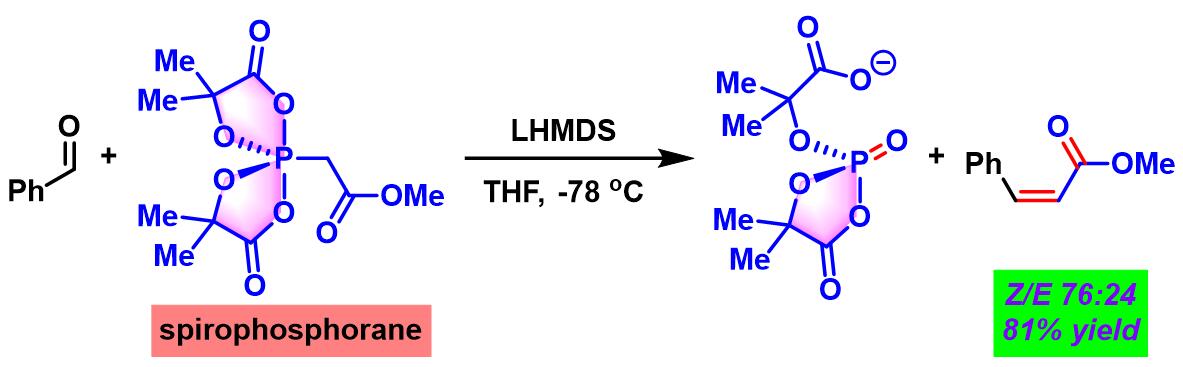
1996年,美国North Carolina大学化学实验室 (Laboratories of Chemistry, University of North Carolina) 的S. A. Evans研究室首次发现将五配位的spirophosphorane乙酸甲酯与强碱LHMDS进行去质子化后,形成的相应烯醇负离子苯甲醛之间进行反应,可以立体选择性地合成相应的(Z)-肉桂酸甲酯[1]。并获得较好的立体选择性。
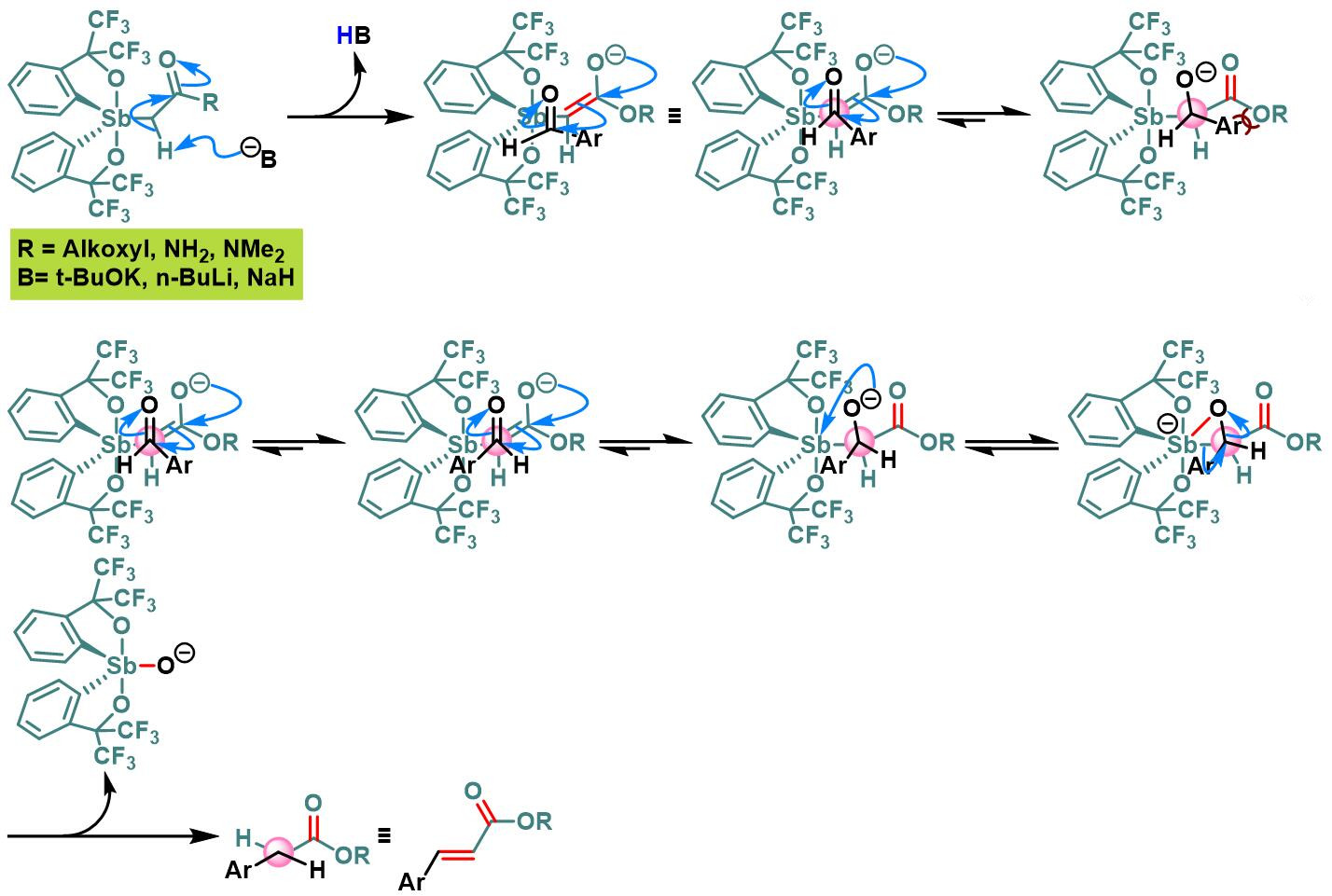
1997年,日本Hiroshima大学理学部化学系 (Department of Chemistry, Faculty of Science, Hiroshima UniVersity, 広島大学理学部化学科)的K. Akiba (Akiba Kin-ya, 秋葉 欣哉)课题组采用Martin配体 (Martin ligand, 即六氟苯异丙醇配体, hexafluorocumyl alcohol ligand)配位的spirophosphorane乙酸酯,叔丁醇钾作为碱,可以极大提高上述反应的(Z)-选择性 [2],并将底物范围扩展至其它芳香醛[2]。同时,K. Akiba发现采用相应的spirostiborane乙酸酯,可以获得较好的(E)-选择性[2]。然而,在spirostiborane乙酸酯参与反应时,对于部分底物而言,烯基化产率较低。
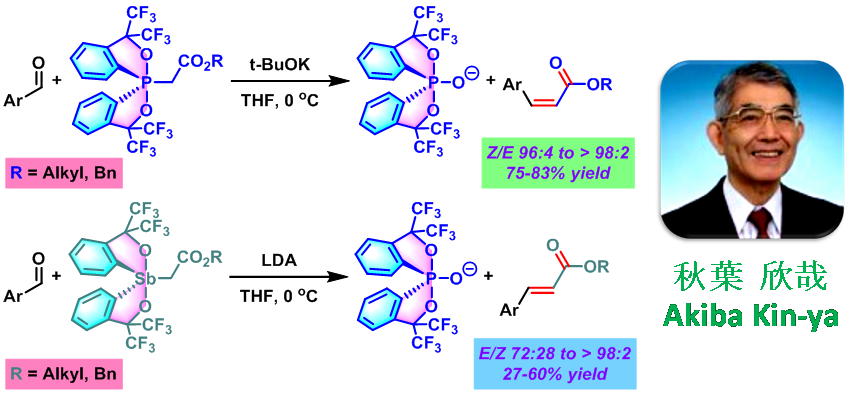
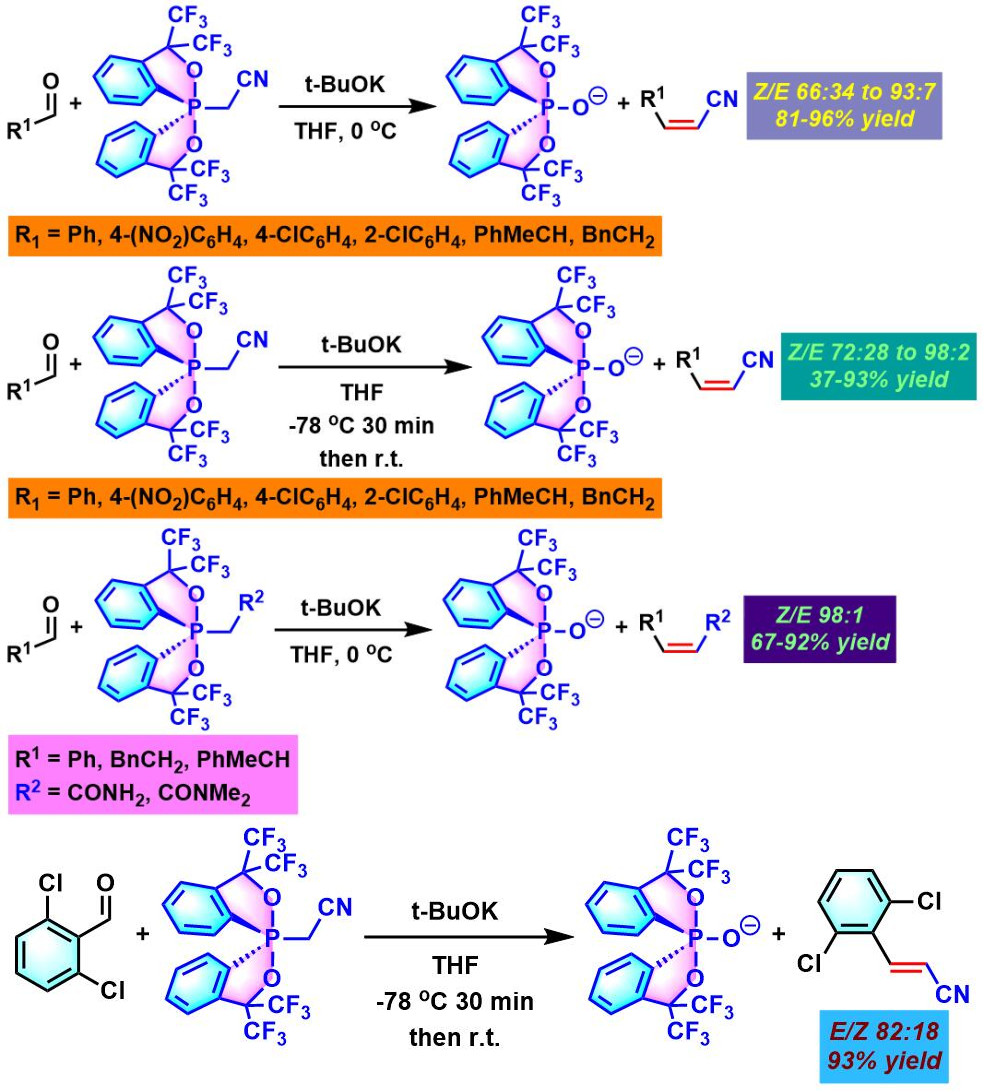
2002年,K. Akiba进一步对具有氰甲基、乙酰胺基及N, N-二甲基乙酰胺基取代的spirophosphorane进行了深入研究,发现具有上述取代基的spirophosphoranes参与的烯基化过程,同样可以获得优良的(Z)-立体选择性,并且,分别获得相应的(Z)-α,β-不饱和腈、(Z)-α,β-不饱和酰胺及(Z)-α,β-不饱和三级酰胺[3]。然而,对于立体位阻较大的2,6-二氯苯甲醛,则获得相反的立体选择性[3]。
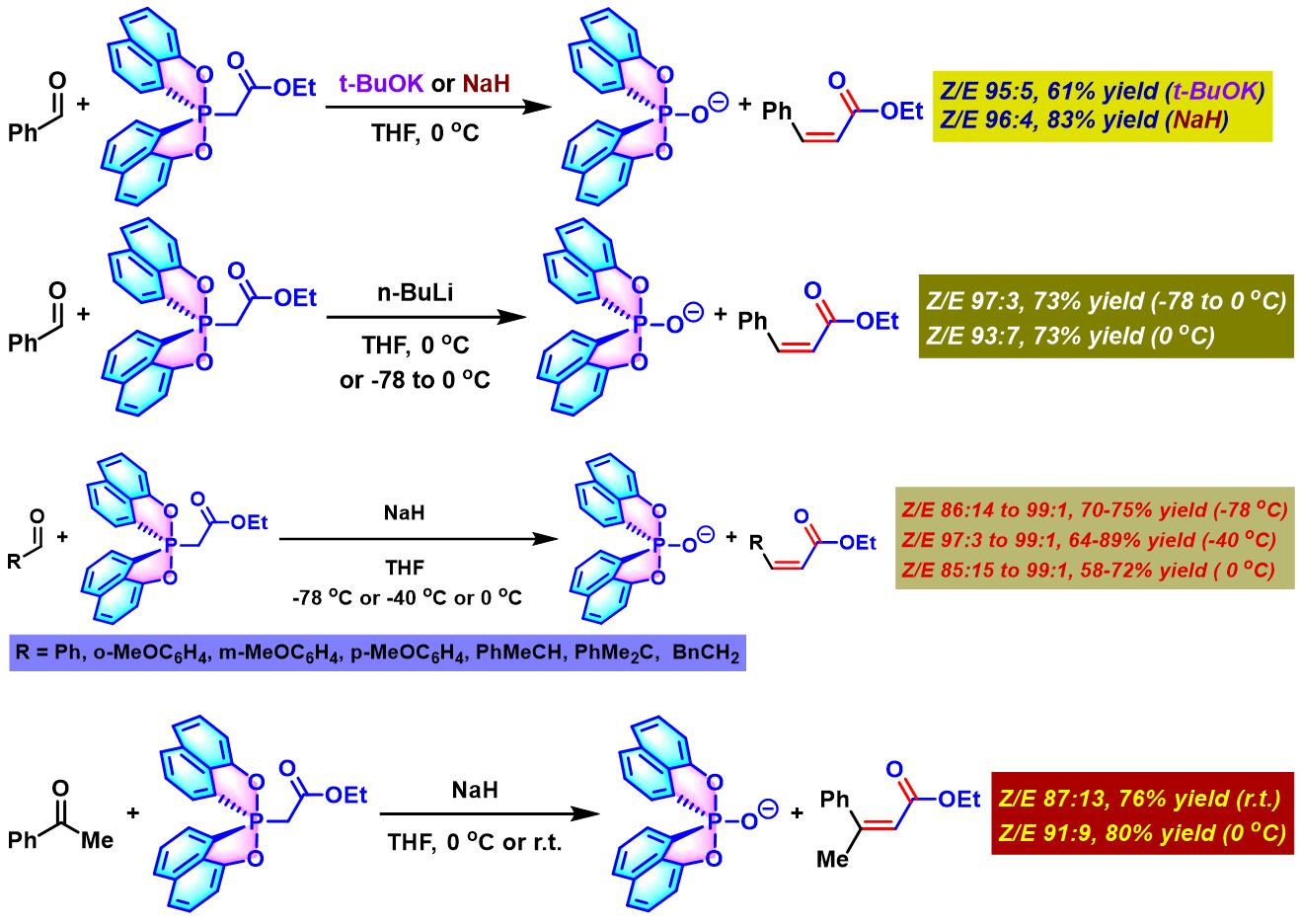
2010年,S. Kojima (Kojima Satoshi, Department of Chemistry, Faculty of Science, Hiroshima UniVersity, 小島 聡志, 広島大学理学部化学科)将phosphorane进一步扩展至1-萘酚配体配位的spirophosphorane[4]。之后,S. Kojima发现采用其它强碱 (如氢化钠,正丁基锂),同样可以获得优良的(Z)-选择性[4]。同时,研究表明,该反应条件对于酮底物同样适用。
文献中将这种在强碱存在下,通过各类取代的spirophosphorane (主要涉及烷氧羰基、氰甲基、乙酰胺基及N, N-二甲基乙酰胺基)与醛作用,立体选择性地获得(Z)-α,β-不饱和酯、(Z)-α,β-不饱和酰胺及(Z)-α,β-不饱和腈等(Z)-α,β-不饱和化合物的反应称为Evans-Akiba反应 (Evans-Akiba reaction)。该反应条件温和,产率优良,并具有高度的立体选择性。为(Z)-α,β-不饱和化合物的立体选择性合成开辟了全新的方法。
基本文献
- [1] M. L. Bojin, S. Barkallah, S. A. Evans Jr, J. Am. Chem. Soc. 1996, 118, 1549. doi: 10.1021/ja952095o.
- [2] S. Kojima, R. Takagi, K. Akiba, J. Am. Chem. Soc. 1997, 119, 5970. doi: 10.1021/ja964122w.
- [3] S. Kojima, K. Kawaguchi, S. Matsukawa, K. Uchida, K. Akiba, Chem. Lett. 2002, 170. doi: 10.1246/cl.2002.170.
- [4] S. Kojima, J. Arimura, K. Kajiyama, Chem. Lett. 2010, 39, 1138. doi: 10.1246/cl.2010.1138.
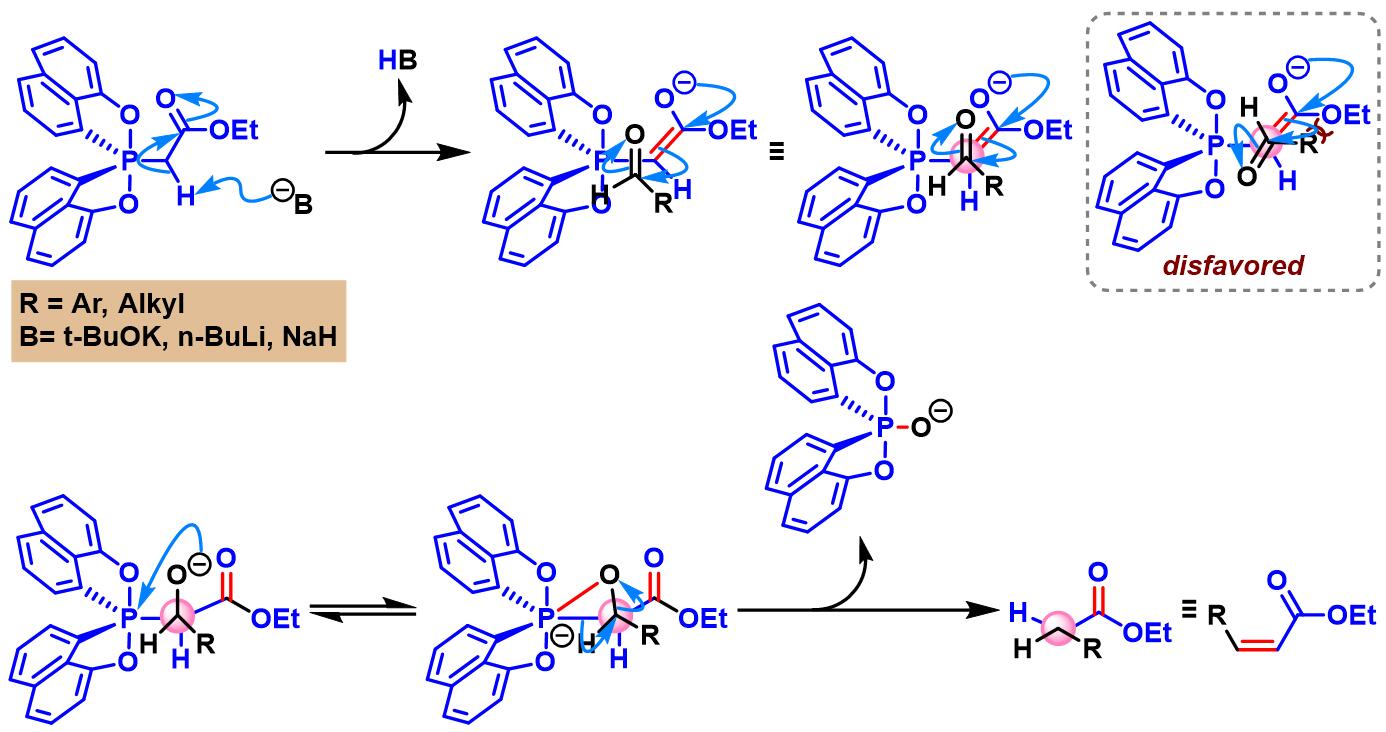
反应机理
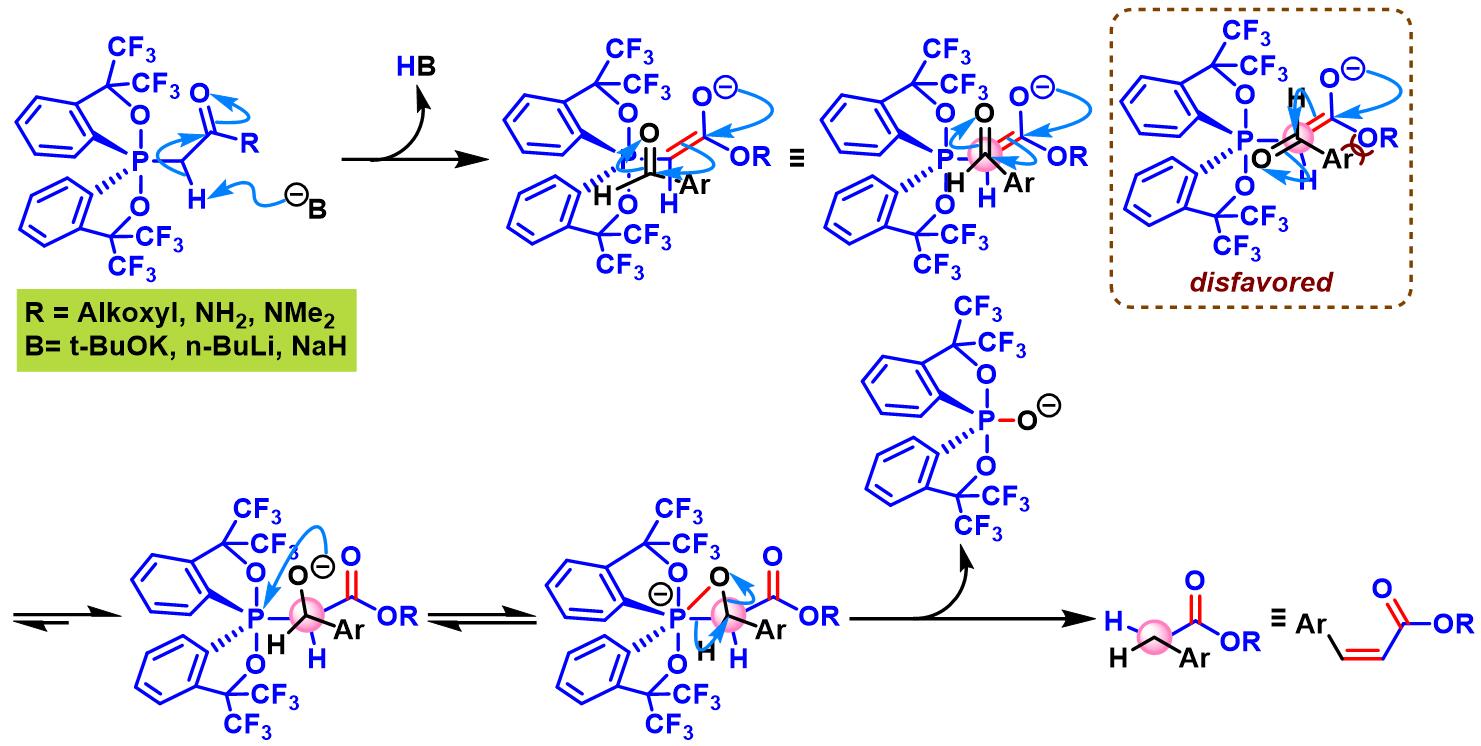
(Z)-α,β-不饱和酯的生成
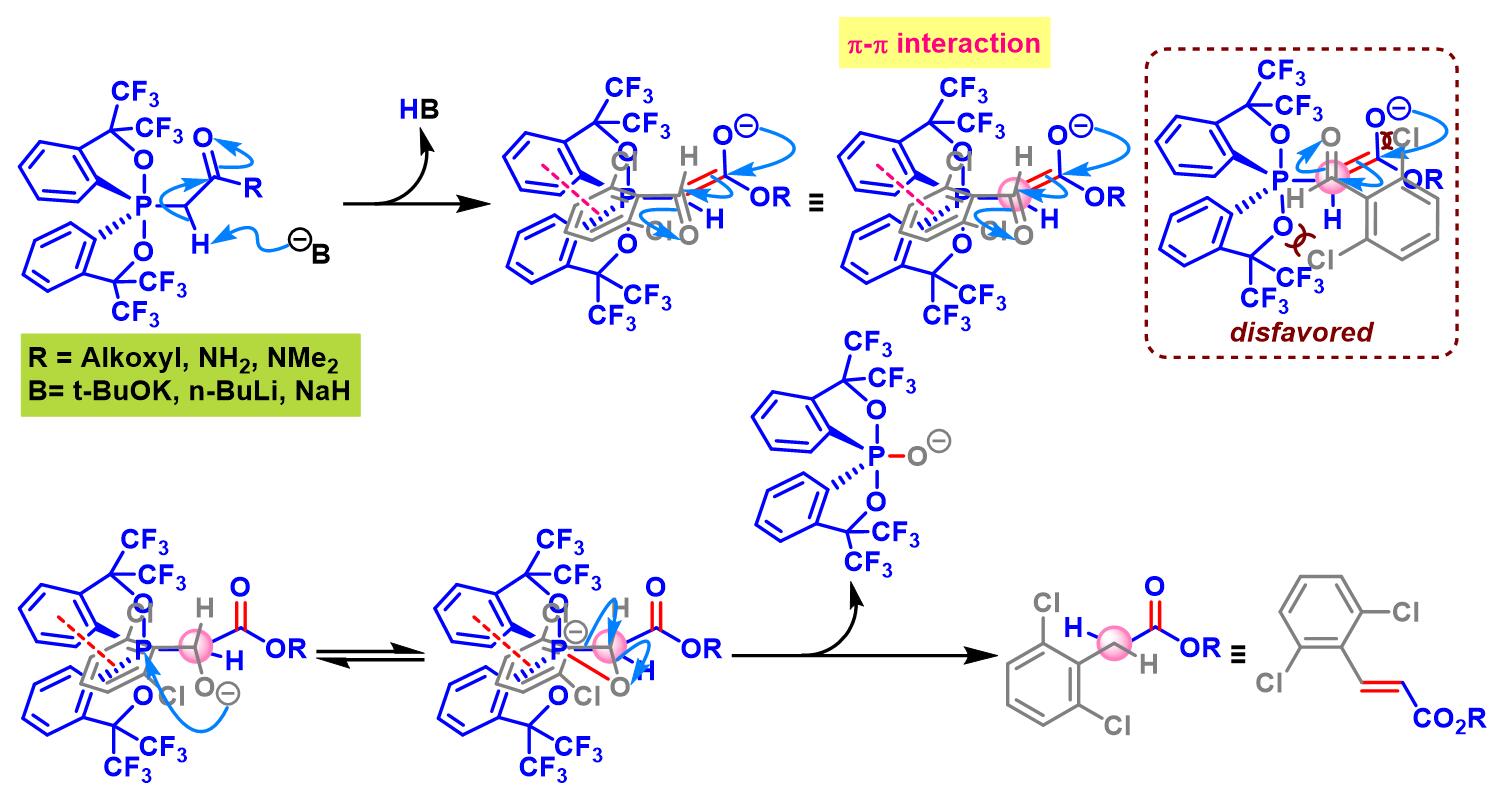
立体选择性的翻转
立体选择性的翻转
1-萘酚配体配位的spirophosphorane参与的烯基化
- [1] S. Kojima, K. Akiba, Tetrahedron Lett. 1997, 38, 547. doi: 10.1016/S0040-4039(96)02368-4.
- [2] S. Matsukawa, S. Kojima, K. Kajiyama, Y. Yamamoto, K. Akiba, S. Re, S. Nagase, J. Am. Chem. Soc. 2002, 124, 13154. doi: 10.1021/ja026776c
- [3] S. Kojima, K. Kawaguchi, S. Matsukawa, K. Akiba, Tetrahedron 2003, 59, 255. doi: 10.1016/S0040-4020(02)01407-2.
反应实例
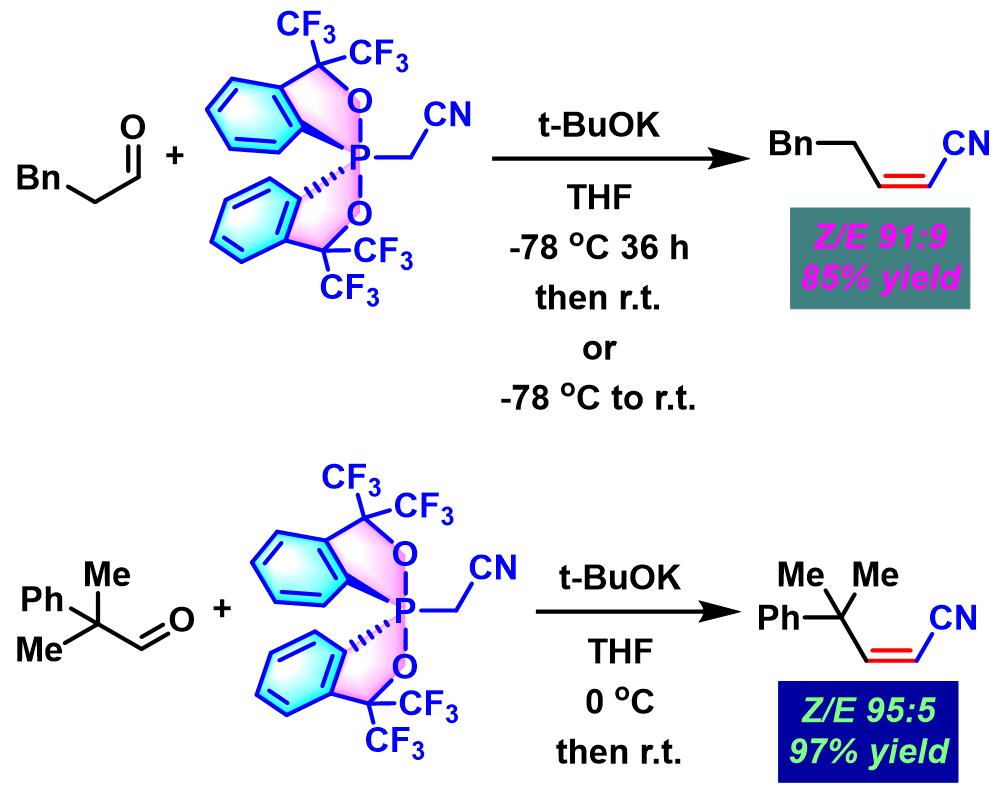
(Z)-α,β-不饱和腈的合成[1]
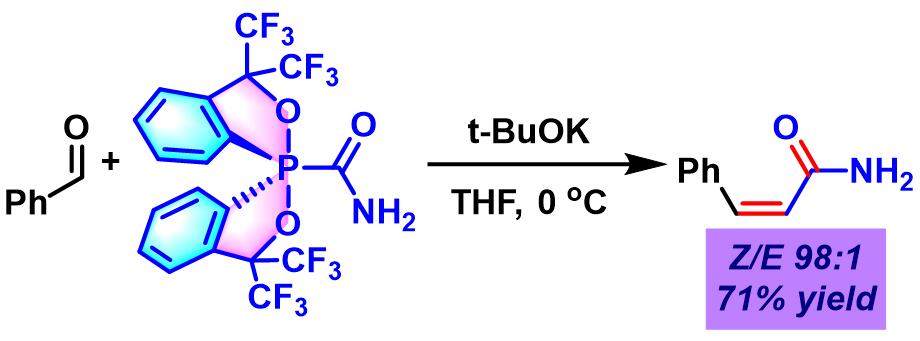
(Z)-α,β-不饱和酰胺的合成[1]
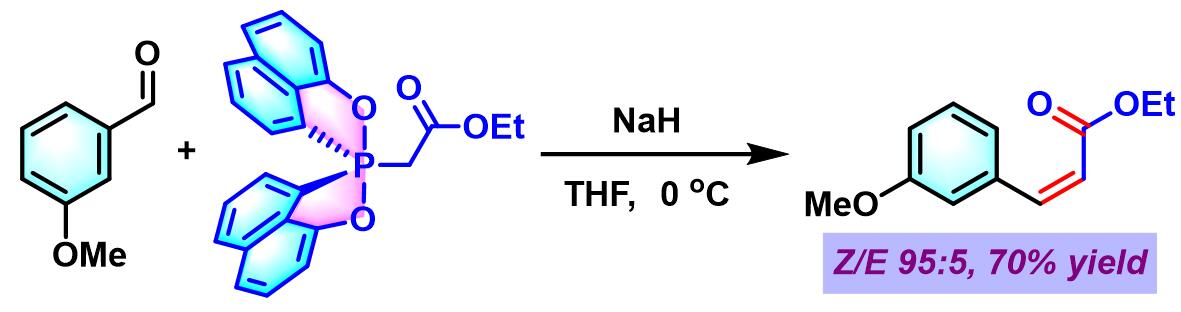
(Z)-α,β-不饱和酯的合成[2]
实验步骤
氩气气氛下,将spirooxyphosphorane (1 eq.)溶于无水THF (浓度为0.1 M)。将上述溶液冷却至-78 oC,再缓慢加入强碱 (1.6 eq)。再将上述混合在-78 oC下搅拌15 min,随后,通过注射器滴加醛 (1.6 eq)底物。滴加结束后,立即将反应烧瓶置于乙醇浴内,反应混合物在1-2 min 内升至室温。 继续搅拌,直至反应结束。反应结束后,加入水淬灭反应。淬灭完成后,加入乙醚进行萃取。将合并的乙醚相采用无水硫酸钠进行干燥,减压除去溶剂后,获得相应烯基化产物。
参考文献
- [1] S. Kojima, K. Kawaguchi, S. Matsukawa, K. Uchida, K. Akiba, Chem. Lett. 2002, 170. doi: 10.1246/cl.2002.170.
- [2] S. Kojima, J. Arimura, K. Kajiyama, Chem. Lett. 2010, 39, 1138. doi: 10.1246/cl.2010.1138.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.