本文作者:石油醚
概要
Keiji Maruoka:日本京都大学特聘教授,有机化学家。
课题组主页: http://kuchem.kyoto-u.ac.jp/yugo/orgcat/english/index.html
教育经历
1976年 京都大学获得学士学位
1980年 夏威夷大学获得博士学位
1980-1985年 名古屋大学应用化学系助教授
1985-1989年 名古屋大学应用化学系讲师
1990-1995年 名古屋大学应用化学系副教授
1995-2000年 北海道大学理学部教授
2000-2001年 京都大学和北海道大学教授
2001-2019年 京都大学理学部教授
2019- 京都大学特聘教授
获奖经历
1985 The Japan Chemical Society Award for Young Chemist
2000 The Inoue Prize for Science
2001 The Ichimura Prize for Science
2003 Japan Synthetic Organic Chemistry Award
2004 Nagoya Silver Medal
2006 The Green and Sustainable Chemistry Award
2006 Award by the Minister of Education, Culture, Sports, Science and Technology
2007 The Japan Chemical Society Award
2007 Molecular Chirality Award
2007/2008 Novartis Lectureship Award
2010 The Chunichi Cultural Prize
2011 Arthur C. Cope Scholar Award
2011 Medal with Purple Ribbon (National Prize)
2011 Humboldt Research Award
2012 Toray Science and Technology Prize
2012 The Kyoto Shimbun Award for the Arts, Science and Culture
2016 Ryoji Noyori Prize (The Society of Synthetic Organic Chemistry, Japan)
2018 Japan Academy Prize (Japan Academy)
研究方向
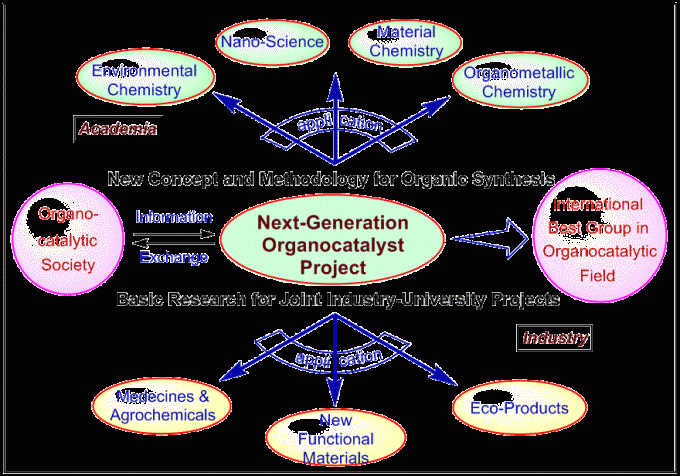
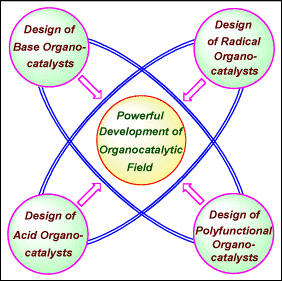
目前,“有机催化剂”是继传统的“生物催化剂”和“金属催化剂”之外的第三种有机合成催化剂而备受关注。在这样一个有机催化领域,“新一代有机催化剂”的合成,能够实现新的反应性和选择性,这是传统的“生物催化剂”和“金属催化剂”所无法获得的。此外,这种下一代有机催化剂有望创造新的研究模式和新的科学技术的发展。根据路易斯酸和有机金属催化剂设计等方面的信息(图 1)。Maruoka教授课题组对下一代有机催化剂进行合理地设计。主要分为以下四个方面(图 2):1)有机碱催化剂;2)有机酸催化剂;3)多功能有机催化剂;4) 自由基有机催化剂。
图 1 研究预期成果
图 2 有机催化剂的研究领域
- 有机碱催化剂1-11
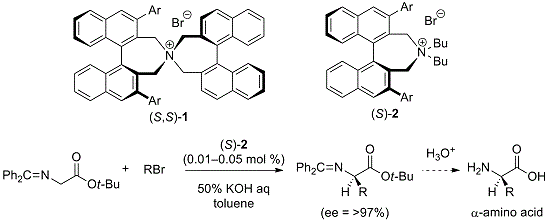
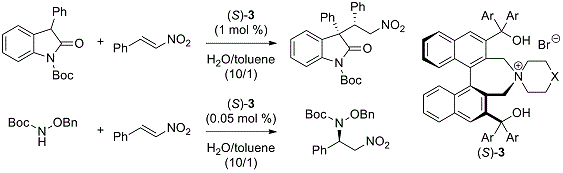
作为相转移催化剂的四烷基铵盐(R4N+X–),由于其离子结构是通常具有很好的水溶性,但如果将其烷基成为长链,则脂溶性提高,也可溶于有机溶剂。通过利用该特性作为相间移动催化剂,可以在常温下或水的存在下进行各种反应,同时也可以期待反应速度的大幅增加。此外,相转移催化剂可以让实验操作非常简便,具有各种合成化学的优点。从这样的观点来看,相间移动反应可以在水溶液中以常温、常压、开放系统进行,因此是极易工业化的反应系统。然而,制备用于不对称合成的高效手性相间移动催化剂并不容易。唯一的成功例子是来自金鸡纳碱的手性相转移催化剂,但是这些催化剂的设计总是受到限制,所适用的有机合成反应有限。Maruoka教授希望开发新的设计型手性相转移催化剂,将其应用于各种不对称合成反应。Maruoka教授小组从廉价易得的手性联萘酚出发制备了季铵盐型手性催化剂。目前,Maruoka教授课题组开发了第一代催化剂(S,S)-1(Maruoka catalyst®,1999年)12-14(图 3);简化的相转移催化剂(S)-215(简化的Maruoka catalyst®)(图1),各种类型的单功能和双功能相转移催化剂(S)-316,17(图 4),并将其应用于各种不对称催化反应。如;1)使用高活性相转移催化剂(S)-2实现了甘氨酸衍生物的不对称烷基化反应,使光学活性α-氨基酸的大量合成成为可能,通过利用本法,各种人工氨基酸合成的工业化成为了可能(图 3)。(催化剂(S)-2现在作为“Maruoka catalyst®”在Sigma-ARdrich、Strem及关东化学等市场上销售。);2)使用多功能催化剂(S)-3,在不需要添加任何外部碱的中性条件下进行的手性相间转移催化反应系统下有效进行(图 4)。
图 3 季铵盐型手性催化剂
图 4 多功能有机碱催化剂
- 有机酸催化剂18-22
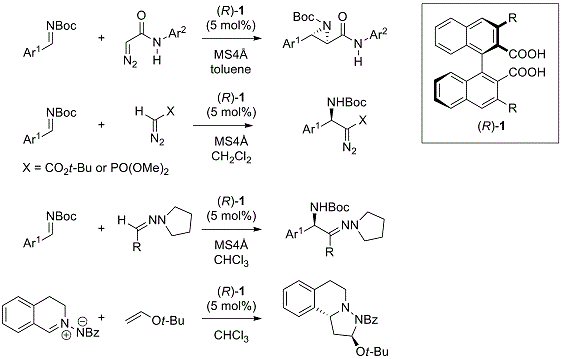
光学活性氮丙啶是在具有抗肿瘤活性的天然产物如丝裂霉素中发现的结构,并且是作为合成中间体的一组高度有用的化合物,例如光学活性1, 2-二胺,α-或β-氨基酸。手性Brønsted酸如磷酸和硫脲是不对称合成中重要的酸有机催化剂,Maruoka教授课题组独立开发了由手性联萘酚制备的二羧酸催化剂(R)-123,并成功地开发了使用该催化剂作为催化剂的反式不对称叠氮化反应和实现了各种异黄素类化合物的高立体选择性反应(图 5)。
图 5 有机酸催化剂
- 多功能有机催化剂24-27
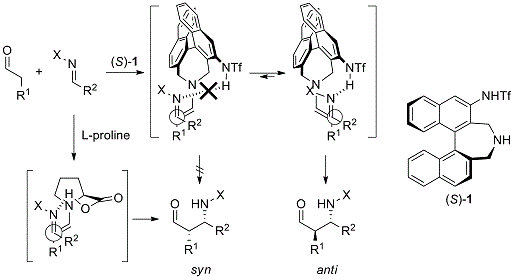
在最近的十几年中,有机催化的淘金热到来了,脯氨酸及其衍生物作为双功能有机催化剂毫无疑问是有机催化反应发展的核心。Maruoka教授课题组开发了轴手性仲胺催化剂作为双功能有机催化剂(S)-1(图 6)。与脯氨酸及其衍生物相比,这种催化剂表现出独特的反应性和选择性,并且已经报道了这些催化剂的许多特征。(S)-1显示了轴手性双功能有机催化剂的代表性特征。
图 6 轴向手性仲胺催化剂作为双功能有机催化剂
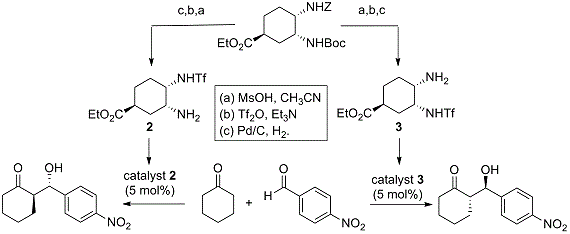
基于催化剂设计的新概念,Maruoka教授课题组开发了可以从相同手性底物制备不同手性的六元环顺式二胺型双功能有机催化剂 2和3。当将这两种双功能有机催化剂中的每一种用于不对称Aldol反应中时,Aldol反应产物的两种光学异构体均以高的立体选择性获得。同一个手性底物,合成两种不同光活性有机催化剂,来催化合成不同构型的产物,这种策略是很有用的(图 7)。
图 7 环己基顺式二胺型双功能有机催化剂
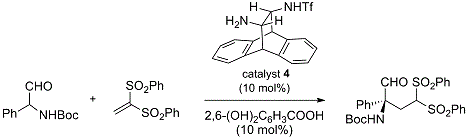
Maruoka教授课题组还开发了衍生自蒽的反式-二胺型双官能有机催化剂 4 (图 8),并已成功地开发出了使用它的高对映选择性共轭加成反应28。
图 8 蒽的反式-二胺型双官能有机催化剂
- 有机自由基催化剂29
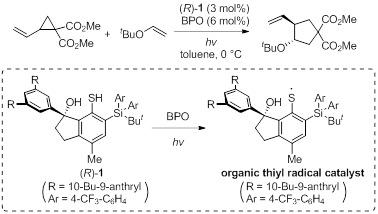
自由基是一种具有高反应性的化学物种,能够实现离子反应难以实现的转化。 但是,与其他有机分子催化剂相比,促进和控制自由基反应的有机自由基催化剂的研究极大地被延迟了。着眼于二硫键和硫醇容易产成的有机硫自由基,Maruoka教授课题组设计并开发了一种新的硫自由基充当催化活性物质的有机自由基催化剂。其主要应用于:1)手性茚满醇骨架的硫醇(R)-1催化剂在光照条件下,高选择性和立体控制性地促进了乙烯基环丙烷与烯烃之间的不对称自由基环化反应的发生(图 9);2)通过使用空间体积大的二硫化物 2 作为催化剂,实现了含氮三元环化合物乙烯基叠氮与烯烃之间自由基环化反应(图 10 )30。
图 9 手性茚满醇骨架的硫醇(R)-1催化剂
图 10 二硫化物有机催化剂
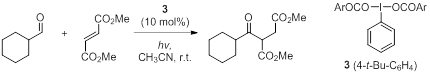
除了有机硫自由基催化剂的开发之外,Maruoka教授课题组已经成功地利用高价碘化合物的光解作用,从脂肪族醛中产生了直接的酰基自由基,并随后将其与缺电子的烯烃进行了自由基共轭加成反应(图11)。
图 11 高价碘化合物的光解作用
参考文献
- Kano, T.; Sugimoto, H.; Maruyama, H.; Maruoka, K., Angew. Chem. Int. Ed. 2015, 54 (29), 8462-8465, doi:10.1002/anie.201500225.
- Kano, T.; Kobayashi, R.; Maruoka, K., Angew. Chem. Int. Ed. 2015, 54 (29), 8471-8474, doi: 10.1002/anie.201502215.
- Shirakawa, S.; Yamamoto, K.; Maruoka, K., Angew. Chem. Int. Ed. 2015, 54 (3), 838-840, doi: 10.1002/anie.201409065.
- Shirakawa, S.; Koga, K.; Tokuda, T.; Yamamoto, K.; Maruoka, K., Angew. Chem. Int. Ed. 2014, 53 (24), 6220-6223, doi:10.1002/anie.201403046.
- Ooi, T.; Kameda, M.; Taniguchi, M.; Maruoka, K., J. Am. Chem. Soc. 2004, 126 (31), 9685-9694, doi:10.1021/ja048865q.
- Ooi, T.; Takeuchi, M.; Kameda, M.; Maruoka, K., J. Am. Chem. Soc. 2000, 122 (21), 5228-5229, doi:10.1021/ja0007051.
- Ooi, T.; Takahashi, M.; Doda, K.; Maruoka, K., J. Am. Chem. Soc. 2002, 124 (26), 7640-7641, doi:10.1021/ja0118791.
- Ooi, T.; Takeuchi, M.; Kato, D.; Uematsu, Y.; Tayama, E.; Sakai, D.; Maruoka, K., J. Am. Chem. Soc. 2005, 127 (14), 5073-5083, doi:10.1021/ja0459328.
- Kano, T.; Hayashi, Y.; Maruoka, K., J. Am. Chem. Soc. 2013, 135 (19), 7134-7137, doi:10.1021/ja403340r.
- Wang, X.; Kitamura, M.; Maruoka, K., J. Am. Chem. Soc. 2007, 129 (5), 1038-1039, doi:10.1021/ja068119g.
- Ooi, T.; Doda, K.; Maruoka, K., J. Am. Chem. Soc. 2003, 125 (8), 2054-2055, doi:10.1021/ja029660p.
- Paria, S.; Lee, H.-J.; Maruoka, K., ACS Catal. 2019, 9 (3), 2395-2399, doi:10.1021/acscatal.8b04949.
- Ooi, T.; Uematsu, Y.; Maruoka, K., J. Am. Chem. Soc. 2006, 128 (8), 2548-2549, doi:10.1021/ja058066n.
- Ooi, T.; Kameda, M.; Maruoka, K., J. Am. Chem. Soc. 2003, 125 (17), 5139-5151, doi:10.1021/ja021244h.
- Paria, S.; Kang, Q.-K.; Hatanaka, M.; Maruoka, K., ACS Catal. 2019, 9 (1), 78-82, doi:10.1021/acscatal.8b03292.
- Kano, T.; Shirozu, F.; Akakura, M.; Maruoka, K., J. Am. Chem. Soc. 2012, 134 (38), 16068-16073, doi:10.1021/ja307668b.
- Kano, T.; Ueda, M.; Maruoka, K., J. Am. Chem. Soc. 2008, 130 (12), 3728-3729, doi:10.1021/ja074003o.
- Hashimoto, T.; Gálvez, A. O.; Maruoka, K., J. Am. Chem. Soc. 2015, 137 (51), 16016-16019, doi:10.1021/jacs.5b11518.
- Hashimoto, T.; Nakatsu, H.; Maruoka, K., Angew. Chem. Int. Ed. 2015, 54 (15), 4617-4621, doi: 10.1002/anie.201410957.
- Hashimoto, T.; Maeda, Y.; Omote, M.; Nakatsu, H.; Maruoka, K., J. Am. Chem. Soc. 2010, 132 (12), 4076-4077, doi:10.1021/ja100787a.
- Hashimoto, T.; Nakatsu, H.; Takiguchi, Y.; Maruoka, K., J. Am. Chem. Soc. 2013, 135 (43), 16010-16013, doi:10.1021/ja407501h.
- Hashimoto, T.; Uchiyama, N.; Maruoka, K., J. Am. Chem. Soc. 2008, 130 (44), 14380-14381, doi:10.1021/ja805635c.
- Hashimoto, T.; Hirose, M.; Maruoka, K., J. Am. Chem. Soc. 2008, 130 (24), 7556-7557, doi:10.1021/ja802704j.
- Kano, T.; Ueda, M.; Takai, J.; Maruoka, K., J. Am. Chem. Soc. 2006, 128 (18), 6046-6047, doi:10.1021/ja0604515.
- Kano, T.; Yamaguchi, Y.; Tokuda, O.; Maruoka, K., J. Am. Chem. Soc. 2005, 127 (47), 16408-16409, doi:10.1021/ja056008w.
- Kano, T.; Shirozu, F.; Maruoka, K., J. Am. Chem. Soc. 2013, 135 (48), 18036-18039, doi:10.1021/ja4099627.
- Kano, T.; Sugimoto, H.; Maruoka, K., J. Am. Chem. Soc. 2011, 133 (45), 18130-18133, doi:10.1021/ja208873k.
- Moteki, S. A.; Xu, S.; Arimitsu, S.; Maruoka, K., J. Am. Chem. Soc. 2010, 132 (48), 17074-17076, doi:10.1021/ja107897t.
- Hashimoto, T.; Kawamata, Y.; Maruoka, K., Nat. Chem. 2014, 6 (8), 702-705, doi:10.1038/nchem.1998.
- 30.T. Hashimoto, K. Takino, K. Hato, K. Maruoka, Angew. Chem. Int. Ed. 2016, 55, 8081,doi: 10.1002/anie.201602723
- 31.T. Hashimoto, Y. Shimazaki, Y. Omatsu, K. Maruoka, Angew. Chem. Int. Ed. 2018, 57, 7200,doi: 10.1002/anie.201803889



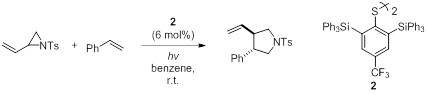














No comments yet.