本文作者:杉杉
导读
近日,中科院大连化物所与Leibniz催化研究所的吴小锋课题组在Angew. Chem. Int. Ed.中发表论文,报道一种全新的通过铜催化剂促进的采用烷基卤参与的双羰基化以及单羰基化反应方法学,进而成功完成一系α-酮酰胺以及酰胺分子的构建。
Copper-Catalyzed Substrate-Controlled Carbonylative Synthesis of α-Keto Amides and Amides from Alkyl Halides
Zhao, H. Ai, X. Wu, Angew. Chem. Int. Ed. 2022, ASAP. doi: 10.1002/anie.202200062.
正文
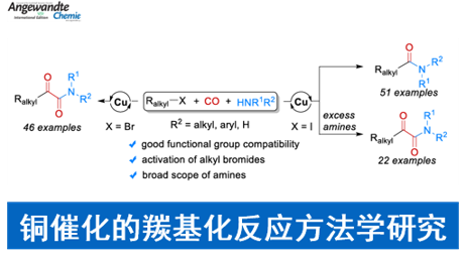
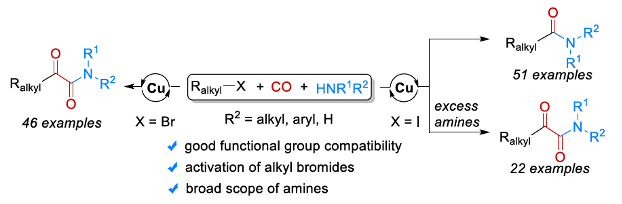
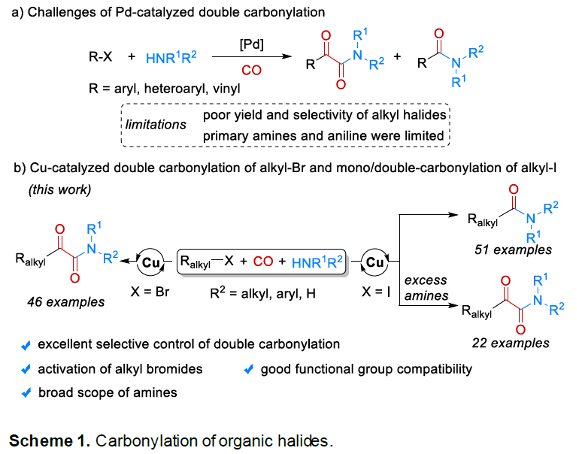
近年来,采用CO作为C1-砌块进行的过渡金属催化羰基化反应方法学[1]-[2],尤其通过钯催化剂促进的双羰基化反应方法学[3]-[5]的相关研究已经备受有机合成化学家的广泛关注 (Scheme 1,eq a)。然而,对于钯催化剂参与的各类烷基碘底物的双羰基化反应方法学[6]以及将烷基溴应用于羰基化学[7]的相关研究,却较少有相关的文献报道。这里,中科院大连化物所与Leibniz催化研究所的吴小锋研究团队成功设计出一种全新的通过铜催化剂促进的采用烷基卤参与的双羰基化以及单羰基化反应方法学。
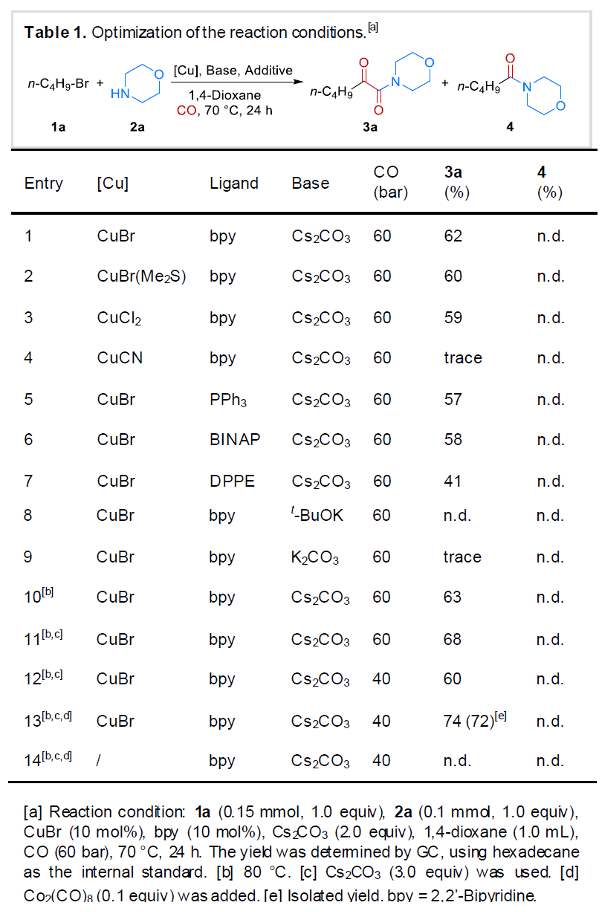
首先,作者采用1-溴丁烷1a与吗啉2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用CuBr作为催化剂,bpy作为配体,Co2(CO)8作为添加剂,Cs2CO3作为碱,1,4-二氧六环作为反应溶剂,CO压力为40 bar,反应温度为80oC,最终获得74%收率的α-酮酰胺产物3a。
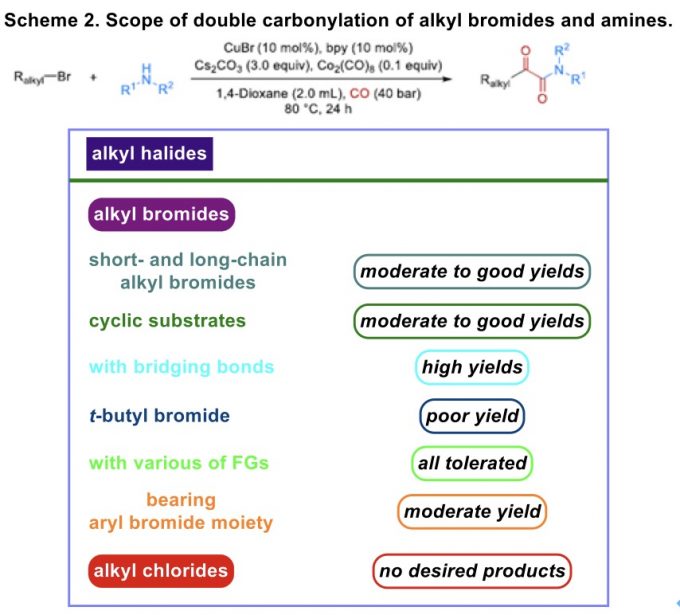
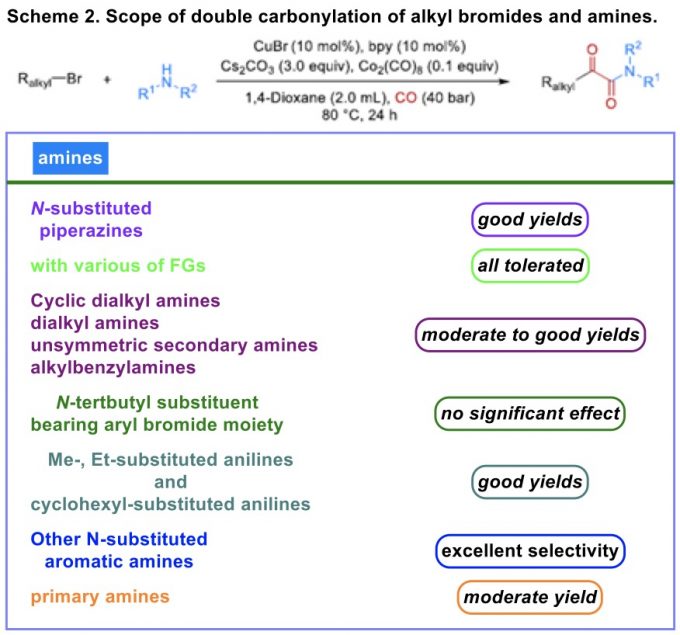
在上述的最佳反应条件下,作者进一步对上述的双羰基化过程中一系列烷基溴底物以及胺底物的应用范围进行如下研究 (Scheme 2)。
同时,作者发现,在采用烷基碘底物时,能够同时进行相应的双羰基化与单羰基化反应过程 (详见Supporting Information Table S2与Table S3)。之后,作者通过对反应条件的进一步优化,研究表明:采用Cu(OAc)2与bpy催化体系,Cs2CO3作为碱,CO压力为60 bar,1,4-二氧六环作为反应溶剂,反应温度为50oC,优先进行相应的双羰基化过程;而采用CuBr(Me2S)与bpy催化体系,Cs2CO3作为碱,CO压力为40 bar,1,4-二氧六环作为反应溶剂,反应温度为50oC,反应温度为110oC,则优先进行相应的单羰基化过程。
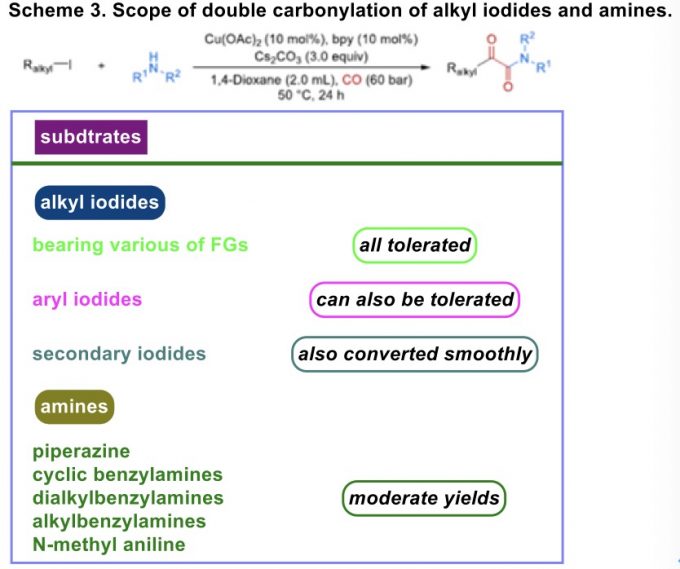
在获得上述最佳反应条件之后,作者分别对上述烷基碘与胺底物之间的双羰基化 (Scheme 3)与单羰基化(Scheme 4)过程中的底物应用范围进行深入研究。
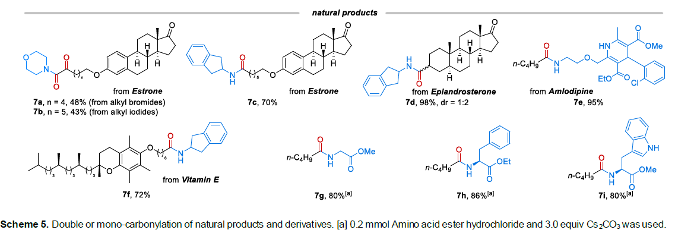
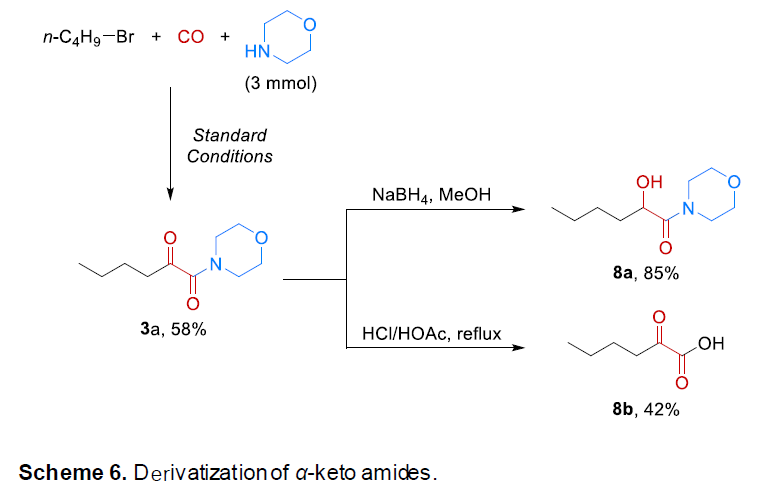
之后,该小组进一步对上述的羰基化策略的合成应用价值进行深入研究(Schemes 5-6)。
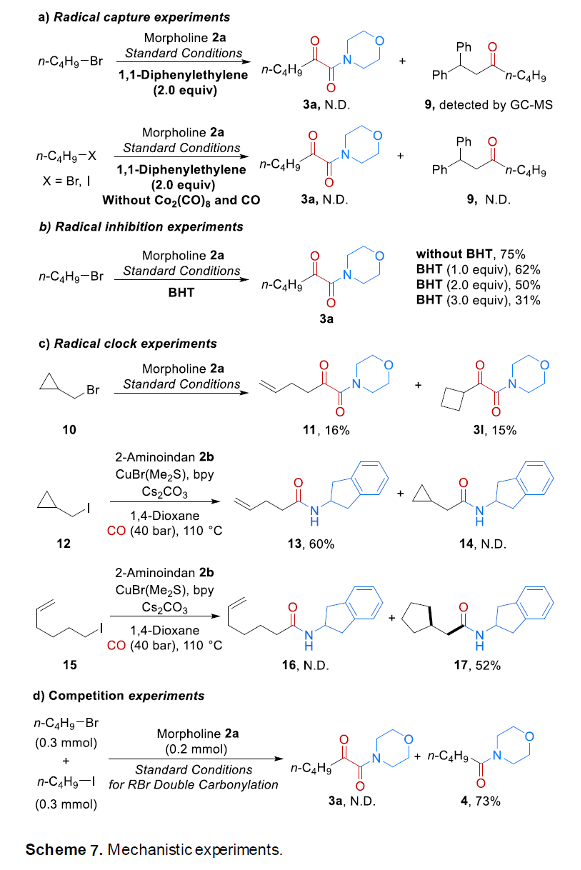
接下来,作者通过自由基捕获实验 (Scheme 7a)的相关研究表明,反应过程中可能涉及烷基自由基与酰基自由基的形成。同时,在烷基溴活化之前,CO同样可能作为配体与铜中心进行配位。之后,该小组通过自由基抑制实验 (Scheme 7b)以及自由基钟实验的研究 (Scheme 7c)进一步证实,上述的羰基化反应过程中涉及自由基中间体的参与。之后,该小组通过竞争实验发现,反应过程中,烷基碘底物的活化速率显著高于相应的烷基溴底物(Scheme 7d)。
基于上述的实验研究以及前期相关的文献报道[5]-[6],作者提出如下合理的反应机理 (Scheme 8)。
总结
中科院大连化物所与Leibniz催化研究所的吴小锋课题组报道一种全新的通过铜催化剂促进的采用烷基卤参与的双羰基化以及单羰基化反应方法学,进而成功完成一系α-酮酰胺以及酰胺分子的构建。这一全新的羰基化策略具有良好地反应收率、广泛的底物应用范围以及优良的官能团兼容性等优势。
参考文献
- [1] (a) H. Matsubara, T. Kawamoto, T. Fukuyama, I. Ryu, Acc. Chem. Res. 2018, 51, 2023. doi: 10.1021/acs.accounts.8b00278.
- (b) J. Peng, F. Wu, X. Wu, Chem. Rev. 2019, 119, 2090. doi: 10.1021/acs.chemrev.8b00068.
- [2] (a) W. Liu, W.Ren, J. Li, Y. Shi, W. Chang, Y. Shi, Org. Lett. 2017, 19, 1748. doi: 10.1021/acs.orglett.7b00507.
- (b) J. Yang, J. Liu, H. Neumann, R. Franke, R. Jackstell, M. Beller, Science, 2019, 366, 1514. doi: 10.1126/science.aaz1293.
- (c) H. Ai, F. Zhao, H. Geng, X. Wu, ACS Catal. 2021, 11, 3614. doi: 10.1021/acscatal.1c00414.
- (d) B. Limburg, Y. Gloaguen, H. M. de Bruijn, E. Drent, E. Bouwman, Chem. Cat. Chem. 2017, 9, 2961. doi: 10.1126/science.aaz1293.
- [3] (a) S. Gadge, B. Bhanage, RSC Adv. 2014, 4, 10367. doi: 10.1039/C3RA46273K.
- (b) D. Das, B. M. Bhanage, Adv. Synth. Catal. 2020, 362, 3022. doi: 10.1002/adsc.202000245.
- [4] F. Ozawa, A. Yamamoto, Chem. Lett. 1982, 6, 865. doi: 10.1246/cl.1982.865.
- [5] C. De Risi, G. Pollini, V. Zanirato, Chem. Rev. 2016, 116, 3241. doi: 10.1021/acs.chemrev.5b00443.
- [6] T. Fukuyama, S. Nishitani, T. Inouye, K. Morimoto, I. Ryu, Org. Lett. 2006, 8, 1383. doi: 10.1021/ol060123+.
- [7] J. Hartwig, in Organotransition Metal Chemistry: From Bonding to Catalysis, University Science Books: Sausalito, CA, 2010, pp. 301.
- [5] F. Ozawa, H. Soyama, H. Yanagihara, I. Aoyama, H. Takino, K. Izawa, T. Yamamoto, A. Yamamoto, J. Am. Chem. Soc. 1985, 107, 3235. doi: 10.1021/ja00297a033.
- [6] F. Ozawa, T. Sugimoto, T. Yamamoto, A. Yamamoto, Organometallics 1984, 3, 692. doi: 10.1021/om00083a008.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载























No comments yet.