导读
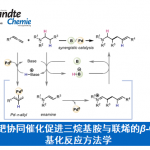
功能化的芳烃骨架化合物被广泛应用于试剂、催化剂、材料以及药物中。亲电芳香取代反应(通过带电的Wheland中间体),如Friedel-Crafts反应,是获取取代芳烃的经典方法。过渡金属和光催化的发展丰富了合成化学家制备不同功能化芳烃骨架的工具箱[1]。通过带负电荷的Meisenheimer加合物功能化通常依赖于硝基取代基、核苷卤素(X)或外加氧化剂(H),其适用性受到限制[2]。相关研究已经确定σH加合物的形成先于σX加合物的形成,近期,谭斌课题组利用不对称有机催化[3]和偶氮基团[4]来获取σH加合物,并有效地利用双功能手性磷酸(CPA)催化剂实现对芳烃的功能化。偶氮取代基可以构成扩展的共轭,并且其吸电子能力可以确保对芳烃进行区域选择性亲核进攻。偶氮取代基还可作为氧化剂,促进σH加合物中间体的快速分子内转化。为了进一步扩展这一概念并为芳烃功能化提供一个更通用的合成策略,原则上可以利用具有与偶氮基类似电子性质的取代基的底物。
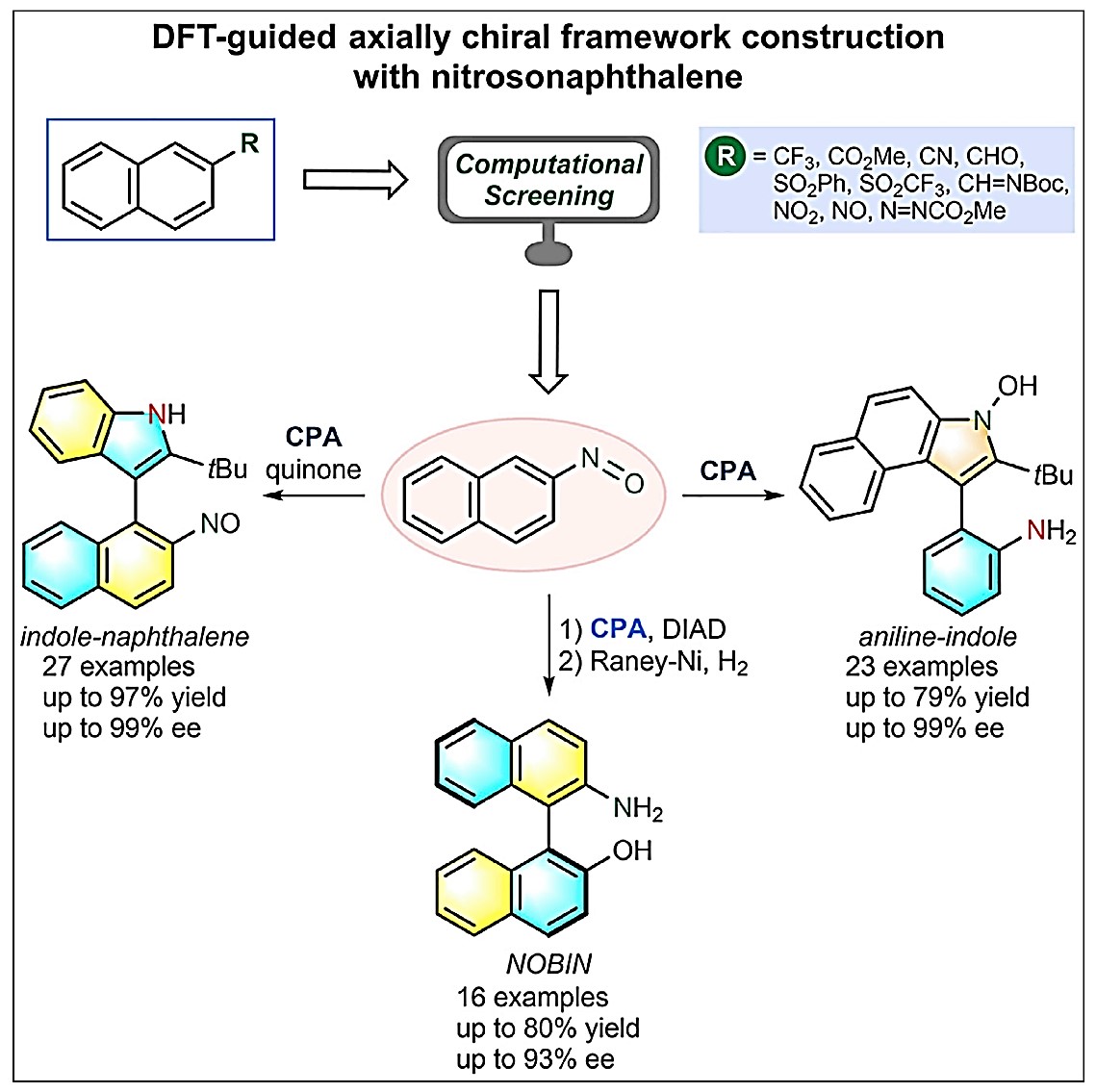
借助对一系列萘衍生物的电子结构计算,作者发现亚硝基基团对该种转化具有很大的可能性。在上述背景研究的基础上,南方科技大学谭斌课题组报道了在DFT的指导下,利用手性磷酸作为催化剂,可在温和的反应条件下,实现含有吲哚(萘酚)骨架的化合物与亚硝基萘反应,均以优秀的对映选择性得到不同轴手性化合物(图1)。 相关成果发表于:
DFT-Guided Phosphoric-Acid-Catalyzed Atroposelective Arene Functionalization of Nitrosonaphthalene
Wei-Yi Ding, Peiyuan Yu, Qian-Jin An, Katherine L. Bay, Shao-Hua Xiang, Shaoyu Li, Ying Chen, K.N. Houk,* and Bin Tan* Chem 2020, 6, 1-14. DOI: 10.1016/j.chempr.2020.06.001
图1. DFT指导的基于亚硝基萘构筑轴手性化合物
论文概要
作者首先设计了一系列取代萘并进行了初步的计算筛选,以寻找最佳的取代萘作为催化不对称亲核芳香取代的模型底物。通过对电子亲和势(EA)、最低空轨道(LUMO)能量等计算,发现亚硝基萘具有很好的反应潜力。以下是其主要研究内容:
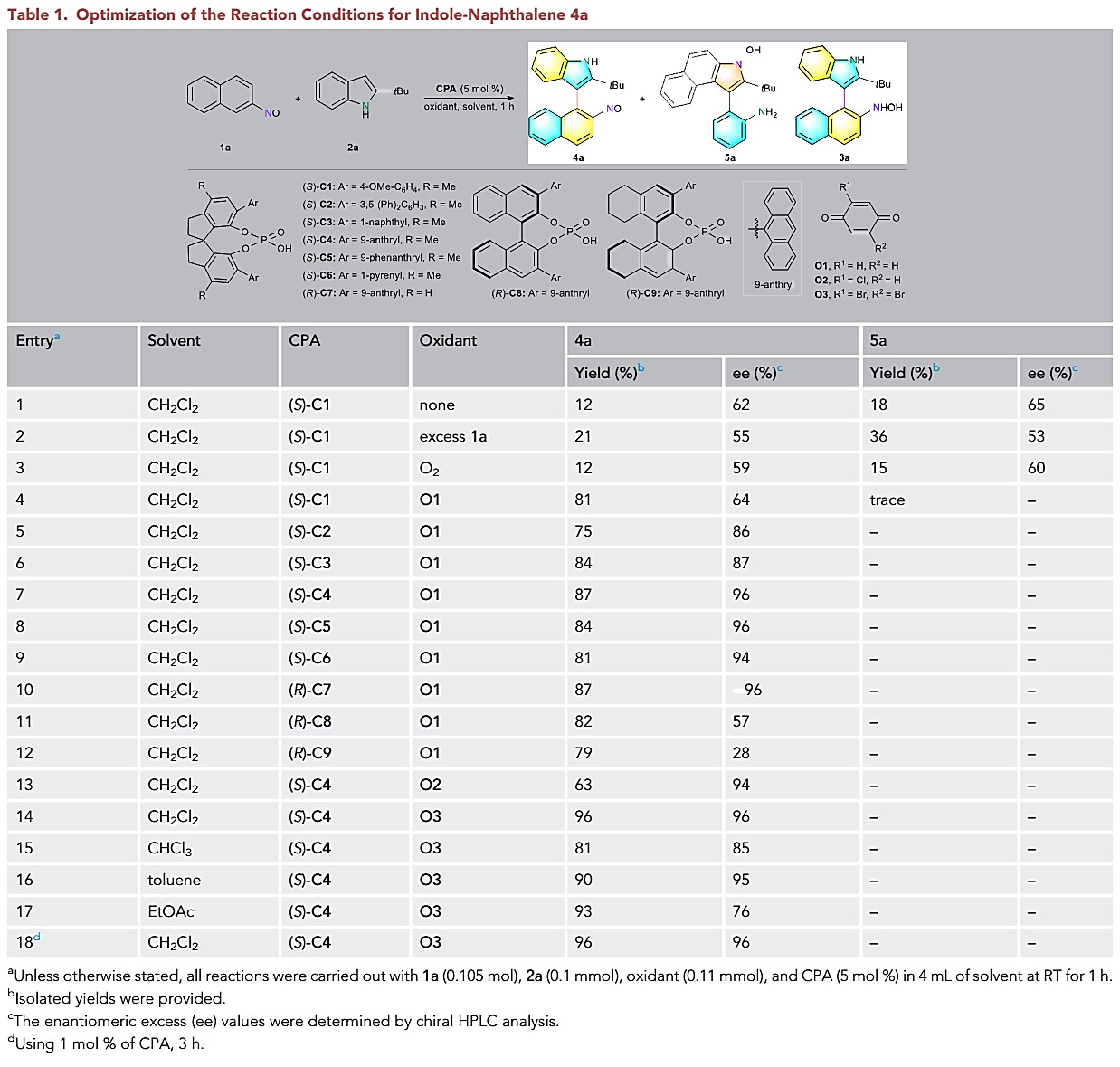
A:亚硝基萘-吲哚骨架轴手性化合物:首先,以2-亚硝基萘1a与叔丁基取代的吲哚2a为模板底物,在5 mol% CPA(S)-C1作为催化剂,以二氯甲烷作为溶剂,可在室温下进行反应,产物3a并没有得到,但获得氧化产物4a(收率12%,ee为62%)和5a(收率18%,ee为65%)(表1, entry 1)。通过对催化剂、氧化剂、溶剂等条件的筛选,最终作者以1 mol%的(S)-C4作为催化剂,以O3作为氧化剂,在二氯甲烷中室温反应为最优条件(表1, entry 18)。
表1. 条件筛选
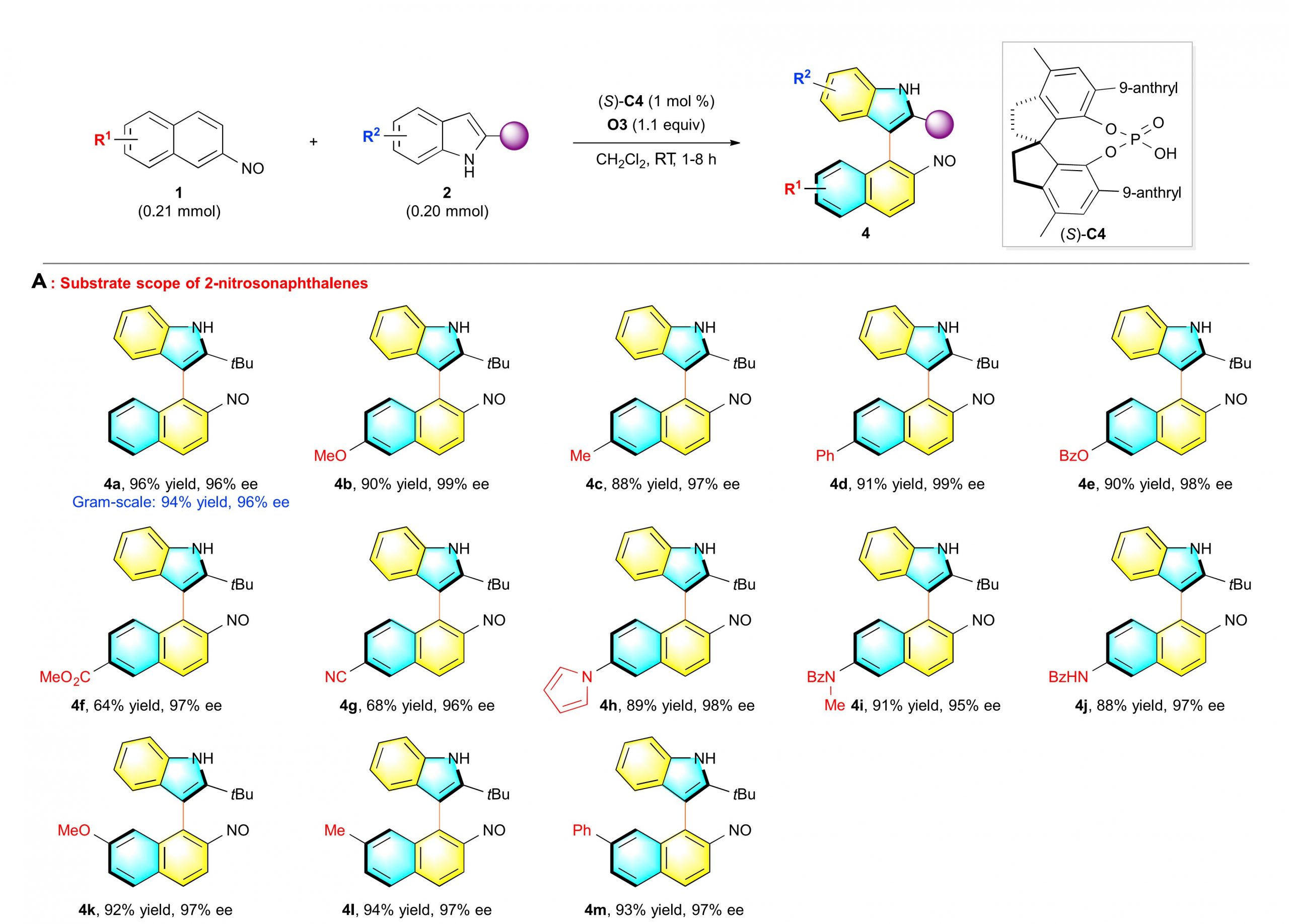
在获得上述最优反应条件后,作者首先对2-亚硝基萘底物进行了拓展研究。各种7-位或8-位不同基团取代的2-亚硝基萘均能较好地适应上述最佳的反应条件,并以优秀的收率和对映选择性(均>95% ee)得到相应产物(图 2 A)。同时,作者也对具有不同取代基的吲哚进行了底物拓展的研究,当吲哚2-位叔丁基换为其他位阻较大的烷基取代基时,均以优秀的对映选择性得到目标产物,但是,当叔丁基换为其他位阻较小的烷基取代基或者苯基时,产物在反应过程中已经消旋化。因此,作者在吲哚4-位引入甲基,且2-位为苯基或者甲基取代时,进行了新的条件探索,当以CPA(S)-C20为催化剂,均能获得中等收率以及良好对映选择性的目标产物(图 2 B)。
图2 A 不同取代的2-亚硝基萘拓展研究
图2 B 不同取代的吲哚拓展研究
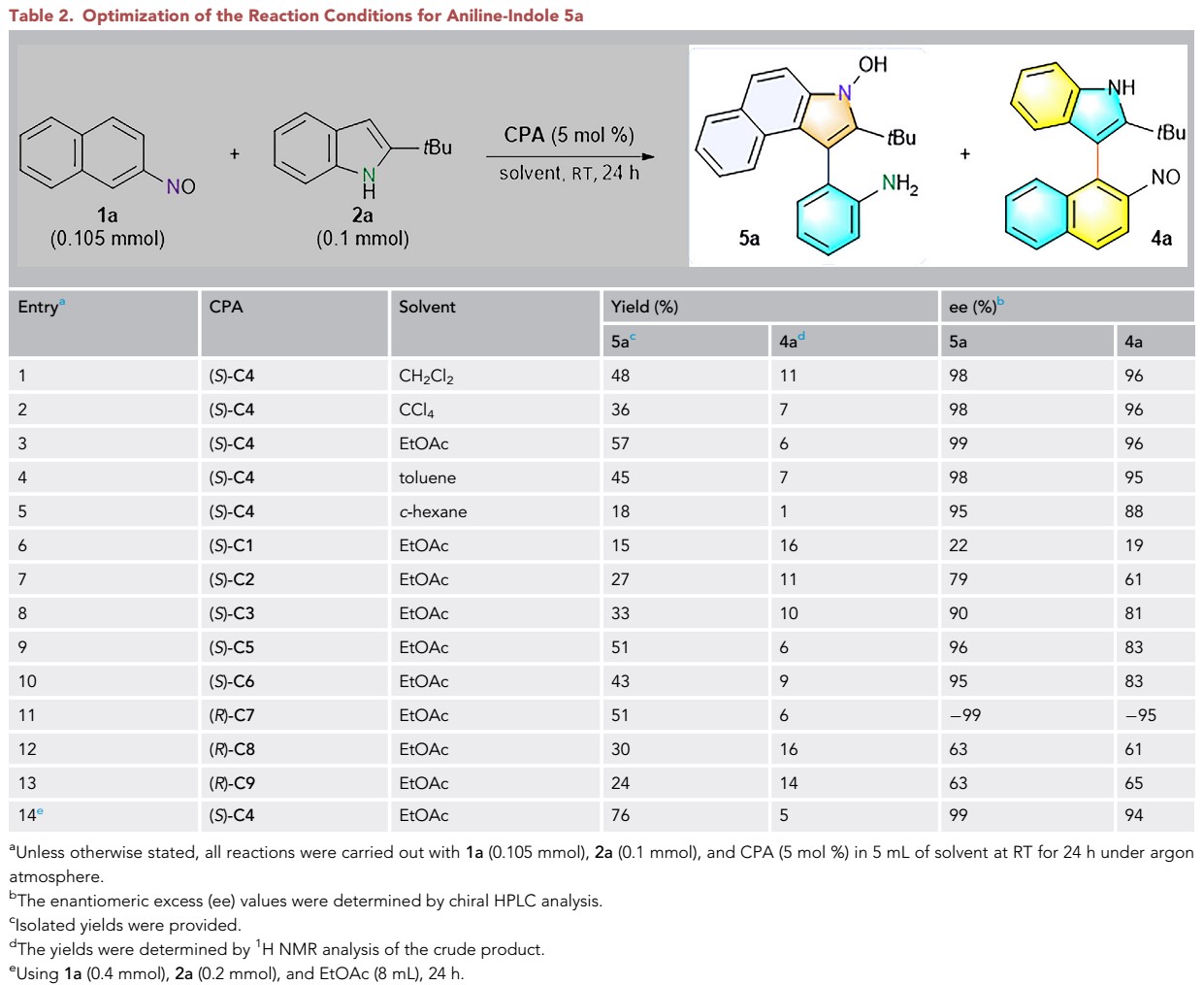
B.苯胺-吲哚骨架轴手性化合物:之后,作者对目标化合物5进行了底物拓展研究。首先,以2-亚硝基萘1a与叔丁基取代的吲哚2a为模板底物,以5 mol% CPA(S)-C4作为催化剂,以二氯甲烷作为溶剂,在室温下进行反应,可获得48%收率以及98% ee的产物5a(表2, entry 1)。通过对溶剂、催化剂、底物的比例等条件筛选,最终作者以5 mol%的(S)-C4作为催化剂,以乙酸乙酯作为溶剂,以两倍当量的1a下进行室温反应为最优条件,进行底物拓展研究(表2, entry 14)。
表2苯胺-吲哚骨架轴手性化合物条件筛选
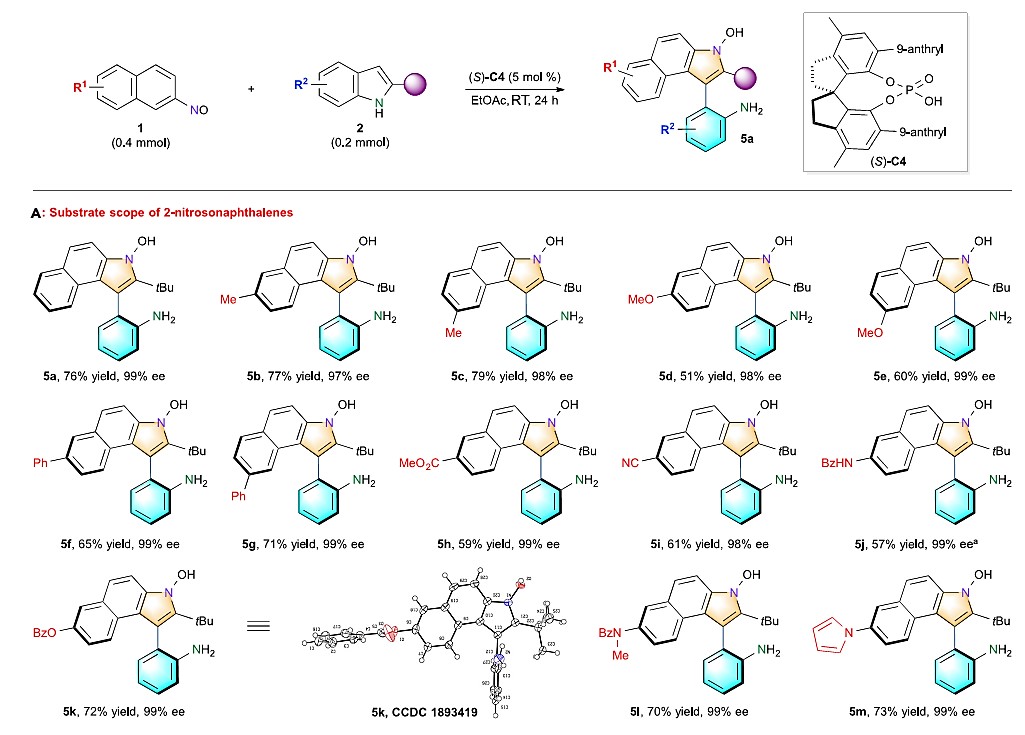
在最优反应条件下,作者首先对2-亚硝基萘进行了底物拓展研究。各种7-位或8-位不同基团取代的2-亚硝基萘均能较好地适应上述最佳的反应条件,从而以中等至良好的收率和优秀的对映选择性(均>97% ee)得到相应产物(图3 A)。同时,作者也对具有不同取代基的吲哚进行了的底物拓展研究,不同位置、不同电性取代基的吲哚均能很好的适应该反应。当吲哚2位叔丁基换为其他烷基取代基时,均能以优秀的对映选择性得到目标产物(图3 B)。
图3 A不同取代的2-亚硝基萘拓展
图3 B不同取代的吲哚拓展研究
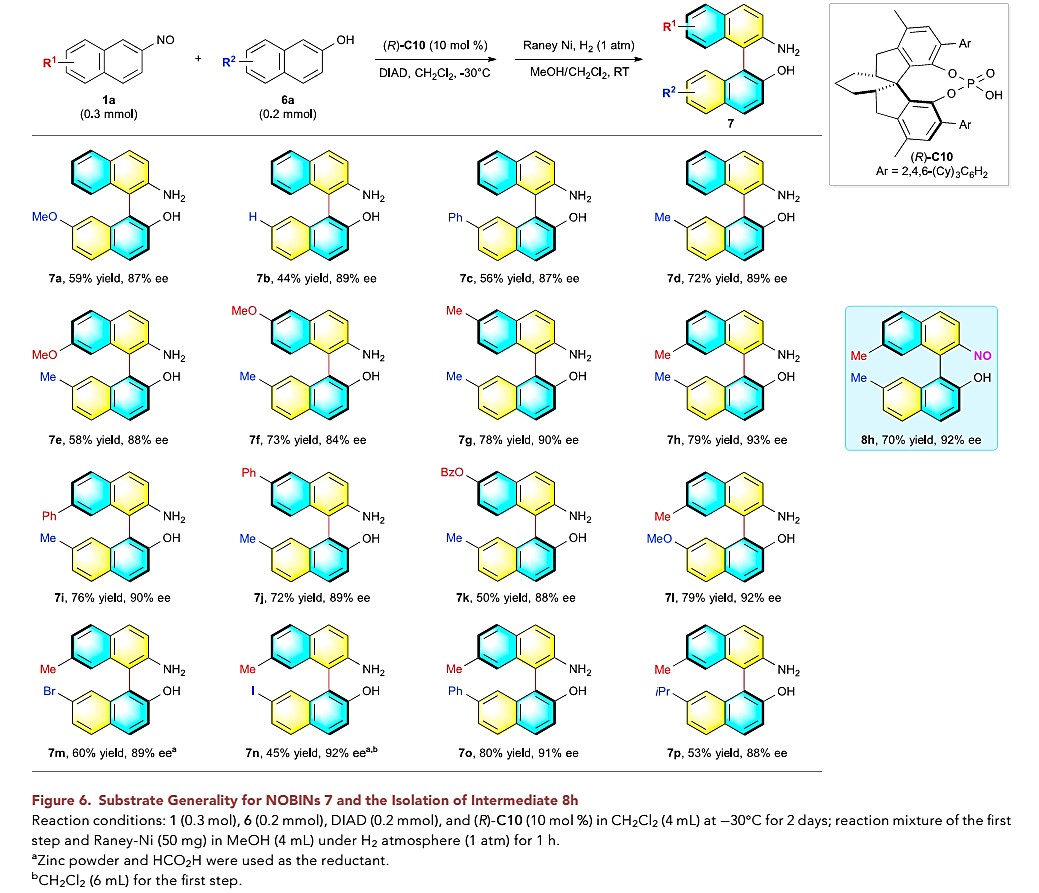
NOBIN轴手性化合物:此外,作者对NOBIN类目标化合物进行了底物拓展研究(图4)。首先,以2-亚硝基萘1a与7-甲氧基-2-萘酚6a为模板底物,以10 mol% CPA(R)-C10作为催化剂,以二氯甲烷作为溶剂,DIDA作为氧化剂,在-30 °C下进行反应,并经过连续的氢化过程,获得产物7a(收率59%, ee为87%)。作者进一步对具有不同取代基的2-亚硝基萘与2-萘酚进行了底物拓展研究,均以中等至良好的收率(50-80%)以及优秀的对映选择性获得相应的目标产物(84-93% ee)。
图4 NOBIN拓展研究
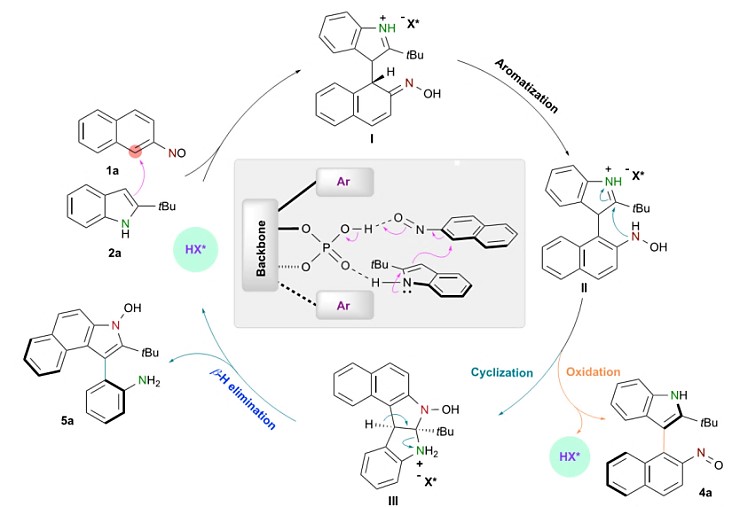
D:理论计算研究:作者提出了可能的反应机理,并进行了理论计算研究(图5)。在手性磷酸催化下,吲哚亲核进攻2-亚硝基萘,生成不稳定的σH加合物中间体,经过迅速的分子内转化,生成中间体I。进一步的芳构化生成中间体II,在氧化剂的存在下,可以得到目标产物4a。中间体II经过进一步的环化反应可以生成中间体III,经过β-H消除,可以得到目标产物5a。作者对反应过程进行了详细的理论计算研究,对我们认识反应过程有极大的帮助。
图5 可能的催化循环
论文总结评价
南方科技大学谭斌课题组报道了在DFT的指导下,利用手性磷酸作为催化剂,可在温和的条件下反应,实现吲哚(萘酚)骨架化合物与亚硝基萘的反应,并获得优异对映选择性的轴手性化合物,如亚硝基萘-吲哚骨架、苯胺-吲哚骨架以及NOBIN骨架等轴手性化合物。此外,作者提出了可能的催化循环机理,并对反应过程的详细机理进行了相关的理论计算研究。
参考文献
- [1] Wang, P. Verma, G. Xia, J. Shi, J. X. Qiao, S. Tao, P. T. W. Cheng, M. A. Poss, M. E. Farmer, K. S. Yeung, and J.-Q. Yu, Nature 2017, 551, 489-493. DOI: 10.1038/nature24632
- [2] S. S. Wilson, M. S. Hill, M. F. Mahon, C. Dinoi, and L. Maron, Science 2017, 358, 1168-1171. DOI: 10.1126/science.aao5923
- [3] W. C. MacMillan, Nature 2008, 455, 304-308. DOI: 10.1038/nature07367
- [4] W. Qi, J. H. Mao, J. Zhang, and B. Tan, Nat. Chem. 2018, 10, 58-64. DOI: 10.1038/NCHEM.2866
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.