本文作者:Sunny华
引言
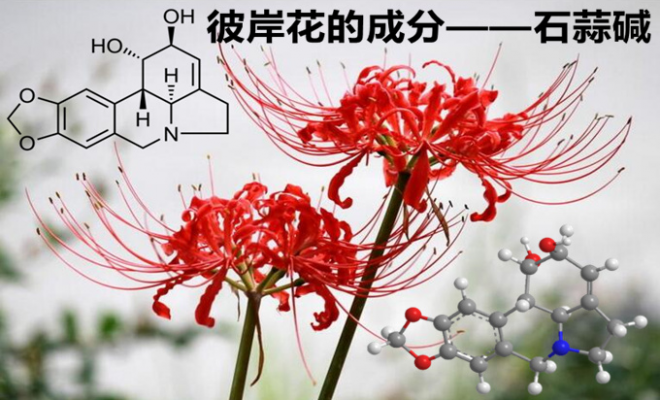
彼岸花,又称为曼珠沙华 (manjusaka),是一种原产于中国并广泛分布在长江中下游以及西南部分地区的多年生草本植物,也是东南亚地区常见的园林观赏性植物。有趣的是,民间以及佛教中有诸多关于彼岸花的传说,人们赋予它多种含义,并将它创作进入影视与文艺作品中。事实上,彼岸花学名为“红花石蒜”,为石蒜属植物,其英文名“Lycoris radiata”中“radiata”一词意为辐射状,形象表明了花朵盛开的娇艳形状。除园艺观赏价值外,石蒜属植物中含有多种重要的生物碱,因此,很早就石蒜属植物作为药用植物,应用于治病疗伤,其中含量较高的活性生物碱则是石蒜碱 (Lycorine)。
Fig. 1娇艳似火的彼岸花 (图片来源于网络)
石蒜碱的药理作用
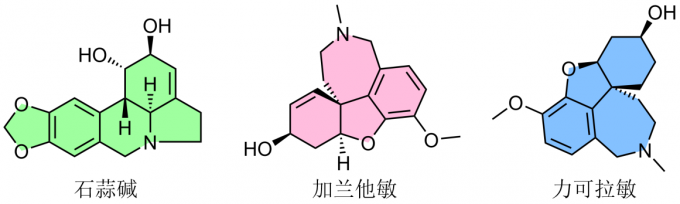
石蒜碱的药用历史十分悠久,明代李时珍《本草纲目》中曾记载:石蒜不仅具有解毒、祛痰、利尿、催吐等多种功效,还能够用于咽喉肿痛、痈肿疮毒、瘰疬(感染性外科疾病)与水肿等疾病的治疗。然而,石蒜属植物富含多种生物碱,成分较为复杂,直到1877年,主要成分石蒜碱才首次通过溶剂提取法分离获得。此外,石蒜属植物中还存在其他类型的生物碱,并且同样具有独特的生物活性,例如,加兰他敏 (Galantamine)能够应用于治疗轻度至中度Alzheimer症;力可拉敏 (Lycoramine)能够用于治疗小儿麻痹后遗症。同时,生物活性研究表明,石蒜碱及其衍生物具有抗炎、抗病毒、抗疟疾、抑制乙酰胆碱酯酶、保护心血管以及诱导肿瘤细胞凋亡等多种作用[1]。
Fig. 2石蒜属植物含有的主要生物碱
石蒜碱的生物合成
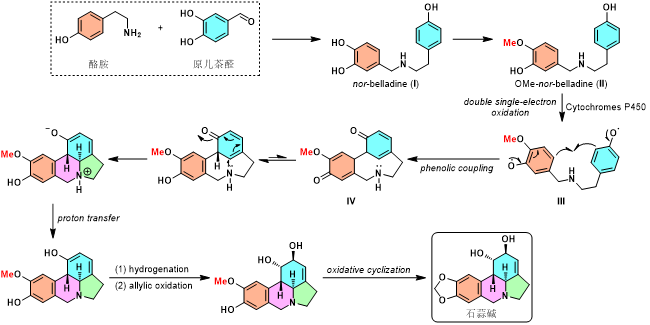
尽管石蒜碱是石蒜属植物中含量较高的生物碱,然而,其含量却仅有干质量的1%,而其生物合成过程却尽显大自然的鬼斧神工。研究表明,酪胺 (tyramine)与原儿茶醛 (protocatechuic aldehyde)是石蒜碱生物合成的起始原料。首先,二者经还原胺化过程,获得nor-belladine中间体 (I),之后,通过酚羟基的选择性保护,获得OMe-nor-belladine (II)。该中间体在生物酶的作用下,进行一系列相关的立体专一性转化,最终形成复杂的多环结构。首先,中间体II在细胞色素P450 (cytochrome P-450)作用下,经历两次单电子氧化过程,形成双酚氧自由基III,并随即进行相应的自由基偶联过程,形成关键产物IV,同时伴随芳构化过程与亲核氮原子的δ-共轭加成,进而完成全部环状骨架的构建。其中,六元环中双羟基结构的构建则是通过首先还原双键,之后进行烯丙位氧化而实现。最后,通过氧化环化步骤,完成Lycorine分子的生物合成[2]。
Fig. 3石蒜碱的生物合成
石蒜碱的化学合成
尽管石蒜碱具有良好的药用价值,然而,由于其天然含量过低,同时提取技术尚未成熟。因此,多数情况下,提取出的石蒜碱均为多种生物碱的混合物,因而,必须进行进一步的分离纯化。同时,相关的纯化的过程同样较为复杂繁琐,存在有机溶剂消耗量大与环境污染严重等问题。鉴于上述的不利因素,诸多化学家一直努力致力于完成石蒜碱的全合成研究,并涌现出多种不同的设计方案。
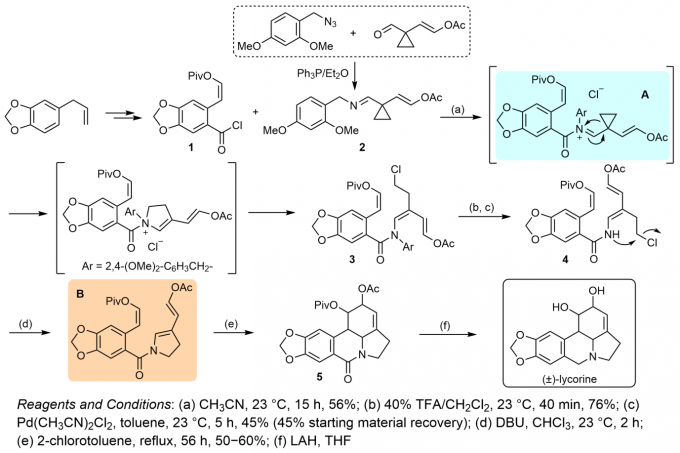
外消旋石蒜碱的全合成工作,最早由Boeckman等人在1988年首次完成。这项研究在学术界认定为最“优雅”的石蒜碱合成路线。其中,作者巧妙地设计,并通过环丙基酰亚胺正离子A(cyclopropyl acyliminium ion)的扩环重排过程,构建出后续Diels-Alder反应所需的关键双烯体3,并进一步经历去保护与双键异构化过程,形成中间体4,之后,中间体4通过分子内SN2反应过程,形成另一关键中间体B。中间体B在惰性溶剂中回流,继而通过Diels-Alder反应,顺利完成分子中所有环系的构建。最后,采用LiAlH4进行相应的还原去保护过程,即可获得外消旋石蒜碱产物[3]。
Fig. 4外消旋体石蒜碱的全合成路线
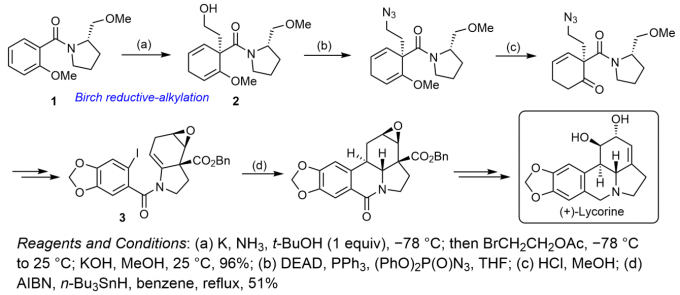
数年之后,对于石蒜碱的首次不对称全合成研究工作,由Schultz等人在1996年完成。然而,该小组获得的却是其左旋光学异构体,并非天然存在的右旋石蒜碱。尽管如此,Schulz小组的工作仍然充满亮点,并对后续右旋石蒜碱的不对称全合成研究提供了重要的指导。该小组选择脯氨酸衍生的酰胺1作为原料,并采用该课题组在1988年发展的非对映选择性“Birch还原-烷基化反应”方法学策略[4],将羟乙基结构成功引入相应底物中,并获得中间体2,随后,通过经典的Mitsunobu反应将羟基转化为叠氮基。同时,将乙烯基甲醚结构单元进行水解,并进一步通过互变异构化过程,转化为羰基结构单元。接下来,经历一系列复杂的转化过程,完成关键中间体3的构建,最后,通过AIBN与n-Bu3SnH引发的自由基环化过程,进而完成全部环系的构建。最终,Schulz团队通过15步反应,以1.4%的总产率获得(+)-Lycorine。[5]值得一提的是,直到2009年,天然 (-)-Lycorine的不对称全合成研究,才由Tomioka团队首次完成[6]。
图5石蒜碱的首次不对称全合成路线
结束语
以彼岸花为代表的石蒜科植物在我国分布较为广泛,石蒜碱是其中的主要成分,现代研究表明,石蒜碱及其衍生物具有多种潜在的药理作用。因而,进行此类化合物的研究能够较好地发挥我国的资源优势,充分利用自然资源,创造巨大的经济效益;另一方面,通过对石蒜碱及其衍生物的进一步研究,最终研发出对于严重危害人类健康的相关疾病,能够进行有效治疗的药物分子,同样具有重大的社会效益。因此,未来石蒜碱化学的研究将充满无限潜力。
参考资料
[1] 秦昆明, 李笑, 徐昭, 等. 石蒜碱及其衍生物的药理作用研究概况. 北京联合大学学报(自然科学版), 2009, 23, 6. [2] Z. Jin, Nat. Prod. Rep. 2005, 22, 111. doi: 10.1039/B316106B. [3] R. K. Boeckman, W. Steven Goldstein, M. A. Walters, J. Am. Chem. Soc. 1988, 110, 8250. doi: 10.1021/ja00232a056. [4] A. G. Schultz, M. Macielag, P. Sundararaman, A. G. Taveras, M. Welch, J. Am. Chem. Soc.1988,110, 7828. doi: 10.1021/ja00231a038.
[5] A. G. Schultz, M. A. Holoboski, M. S. Smyth, J. Am. Chem. Soc. 1996, 118, 6210. doi: 10.1021/ja9606440. [6] K. Yamada, M. Yamashita, T. Sumiyoshi, K. Nishimura, K. Tomioka, Org. Lett. 2009, 11, 1631. doi: 10.1021/ol9003564.


















No comments yet.