烯烃→醇
炔→醛,烯烃
- 概要
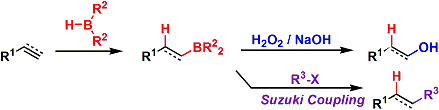
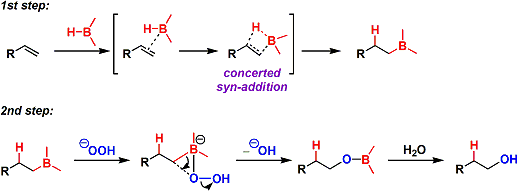
反应从B-H键对烯烃的位置、立体选择的顺式加成,接下来H2O2/NaOH氧化,可从烯烃合成反马氏醇。利用羟汞化或水合的反应则只能得到马氏规则的醇。所以两种方法相辅相成,选择合适的方法能选择合成反马氏醇或马氏醇。本反应也能从炔出发合成羰基化合物。
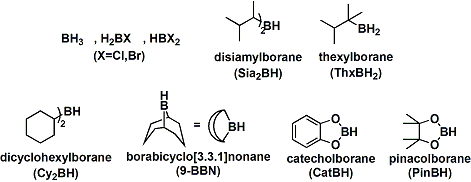
最基本的反应剂硼烷(BH3)以二聚体乙硼烷(B2H6)的形式存在。因为是有毒气体而且反应活性也比较低,它的实用性不高。
为了把乙硼烷变成单体的硼烷,可使它与配体作用结合生成硼烷加和物,在实际合成中较多使用。常见的硼烷配体如THF、二甲基硫醚或胺等。另外硼烷配合物的一些溶液有市售,方便使用。
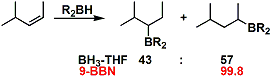
对有些反应,使用硼配合物时,硼氢化-氧化的立体选择性,位置选择性和官能团选择性不高。向硼烷引入较大的取代基能解决这个问题。B和H的电负性的差别不是很大,所以立体因素比电子因素影响要大。下面是有代表性的反应剂。对含氧的硼烷试剂(就像儿茶酚硼烷或片呐醇硼烷), 硼氢化-氧化的反应速度比较低。提高反应速度需要过渡金属催化剂的帮助。
反应剂里含不对称取代基的硼烷称光学活性硼烷。利用光学活性硼烷能合成不对称的醇化合物。二异松蒎烯基硼烷(Ipc2BH)是最有名的手性硼烷反应剂之一。它能从天然产物制备。从大量合成和反应性看,本反应剂的实用性较高。
近年,利用钯的偶联反应的研究有很大的进步。通过串联反应(硼氢化-氧化)→(Suzuki-Miyaura偶联反应)进行碳-碳结合的反应也能达到比较高的收率。
Purdue大学的H.C.Brown教授为了开发本反应和对有机硼化学的发展、在1979年和G.Wittig教授一起获到诺贝尔化学奖。
- 基本文献
・Brown, H. C.; Subba Rao, B C.J. Am. Chem. Soc. 1956, 78, 5694. DOI: 10.1021/ja01602a063
・Brown, H. C.; Subba Rao, B. C. J. Am. Chem. Soc. 1958, 80, 1552. DOI: 10.1021/ja01540a011
・Brown, H. C.“Hydroboration” W. A. Benjaminem, 1962.
・Zweifel, G. et al. Org. React. 1963, 13, 1.
・Brown, H. C. Tetrahedron 1981, 37, 3547. doi:10.1016/S0040-4020(01)98886-6
・Burgess, K.; Ohlmeyer, M. J. Chem. Rev. 1991, 91, 1179. DOI: 10.1021/cr00006a003
・Beletskaya, I.; Pelter, A. Terahedron 1997, 53, 4957. doi:10.1016/S0040-4020(97)00001-X
- 反应机理
① B-H键加成反应:首先、烯烃和B上面的空轨道发生相互作用并形成配合物。接下来进行协同顺式加成反应。
② B-C键的氧化断裂:过氧化氢的共轭碱与B的空轨道配位。之后,经过羟基的脱离而发生重排反应。反应过程中能保持碳原子上的立体化学。
- 反应实例
利用9-BBN能提高反应的位置选择性。
若用过氧化氢、使用羟胺磺酸盐或氯胺代替过氧化氢,可转换成胺化合物。
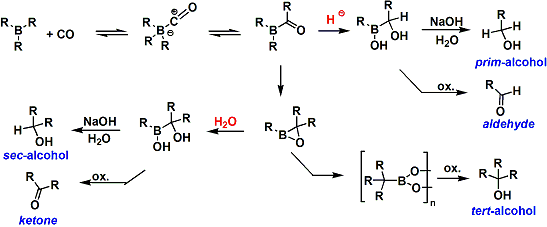
把三烷基硼化合物和一氧化碳在高温条件下反应、能使所有的烷基全转移到羰基的碳上。接下来通过水解反应能直接合成叔醇。本方法能利用在立体位阻大的醇化合物的合成中。因反应中间体形成的环氧硼烷的转移反应非常慢,添加水能使防止第三个烷基的转移反应。本合成法可以利用在仲醇或酮的合成中。另外,添加LiBH4等(氢负离子源)试剂能在烷基转移后生成的酮的阶段被还原、而得到伯醇或醛化合物。下面是反应的总结。
用Rh(I)对末端炔烃的硼氢化-氧化反应能利用Z-乙烯基硼化合物的合成。[1]反应通过铑烯中间体进行。
反应的位置选择性能完全由反应条件控制,可能发生逆转。如果使用Rh催化剂,底物中烯烃的反应性高于酮基等其他的官能团。对有配位性的官能团使用Crabtree催化剂进行硼氢化-氧化反应[2],能指向性选择合成非对应异构。
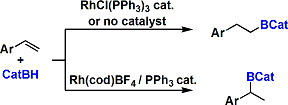
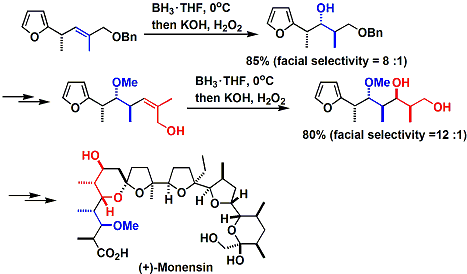
充分利用有立体选择性的硼氢化反应,岸group报告了Monensin的全合成。[3]其选择性可以从避开烯丙基的排斥而得到较稳定配位、及由立体位阻小的一边发生硼的加成来解释说明モデルで選択性は説明される。
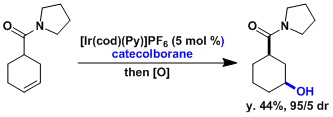
吡啶・硼烷配体(pyridine・borane-complex)能使底物在室温进行反应。和硼烷・THF配体不同、反应会停止在一取代物。得到的硼烷化合物能利用在下一步的各种各样的反应。[4]
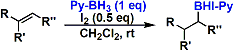
- 实验步骤
- 实验技巧
- 参考文献
[2] (a) Evans, D. A.; Fu, G. C.J. Am. Chem. Soc. 1991, 113, 4042. DOI: 10.1021/ja00010a083 (b) Evans, D. A.; Fu, G. C.; Hoveyda, A. H. J. Am. Chem. Soc. 1992, 114, 6671. DOI:10.1021/ja00043a009
[3] Schmid, G.; Fukuyama, T.; Akasaka, K.; Kishi, Y. J. Am. Chem. Soc. 1979, 101, 259. DOI:10.1021/ja00495a064
[4] Clay, J. M.; Vedejs, E. J. Am. Chem. Soc. 2005, 127, 5766. DOI: 10.1021/ja043743j
- 相关书籍
- 相关链接
・Herbert.C.Brown-Autobiography(Nobelprize.org)
・Organoborane (Wikipedia)
・Hydroboration-oxidation reaction (Wikipedia)
・Diborane(Wikipedia)
・9-BBN (Wikipedia)
・Hydroboration of Alkenes
・Brown Hydroboration (organic-chemistry.org)


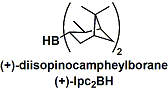
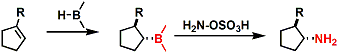
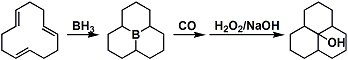
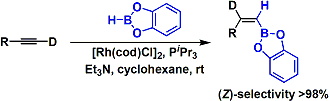

















No comments yet.