半胱酰胺(Cysteine, Cys)由于在自然界存在率比较低,侧基(SH基)的pKa较低(pKa ~ 8.2),所以具有比较强的亲核性、可以作为Bioconjugation靶点修饰基团。与赖氨酸类似的选择性修饰的手法近年来被大量开发,并且也可以用于基于活性的蛋白质组学方面的应用。
在许多情况下作为底物与马来酰亚胺进行迈克尔加成反应进行修饰、但是由于反应后成键的不稳定性,因此还存在很多问题,针对于这个弱点,也开发出了很多改良的手法。
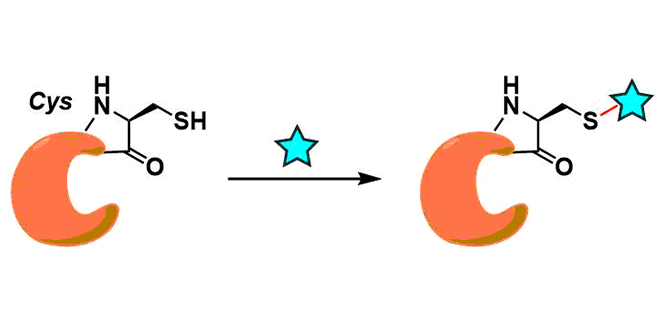
而本质的课题是,从蛋白质结构保持性等观点出发,大多数Cys在蛋白质中是以胱氨酸(二硫键型Cys二聚体)的形式存在,因此在对其进行修饰前,需要进行S-S键断链的还原性前处理。所以,在保持蛋白质的高次结构下,直接进行修饰是比较困难的。
为了回避这个问题,通过基因改造的方法,通过别的途径导入unpaired Cys再对其进行修饰。
对于Cys的修饰法有交联修饰法,脱氢丙氨酸介导法,天然化学连接法,N-末端Cys修饰等。
基本文献
<Review>
- Chalker, J. M.; Bernardes, G. J. L.; Lin, Y. A.; Davis, B. G. Chem. Asian J. 2009, 4, 630. DOI: 10.1002/asia.200800427
- Gunno, S. B.; Madder, A. ChemBioChem 2016, 17, 529. DOI: 10.1002/cbic.201500667
- Calce, E.; De Luca, S. Chem. Eur. J. 2017, 23, 224. DOI: 10.1002/chem.201602694
<Chemist’s Guide>
- Stephanopoulos, N.; Francis, M. B. Nat. Chem. Biol. 2011, 7, 876. doi:10.1038/nchembio.720de
- Gruyter, J. N.; Malihns, L. R.; Baran, P. S. Biochemistry 2017, 56, 3863. DOI: 10.1021/acs.biochem.7b00536
反应实例
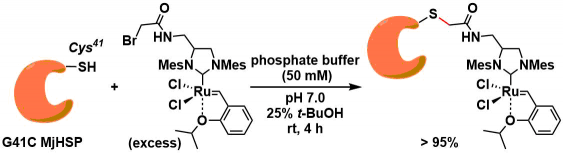
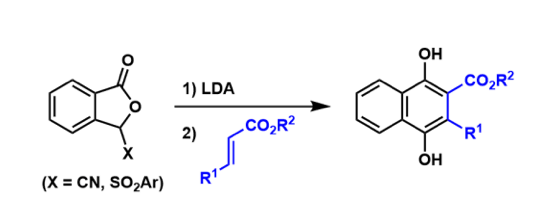
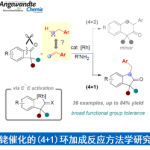
烷基化反应[1]:缺点是与可能会与其他亲核性氨基酸残(Lys, His)发生交叉反应。α-碘(溴)乙酰胺试剂被开发应用。下图是蛋白质与Grubbs催化剂结合,开发出新型复分解反应催化剂的一个实例[2]。
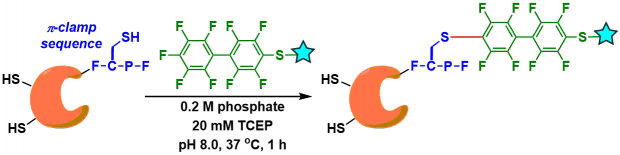
Perfluoroaryl化[3]: 芳香族亲核取代反应。生成的S-aryl键稳定性很好。然而局限再与反应试剂的水溶性差。
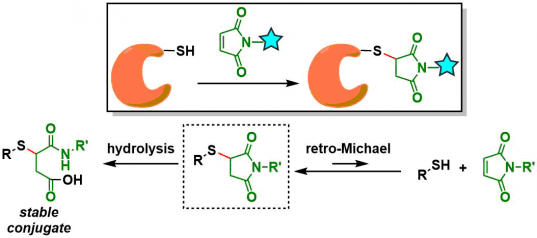
与马来酰亚胺进行迈克尔加成[4]:反应非常迅速,并且没有副产物生成,还能进行大scale的合成。然而具有以下问题点:通过逆迈克尔反应发生可逆的硫醇交换,并且还有可能会发生琥珀酰亚胺开环(为了生成更稳定的C – S键)。
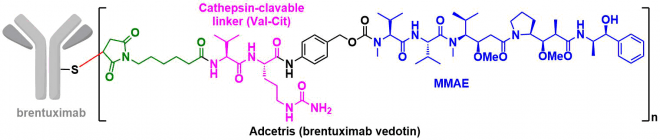
下图是市售ADC(抗体偶联药物)中的一种叫Adcetris的药物的结构,抗体的侧链通过Cys作为连接点,与抗癌小分子药物monomethyl auristatin E(MMAE)连接形成ADC药物。
其他的迈克尔受体型试剂还有、炔基酮[5]、炔基腈[6]、Allenamides[7]等反应被报道。
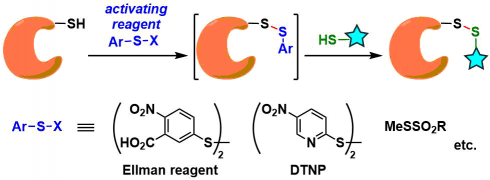
交叉二硫键形成[8]: S-S键虽然可能会与内在性的硫醇进行交换反应与具有redox-sensitive的弱点等问题存在,但是也有利于改善药物在生物体中的输送的特性。
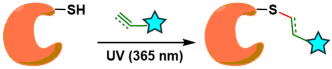
Thiol-ene Reaction: 优点是不需要有机溶剂,对氧气,水也具有一定耐受性。然而怕光,尤其是在UV照射下会引起蛋白质变性。
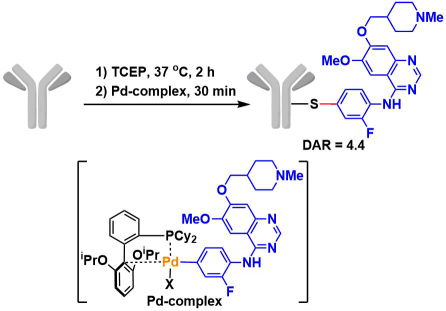
使用有机金属的转换法:毒性是一个巨大的问题,一般该方法修饰后无法进行in vivo的应用,但是作为方法学来说具有一定的魅力。铑卡宾的插入方法[9]、鈀催化的S-aryl化[10]、金催化的allen加成反应[11]等已经被报道。下图是通过S-aryl化反应的ADC的开发[10]。
实验技巧
S-S键的还原性断裂通常使用、三(2-羧乙基)膦(TCEP)盐酸盐。特点是在广域的pH下使用(1.5 < pH < 8.5)。
二硫苏糖醇(DTT)作为强力的还原剂使用频率也比较高,但是只能在中性条件下使用(pH>7)、并且对架桥试剂也具有一定反应活性,是其最大的弱点。
参考文献
- Recent Review: Calce, E.; De Luca, S. Chem. Eur. J. 2017, 23, 224. DOI: 10.1002/chem.201602694
- Mayer, C.; Gillingham, D. G.; Ward, T. R.; Hilvert, D. Chem. Commun. 2011, 47, 12068. doi:10.1039/C1CC15005G
- (a) Spokoyny, A. M.; Zou, Y.; Ling, J. J.; Yu, H.; Lin, Y.; Pentelute, B. L. J. Am. Chem. Soc. 2013, 135, 5946. DOI: 10.1021/ja400119t (b) Zhang, C.; Welborn, M.; Zhu, T.; Yang, N. J.; Santos, M. S.; Voorhis, T. V.; Pentelute, B. L. Nat. Chem.2016, 8, 120. doi:10.1038/nchem.2413
- Moore, J. E.; Ward, W. H. J. Am. Chem. Soc. 1956, 78, 2414. DOI: 10.1021/ja01592a020
- Shiu, H.-Y.; Chan, T.-C.; Ho, C.-M.; Liu, Y.; Wong, M.-K.; Che, C.-M. Chem. Eur. J.2009, 15, 3839. DOI: 10.1002/chem.200800669
- Koniev, O.; Leriche, G.; Nothisen, M.; Remy, J.-S.; Strub, J.-M.; Schaeffer-Reiss, C.; Dorsselaer, A. V.; Baati, R.; Wagner, A. Bioconjugate Chem. 2014, 25, 202. DOI: 10.1021/bc400469d
- Abbas, A.; Xing, B.; Loh, T.-P. Angew. Chem. Int. Ed. 2014, 53, 7491. DOI: 10.1002/ange.201403121
- (a) Ellman, G. L. Arch. Biochem. Biophys. 1959, 82, 70. doi:10.1016/0003-9861(59)90090-6 (b) Chatterjee, C.; McGinty, R. K.; Fierz, B.; Muir, T. W. Nat. Chem. Biol. 2010, 6, 267. doi:10.1038/nchembio.315
- Kundu, R.; Ball, Z. T. Chem. Commun. 2013, 49, 4166. doi:10.1039/C2CC37323H
- (a) Vinogradova, E. V.; Zhang, C.; Spokoyny, A. M.; Pentelute, B. L.; Buchwald, S. L. Nature 2015, 526, 687. doi:10.1038/nature15739 (b) Rojas, A. J.; Pentelute, B. L.; Buchwald, S. L. Org. Lett. 2017, 19, 4263. DOI: 10.1021/acs.orglett.7b01911
- Chan, A. O.-Y.; Tsai, J. L.-L.; Lo, V. K.-Y.; Li, G.-L.; Wong, M.-K.; Che, C.-M. Chem. Commun. 2013, 49, 1428. doi:10.1039/C2CC38214H
关联书籍
Bioconjugate Techniques, Third Edition
- 著者Greg T. Hermanson
- 参考価格¥ 12,249
価格¥ 12,159(2017/11/12 19:06時点) - 出版日2013/09/02
- 商品ランキング26,400位
- ハードカバー1200ページ
- ISBN-100123822394
- ISBN-139780123822390
- 出版社Academic Press
Bioconjugation Protocols: Strategies and Methods (Methods in Molecular Biology)
- 価格¥ 24,479(2017/11/12 19:06時点)
- 出版日2016/08/23
- ペーパーバック624ページ
- ISBN-101493960962
- ISBN-139781493960965
- 出版社Humana Press
外部链接
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!
















No comments yet.