本文投稿作者 楚子
概要
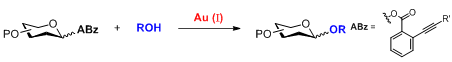
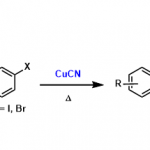
自1893年Fisher糖基化反应被建立以来,许多种不同类型的糖基化反应被开发出来应用于糖苷键的构建。目前,大多数的糖基化反应都需要化学计量的酸、酸酐或者Lewis酸的促进,使用非催化量促进剂的糖基化反应体系本身具有较强的酸性或反应体系中会有H+的聚集,使得合成不稳定的糖苷键具有非常大的挑战性。2008年,上海有机所俞飚研究员课题组发展了一种新型的糖基化方法,该方法通过使用Au(Ⅰ)络合物(如Ph3PAuOTf、Ph3PAuNTf2)对邻炔基苯甲酸酯供体进行高效的活化。离去基在活化过程中可以有效捕获反应中产生的H+ [1],从而使得反应体系一直保持在较为温和的条件下。这种新型糖基化反应具有反应条件十分温和、仅需要催化当量的活化剂、底物适用范围广的特点,对一些在其他糖苷化条件下不稳定的底物有较好的耐受性和选择性。目前,这种合成方法已被广泛应用于各种寡糖以及复杂天然产物的合成中(如:Tunicamycin V[2],Spinosyn A[3], Mannopeptimycins[4], Trioxacarcin C[5]等);这种新型的糖基化合成方法被大家称作俞氏糖基化反应(Yu Glycosylation)。
反应通式
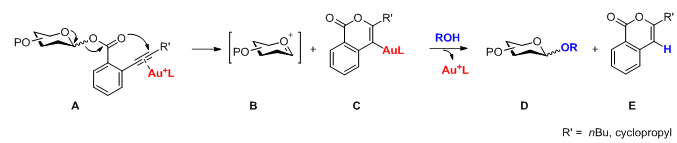
反应机理
糖基邻炔基苯甲酸酯供体A的离去基在Au(I)的活化下,通过分子内的合环反应离去形成含Au中间体C,同时生成氧鎓离子B。氧鎓离子B和亲核试剂发生糖基化反应生成产物D并释放出酸性质子,新产生的质子随即通过置换反应将被中间体C束缚的Au释放出来,实现Au(I)催化剂的再生和催化循环。
反应实例与应用
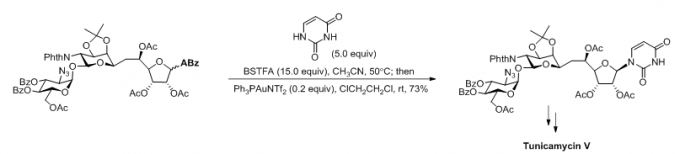
(1) Tunicamycin V的全合成[2]
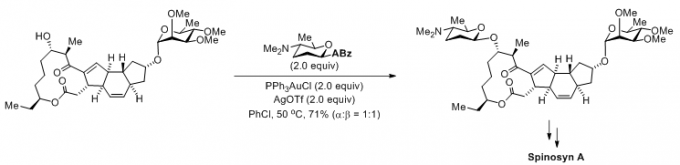
(2)Spinosyn A的全合成[3]
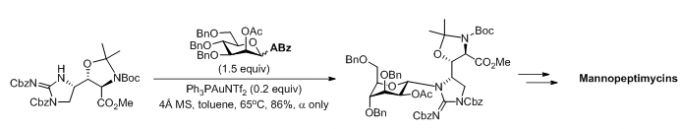
(3)Mannopeptimycins的全合成[4]
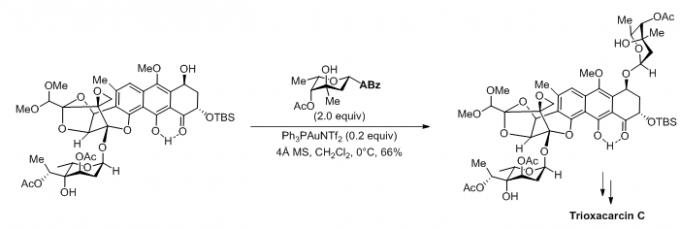
(4)Trioxacarcin C的全合成[5]
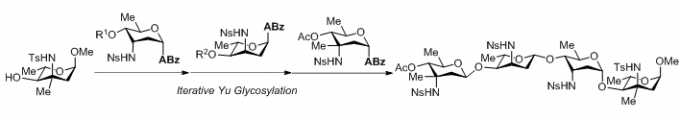
(5)3-氨基脱氧糖四糖的合成[6]
实验技巧
使用2-(环丙基乙炔基)苯甲酸可以制备出易于操作的固体糖基供体,并且制备成本相对更低[7]。在进行俞糖基化反应时,宜将供体和受体混合后先利用甲苯共沸除水,然后加入分子筛(如4Å MS)和无水溶剂,最后将金催化剂以溶液的形式滴加至反应体系中。在一些俞糖基化反应中,加入催化量的质子酸(如10 mol% TfOH)可促进Au(I)的循环,减少金催化剂的用量[8],提高此方法的经济性。
代表性文献
- (1) (a) Li, Y.; Yang, Y.; Yu, B.Tetrahedron Lett. 2008, 49, 3604-3608. (b) Yu, B.; Sun, J.; Yang, X. Acc. Chem. Res.2012, 45, 1227-1236. (c) Tang, Y.; Li, J.; Zhu, Y.; Li, Y.; Yu, B. J. Am. Chem. Soc. 2013, 135, 18396-18405.(d)Spell , M. L.; Deveaux, K.; Bresnahan, C. G. Ragains, J. R. Synlett , 2017, 28, 751-761.
- (2) Li, J.; Yu, B. Angew. Chem. Int. Ed. 2015, 54, 6618-6621.
- (3) Bai, Y.; Shen, X.; Li, Y.; Dai, M. J. Am. Chem. Soc.2016, 138, 10838-10841.
- (4) Wang, B.; Liu, Y.; Jiao, R.; Feng, Y.;Li, Q.; Chen, C.; Liu, L.;He, G.; Chen, G. J. Am. Chem. Soc. 2016, 138, 3926-3932.
- (5) Nicolaou, K. C.; Cai, Q.; Sun, H.; Qin, B.; Zhu, S. J. Am. Chem. Soc. 2016, 138, 3118-3124.
- (6) Zeng, J.; Sun, G.; Yao, W.; Zhu, Y.; Wang, R.; Cai, L.; Liu, K.; Zhang, Q.; Liu, X.; Wan, Q. Angew. Chem. Int. Ed. 2017, 56, 5227-5231.
- (7) Li, Y.; Yang, W.; Ma, Y.; Sun, J.; Shan, L.; Zhang, W.-D.;Yu, B. Synlett. 2011, 7, 915–918.
- (8) Zhu, Y.; Yu, B. Angew. Chem. Int. Ed. 2011, 50, 8329-8332.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!

















No comments yet.