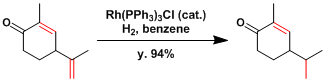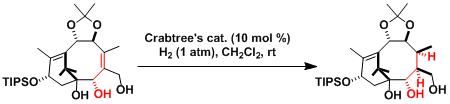- 概要
烯烃的均相催化加氢,氢顺式加成。另外、炔也可用同样的方法得到烷烃。均相体系有利于反应条件更加温和和实现良好的化学选择性。另一方面,后处理上稍微比非均相反应要麻烦一些。
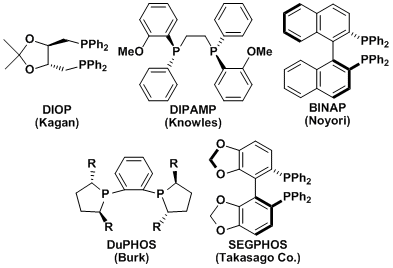
利用DIPAMP,实现了L-DOPA的工业化生产的W.S.Knowles、以及BINAP的发明者野依良治已经获得了2001年的诺贝尔化学奖。
- 基本文献
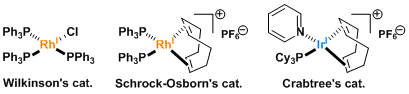
・Wilkinson catalyst: (a) Osborn, J. A.; Jardine, F. H.; Young, J. F.; Wilkinson, G. J. Chem. Soc. A 1966, 1711. doi:10.1039/J19660001711 (b) Harmon, R. E.; Gupta, S. K.; Brwon, D. J. Chem. Rev. 1973, 73, 21. DOI: 10.1021/cr60281a003
・Birch, A. J.; Williamson, D. H. Org. React. 1976, 24, 1.
・Crabtree catalyst: (a) Crabtree, R. H. Acc. Chem. Res. 1979, 12, 331. DOI: 10.1021/ar50141a005 (b) Crabtree, R. h.; Davis, M. W. J. Org. Chem. 1986, 51, 2655.DOI: 10.1021/jo00364a007
・Asymmetric Hydrogenation: (a) Ojima, I.; Clos, N.; Bastos, C. Tetrahedron 1989, 45, 6901. doi:10.1016/S0040-4020(01)89159-6 (b) Gridner, I. D.; Imamoto, T. Acc. Chem. Res. 2004, 37, 633. DOI: 10.1021/ar030156e
- 反应机理
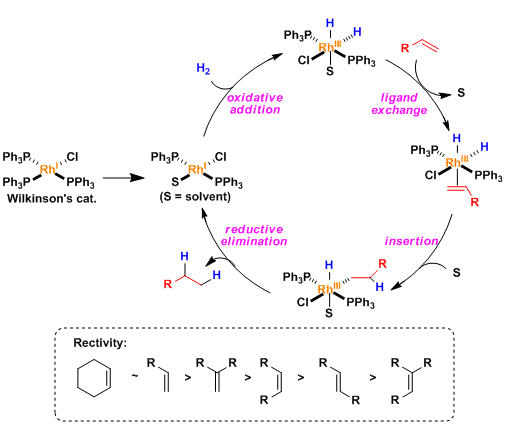
Wilkinson配体的情况、烯的插入是决定反应速率的阶段、因此容易配位的底物更容易发生反应。反应能力遵循以下顺序:
- 反应实例
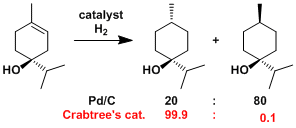
Schrock-Osborn催化剂或Crabtree催化剂那样的阳离子催化剂、近旁有能配位的官能团存在的话,能定位催化剂达到立体选择性还原。[1]
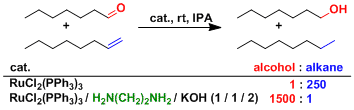
选择性还原烯烃的例子。硝基,氰基,羰基等不会被还原。有醛的存在会发生脱羰基化,因此不能做底物使用。
L-DOPA的工业不对称加氢
Taxol的合成[2]
加入二氮配体的话、化学选择性会发生大的改变。这可以由胺上的氢和羰基的氧相互作用的中间态来解释。(参照野依不对称氢迁移反应)。
- 实验步骤
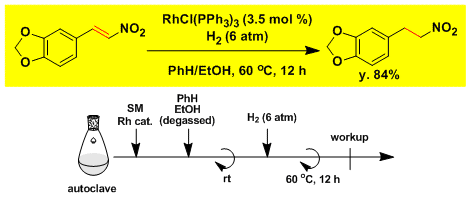
硝基烯烃的还原[3]
- 实验技巧
通常被称为Wilkinson配体的Rh配体是首选、反应活性较低的四取代烯烃不发生反应。用Ir做中心的Crabtree催化剂能使四取代的烯烃发生还原反应。
使用不对称的双齿磷配体的不对称加氢技术,到现在有了高速的发展、多种加氢过程已经被应用于工业生产。在这之中,以下的配体都是具有非常的历史价值和实用性的。
- 参考文献
[1] (a) Crabtree, R.H. Davis, M. W. J. Org. Chem. 1986, 51, 2655. DOI: 10.1021/jo00364a007 (b) Brown, J. M.; Hall, S. A. Tetrahedron Lett. 1984, 25, 1393. doi:10.1016/S0040-4039(01)80167-2
[2] Wender, P. A. et al. J. Am. Chem. Soc. 1997, 119, 2755 & 2757. DOI: 10.1021/ja9635387 DOI: 10.1021/ja963539z
[3] Harmon, R. E.; Parsons, J. L.; Cooke, D. W.; Gupta, S. K.; Schoolenberg, J. J. Org. Chem. 1969, 34, 3684. DOI: 10.1021/jo01263a122