作者:石油醚
导 读
近日,厦门大学卓春祥教授团队开发了新型手性低价Salen-Mo催化剂,并实现了首例催化不对称脱氧环丙烷化反应,合成了一系列有价值的、具有高光学纯度的手性环丙烷化合物。该策略不仅为手性环丙烷的合成提供了一条全新的、具有前景的路线,而且为手性低价salen-Mo催化剂在不对称催化中的潜在应用打开了一扇新的窗口。
“Catalytic Asymmetric Deoxygenative Cyclopropanation Reactions by a Chiral Salen-Mo Catalyst
Li-Ya Cao, Jia-Le Wang, Kai Wang, Jiang-Bin Wu, De-Ku Wang, Jia-Min Peng, Jin Bai, and Chun-Xiang Zhuo*
J. Am. Chem. Soc. 2023, ASAP. doi: 10.1021/jacs.2c12225”
正 文
手性环丙烷结构广泛分布在一系列天然产物和已批准上市的药物中(图1 A)。由于手性环丙烷的独特性质,使其在药物研发中非常具有吸引力。鉴于此,化学界对环丙烷结构的不对称合成产生了极大的兴趣。在众多合成策略中,通过过渡金属催化的重氮化合物与烯烃的不对称环丙烷化反应可以方便地用于构建手性环丙烷(图1 B)。然而,高能量的重氮化合物不仅具有潜在的爆炸性,而且其合成往往需要使用危险的试剂和多步操作。因此,开发安全、廉价易得的重氮化合物替代物,将会使该方法更具有吸引力和广阔的应用前景。
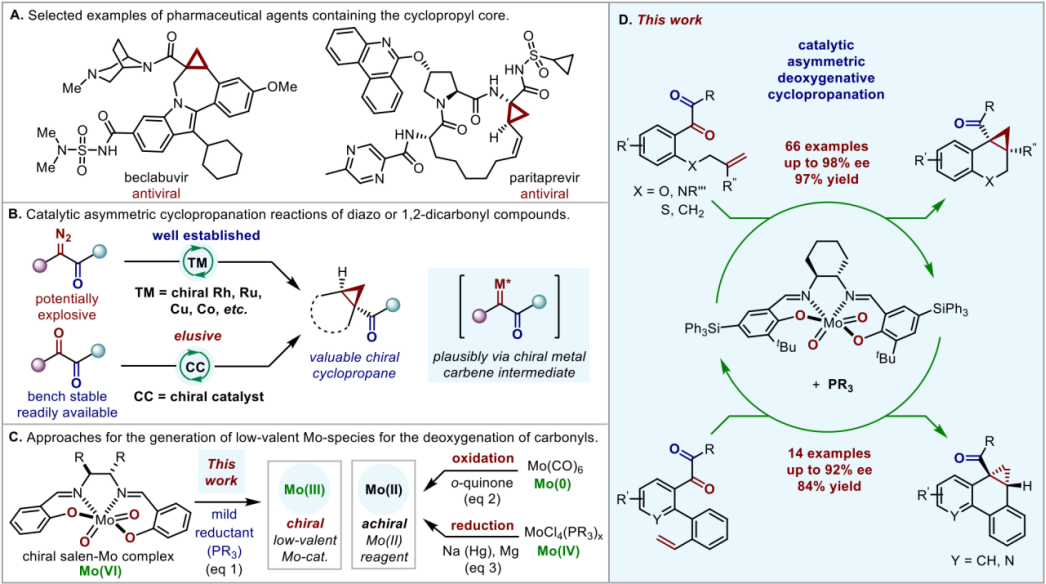
图1
稳定且易于获取的羰基或1,2-二羰基化合物被认为是卡宾前体的理想候选者(图1 B)。然而,由于羰基碳氧双键的断裂需要较高的活化能,且羰基丰富的反应活性往往可能诱发多种副反应。因此,羰基作为卡宾前体存在着重大挑战。迄今为止,仅有少数依赖化学计量的金属试剂和还原剂或低价过渡金属配合物的例子被报道。其中,通过化学计量的锌促进的或者金属钼络合物催化的羰基或1,2-二羰基化合物的直接脱氧环丙烷化反应特别值得注意,因为这两种方法不仅避免了危险重氮化合物的使用,而且实现了外消旋环丙烷的合成。尽管这些研究进展非常出色,但目前还没有通用的不对称催化体系可用于羰基或1,2-二羰基化合物与未活化烯烃的直接催化不对称脱氧环丙烷化反应。
厦门大学卓春祥课题组一直致力于发展新型金属钼催化的羰基直接脱氧官能团化反应(Angew. Chem. Int. Ed. 2021, 60, 15254; ACS Catal. 2022, 12, 11428−11435),前期发展了首例消旋版本的钼催化的1,2-二羰基或单羰基化合物的直接脱氧环丙烷化反应(Angew. Chem. Int. Ed. 2021, 60, 15254)。之后,他们将研究目标转向更具有挑战性的催化不对称版本。此研究关键在于开发出一种既能区域选择性地断裂底物中的两个碳氧双键之一,又能控制不对称环丙烷化立体选择性的手性金属钼催化剂。
受钼酶在生物体内氧原子转移反应中的普遍应用的启发,作者设想将廉价易得、稳定的六价二氧化钼物种与手性salen配体结合起来,并通过加入膦作为温和的还原剂,现场生成具有催化活性的手性低价金属钼物种(图1 C,eq 1)。相较于文献采用3,5-二叔丁基邻苯醌氧化有毒的零价Mo(CO)6(图1 C,eq 2)或用强金属还原剂如钠汞齐或镁还原敏感的四价MoCl4(PR3)x来生成非手性的二价钼脱氧试剂(图1 C,eq 3),该新方法更加安全、温和、简便,并可方便地用于不对称催化。虽然概念设计上看似简单,但是该类转化非常具有挑战性。首先,尽管在过去的几十年里其他手性salen金属配合物(如金属Mn、Co和Cr)已经取得了巨大的成功,但手性salen-Mo (VI)配合物在不对称催化中的应用仍然非常少见。因此,实现手性salen-Mo催化剂控制反应的高对映选择性是需要解决的首要难题;其次,需要寻找一种合适的氧受体和还原剂,可以与手性salen-Mo催化剂兼容,并能够有效地生成具有催化活性的手性低价钼物种。
近日,卓春祥教授团队报道了首例手性salen-Mo催化的1,2-二羰基化合物的直接催化不对称脱氧环丙烷化反应。该反应以专一的区域选择性、中等到优秀的收率和良好到优秀的对映选择性获得一系列取代的手性环丙烷产物(图2)。反应所使用的手性钼催化剂方便易得,反应操作简单并成功应用于一系列生物活性分子的衍生化。此外,这个手性salen-Mo催化体系同样可以应用于苯乙烯类型底物3的不对称脱氧环丙烷化反应(图3)。
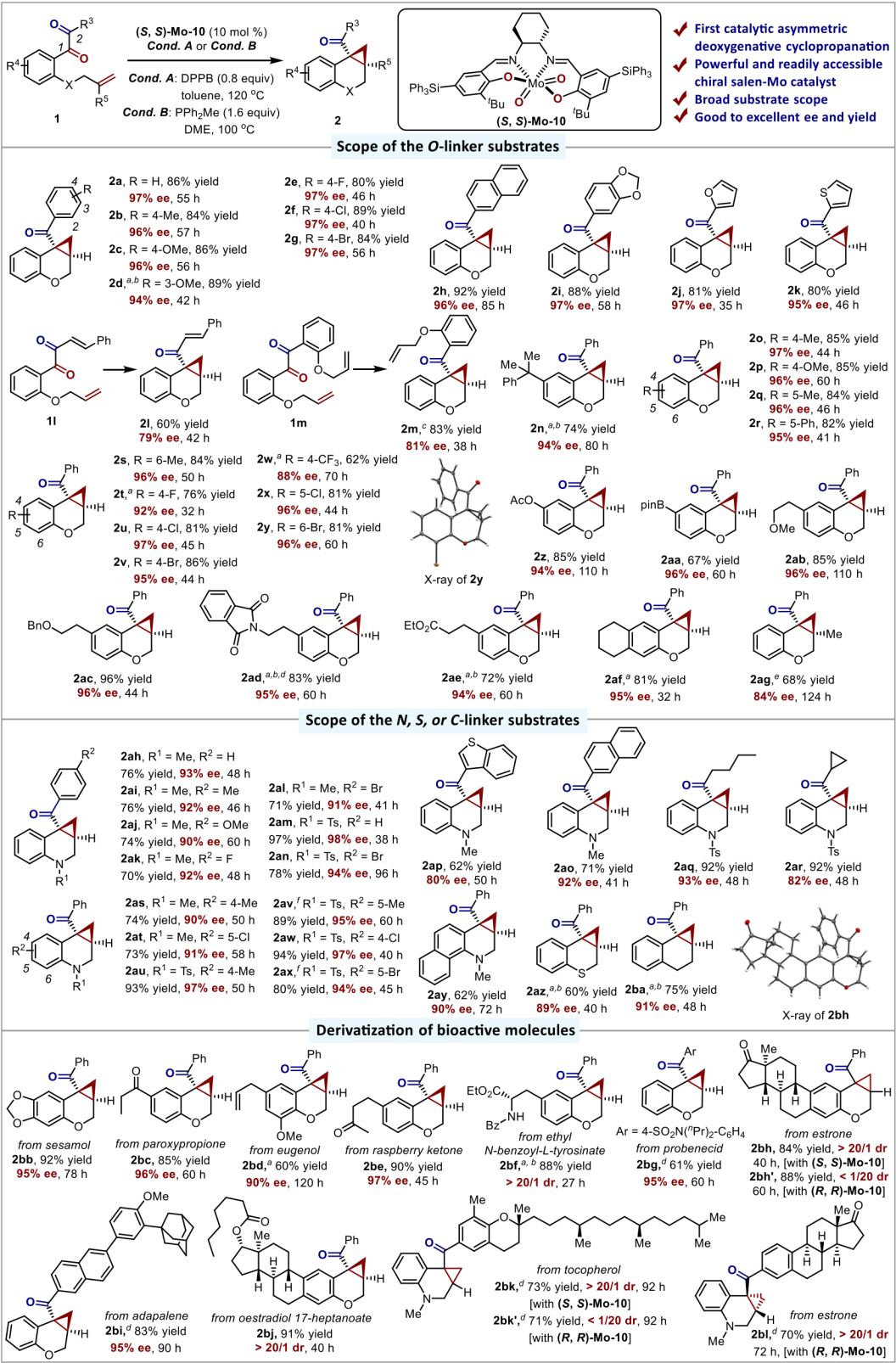
图2
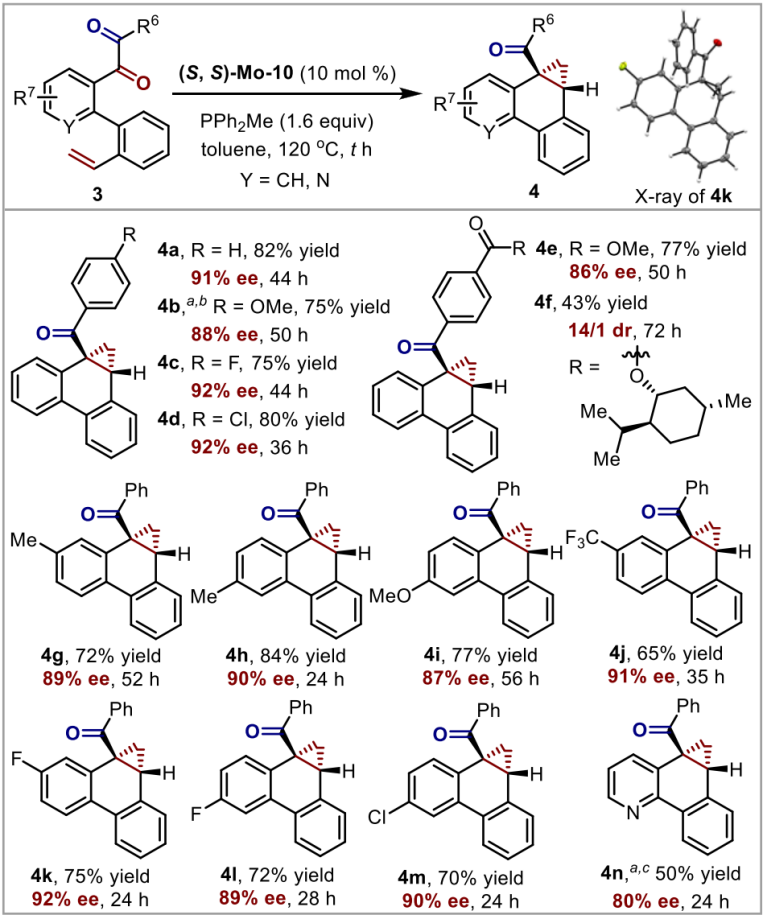
图3
随后,作者进行了放大量实验和合成转化,以展示该方法的实用性(图4)。在几百毫克的规模上,反应可以顺利进行。手性环丙烷产物可以进一步发生Wittig反应、Beckmann重排、Suzuki偶联、Sonogashira偶联、DIBAL-H还原和Simmons-Smith反应等转化,构建多种含有手性环丙烷结构的化合物。在这些反应条件下,环丙烷结构均可以被很好的兼容且光学纯度得到很好的保留。
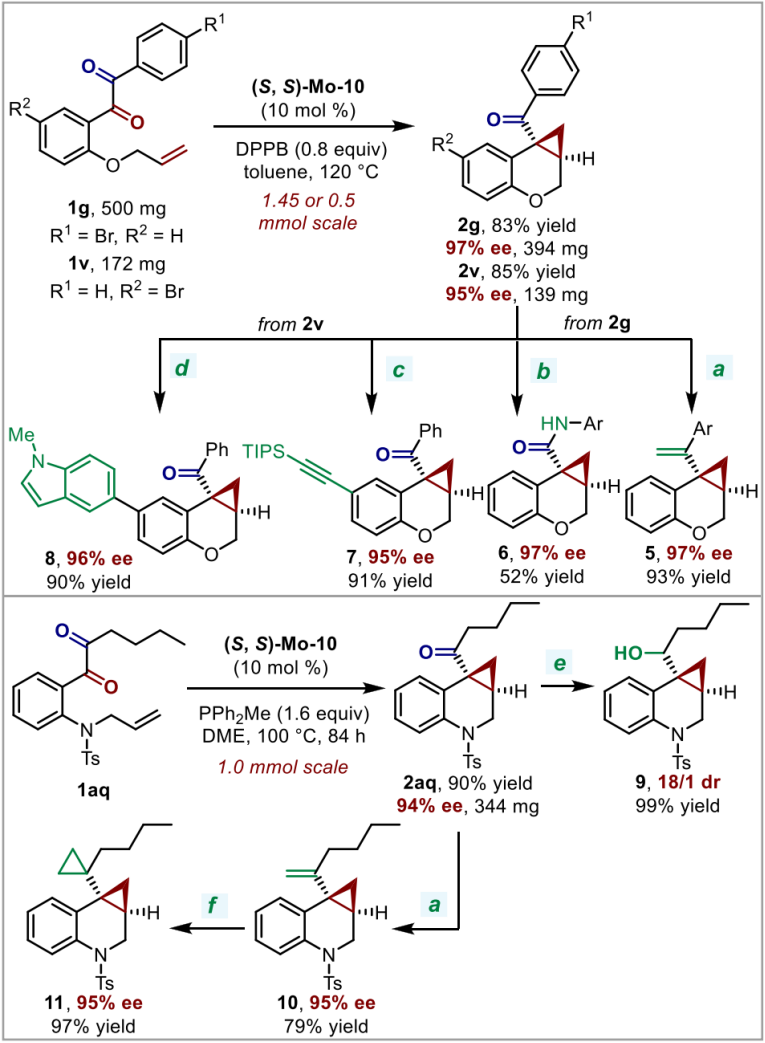
图4
为了阐明反应机理,作者进行了初步的机理研究。 首先,在氘苯中将Mo(VI)络合物(Mo-1)与DPPB在45℃下混合,定量生成氧桥双核Mo(V)络合物(Mo-11),其结构通过单晶证实,该络合物可能是由Mo(VI)络合物与原位生成的Mo(IV)络合物通过归中反应生成(图5 A,eq 1)。 有趣的是,通过简单地调节反应温度,可以选择性地形成推测结构为氧桥双核的低价Mo(III)络合物(Mo-12) (图5 A,eq 2)。另外,该钼物种(Mo-12)也可以通过还原双核Mo(V)络合物(Mo-11)获得(图5A,eq 3)。接下来, 将两种钼络合物(Mo-11和Mo-12)分别与底物1b反应(图5 A,eq 4和eq 5)。结果表明三价的Mo-12可以促进底物1b的脱氧环丙烷化,而Mo-11则完全无活性。而且化学计量的三价Mo-12与底物1b的反应中,三价的Mo-12几乎定量转化为五价的Mo-11,该结果也支持了Mo-12为氧桥双核Mo(III)络合物的结构推测(图5 A,eq 5)。此外,Mo-12的高分辨质谱(HRMS)和红外光谱(IR)数据进一步支持了这一推测。总的来说,这些结果表明双核Mo(III)物种(Mo-12)是该反应的催化活性物种。 基于此,作者提出了一个可能的催化循环(图5 B)。
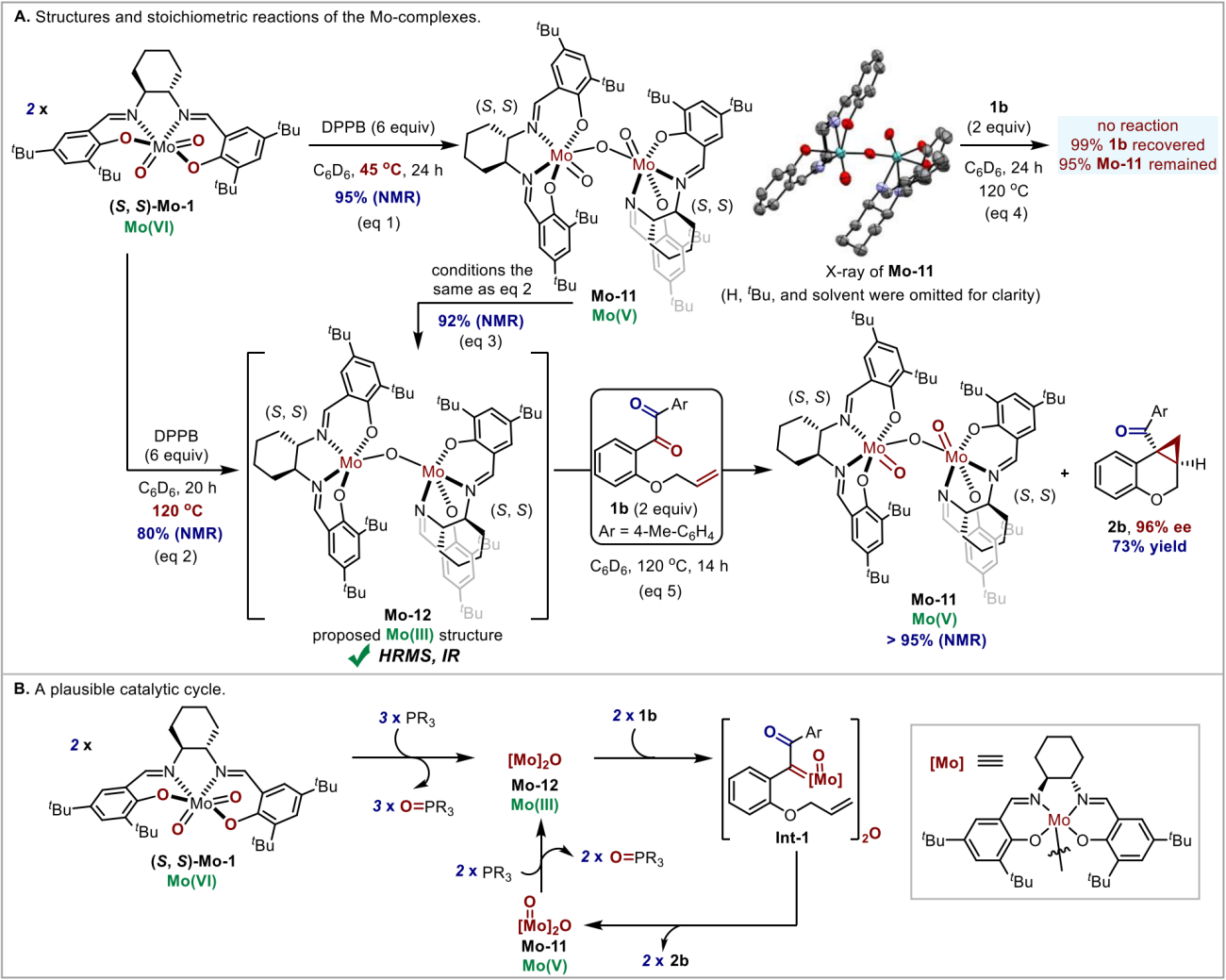
图5
小结:
在该工作中,卓春祥教授团队开发了新型手性低价salen-Mo催化剂,并实现了首例催化不对称脱氧环丙烷化反应,合成了一系列有价值的、具有高光学纯度的手性环丙烷化合物。该策略不仅为手性环丙烷的合成提供了一条全新的、具有前景的路线,而且为手性低价salen-Mo催化剂在不对称催化中的潜在应用打开了一扇新的窗口。
(卓春祥课题组供稿)
课题组长简介
卓春祥,福建省“闽江学者”特聘教授,博士生导师,国家高层次人才计划,厦门大学化学化工学院有机化学研究所副所长。2009年本科毕业于湖南大学化学系,2014年博士毕业于中国科学院上海有机化学研究所(导师:游书力 研究员)。2014年至2019年,在德国马普煤炭所Alois Fürstner教授课题组进行博士后研究。2019年4月入职厦门大学开展独立研究工作,主要研究方向为新型有机合成方法学、不对称催化、活性天然产物及药物分子的合成。迄今发表论文28 篇,被引用2800余次。课题组主页:https://zhuolab.xmu.edu.cn/index.htm
欢迎有机化学方向的博士后和科研助理加入本课题组,待遇详见:https://zhuolab.xmu.edu.cn/joinus.htm



















No comments yet.