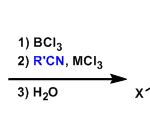
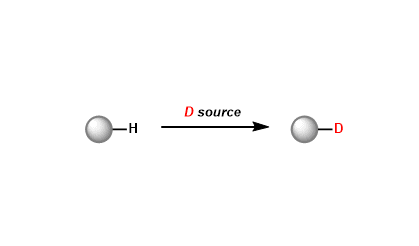
酮,醛→烯烃
概要
・叶立德在一般情况下,是带正电荷的杂原子使相邻负离子稳定的一类化学物种。用磷叶立德(phosphorous ylide)把羰基化合物转化为烯烃的反应叫Wittig反应。
・如果利用经典的E2消去反应条件,反应需要强酸或强碱或高温条件。另外,常面临位置选择性,双键顺反异构化等问题。Wittig反応的优点在于它的高效率的官能团选择性,反应性较好,在低温条件也能进行的。因为合成操作简单,产率较好,能控制顺反构型,直到现在也频繁的被应用于合成。是将羰基化合物变成烯烃的首选的反应。
・Wittig反应的缺点是,清除反应后产生的氧化膦非常困难。改良wittig反应为Horner–Wadsworth–Emmons反应(把常用的三苯基膦换成磷酸酯) 改善了wittg反应的这个缺点。Horner–Wadsworth–Emmons反应产生的磷副产物极性大,水溶性,使纯化非常容易。
・反应性・试剂的碱性・顺反异构的控制,对于四取代烯烃的合成通常较困难。
・发明本反应的G. Wittig教授(Heidelberg大学)由于他对有机膦在合成化学中的研究贡献,在1979年获得诺贝尔化学奖。
基本文献
・Wittig, G.; Schöllkopf, U. Ber. 1954, 87, 1318. doi:10.1002/cber.19540870919
・Maercker,A. Org. React. 1965, 14, 270.
・Maryanoff, B. E.; Reitz, A. B. Chem. Rev. 1989, 89, 863. DOI: 10.1021/cr00094a007
・Schlosser Modification: Angew. Chem. Int. Ed. Engl. 1966, 5, 126. doi:10.1002/anie.196601261
反应机理
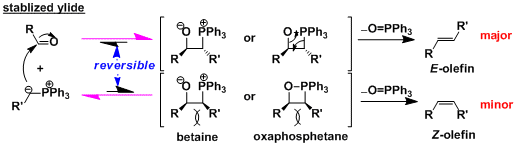
首先,磷叶立德加成到羰基化合物后产生的偶极中间体betaine或者膦氧四元环中间体。消去氧化膦后产生烯烃。因为磷和氧原子的作用力非常强是本反应的动力。关于中间体,有一些膦氧四元环中间体已经被分离,并且确认结构。但偶极中间体betaine至今为止还没有被正式报道。
碳负离子被邻接的吸电子基团稳定并可分离的磷叶立德称稳定叶立德。从稳定叶立德会产生的E-烯烃。
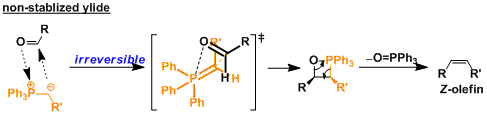
不可分离对空气和水分不稳定的叶立德叫不安定叶立德。因为不可长时保存,这种叶立德需要用现用现制。另外,不稳定叶立德的反应后经常产生Z-烯烃。
对于稳定叶立德,磷叶立德和羰基化合物的加成步骤是可逆反应。膦氧中间体是在加热条件下最稳定的中间体,目标产物主要是E-烯烃。
因为不稳定叶立德的反应性非常强,叶立德和羰基化合物的附加反应是不可逆反应。因此、不稳定叶立德的反应是以速度論为主,而反应过程中会产生膦氧四元环中间体。
就像下面的分子式,膦氧四元环中间体通过空间位阻斥力最低的过渡态。继续消去氧化膦后产生Z-烯烃。
在反应系内若同时存在锂盐等则会降低Z-体的选择性。
反应实例
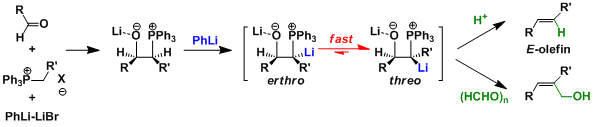
将磷叶立德在低温条件下加入醛中生成中间体,用PhLi等强碱处理后得到β-氧化叶立德。这可以从向热力学稳定的threo型中间体转变来解释。利用这个转变,可以由不稳定叶立德合成E-烯烃(Schlosser变换)。β-氧化叶立德可以和各种各样的亲电试剂反应,并可利用在许多官能团的合成中。
一般磷叶立德不会和酯反应。但是分子内反应例外,会生成烯醇醚。
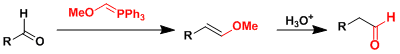
由MOMCl和PPh3制备的甲氧基亚甲基三苯基膦能使醛/酮增加一个的碳原子。
实验步骤
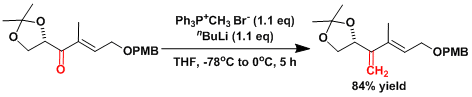
把甲基三苯基溴化鏻(7.84g, 21.6 mmol)悬浮于脱水THF中(10mL)。在-78℃低温下滴加正丁基锂(20.7 mmol)。然后将反应液升至0℃,撹拌1h后,再把温度降到-78℃。把酮(6.3g, 19.77mmol)的THF(90mL)缓慢加入。在0℃搅拌5h后,再加进氯化铵水溶液。用醚萃取后,再用饱和盐水洗涤,无水硫酸钠干燥,过滤后、浓缩有机层。用flash柱层析(正己烷/乙酸乙酯=10/1)纯化后,得到目的物 (5.25g、収率84%)。[2]
甲基三苯基溴化鏻是离子性化合物,而有时含水分。精细合成时最好真空减压干燥。
实验技巧
参考文献
[1] Levins, S. G. J. Am. Chem. Soc. 1958, 80, 6150. DOI: 10.1021/ja01555a068[2] White, J. D.; Wang, G.; Quaranta, L. Org. Lett. 2003, 5, 4983.
相关书籍
 |
|
相关链接
・ケミカルスノート 「光延反応最近の動向」 (PDF:東京化成工業)
・The Mitsunobu Reaction
・Mitsunobu Reaction (organic-chemistry.org)
・光延反応 (Wikipedia日本)
・Mitsunobu Reaction (Wikipedia)
・Mitsunobu reaction
・Sulfur and Phosphorus Compounds
・光延旺洋 (Wikipedia日本)
・光延反応 (TCI)
・IPNBSH:アルコールのシンプルな還元に有用な試薬
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


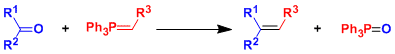















No comments yet.