- 概要
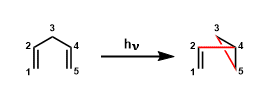
膦酸的叶立德和醛化合物进行加成反应能得到α,β-不饱和酯。本反应的反应机理和Wittig reaction 的反应机理相似。
底物可以从亚磷酸和α-卤代酯之间作Michaelis-Arbuzov反应而得到。
除了酯以外,腈、芳基、乙烯基,硫化物,胺,醚等官能基也能使用。
通常情况下、反应是E–式选择。但像下面的反应例,改变反应剂能使反应呈Z-式选择性。
反应副产物的磷化合物能溶于水、可在分液等操作时除去。这点比Wittig reaction的副产物更好分离除去。
- 基本文献
・Horner, L.; Hoffmann, H. M. R.; Wippel, H. G. Ber. 1958, 91, 61.
・Horner, L.; Hoffmann, H. M. R.; Wippel, H. G.; Klahre, G. Ber. 1959, 92, 2499.
・Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. doi:10.1021/ja01468a042
・Boutagy, J.; Thomas, R. Chem. Rev. 1974, 74, 87. doi:10.1021/cr60287a005
・Wadsworth, W. S., Jr. Org. React. 1977, 25, 73.
・Maryanoff, B. E.; Reitz, A. B. Chem. Rev. 1989, 89, 863. doi:10.1021/cr00094a007
・Kelly, S. E. Comprehensive Organic Synthesis 1991, 1, 729.
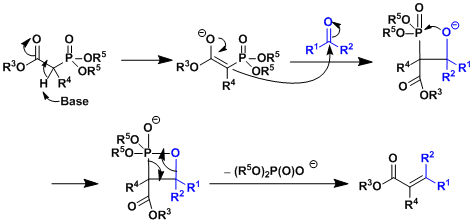
- 反应机理
- 反应实例
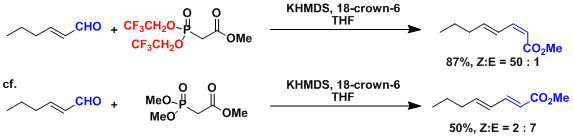
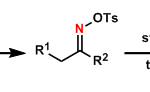
把膦酸酯变成(CF3CH2O)2P(O)-基能使反应呈Z选择性(Still-Gennari法)。[2]
同样原理,使用(ArO)2P(O)-基也能使反应呈Z选择(安藤法)。[2]
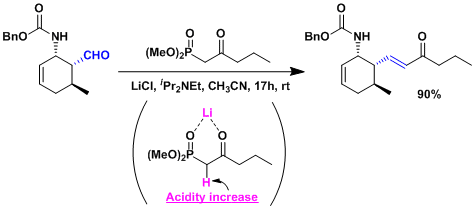
使用LiCl作添加剂时,能在DBU或Hünig Base弱碱性条件下进行反应。使用对强碱NaH或LDA不稳定的化合物时,该反应非常有效 (Roush-正宗法)[3]。Li作为路易斯酸,使活性质子的酸性度增加,提高反应性。
- 实验步骤
- 实验技巧
- 参考文献
[2] (a) Ando, K. J. Org. Chem. 1997, 62, 1934. DOI: 10.1021/jo970057c (b) Ando, K. J. Org. Chem.1998, 63, 8411. DOI: 10.1021/jo981337a (c) Ando, K. J. Org. Chem. 1999, 64, 6815. DOI:10.1021/jo9909150
[3] Blanchette, M. A.; Choy, W.; Davis, J. T.; Essenfeld, A. P.; Masamune, S.; Roush, W. R.; Sakai, T.Tetrahedron Lett. 1984, 25, 2183.
- 相关书籍
- 相关链接


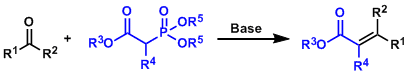


















No comments yet.