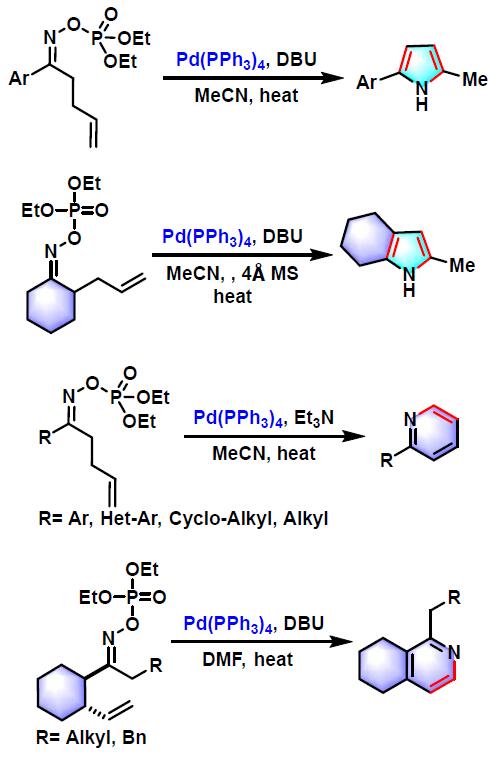
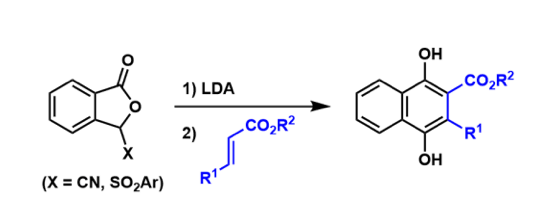
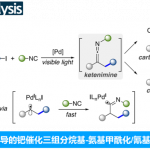
概要
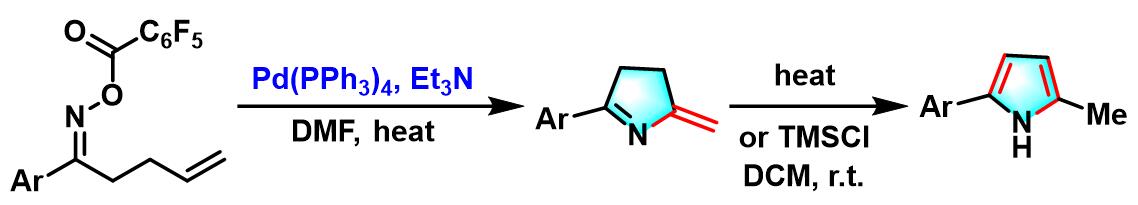
1999年,日本东京大学化学系 (東京大学理学部化学教室,Department of Chemistry, Tokyo University)的奈良坂纮一 (奈良坂 紘一,Narasaka Koichi)研究室报道了钯催化剂参与的γ, δ-不饱和酮肟酯 (γ, δ-unsaturated oxime esters,其中γ, δ-不饱和酮-O-五氟苯甲酰氧基肟最为常用)的氮杂Heck-Mizoroki环化 (aza-Heck-Mizoroki cyclization,又称为amino-Heck reaction),形成吡咯环的反应[1],该反应称为Narasaka-Heck环化反应 (Narasaka-Heck cyclization)。
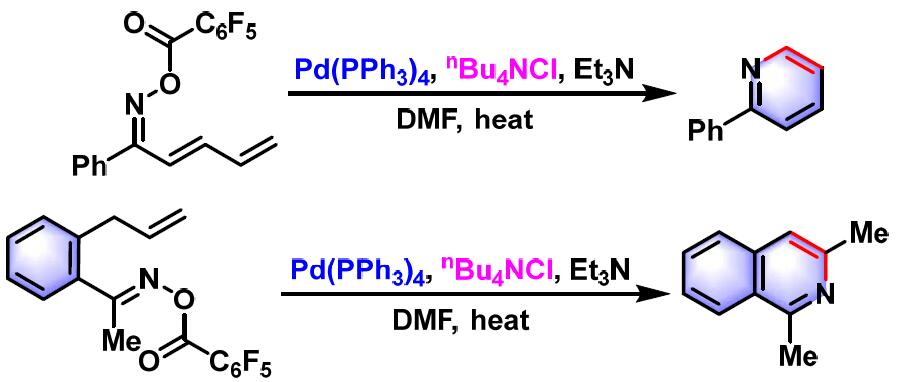
2001年,该研究组将底物范围扩展至烯酮-O-五氟苯甲酰氧基肟,成功完成吡啶及喹啉衍生物的构建[2]。
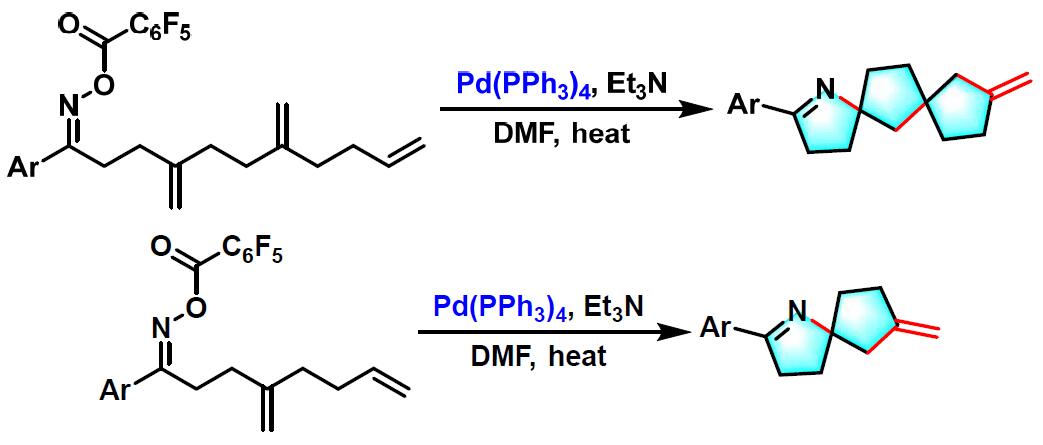
之后,Narasaka通过二烯基及三烯基酮肟底物参与的domino Narasaka-Heck环化反应,成功完成螺环亚胺的构建[3]-[4]。
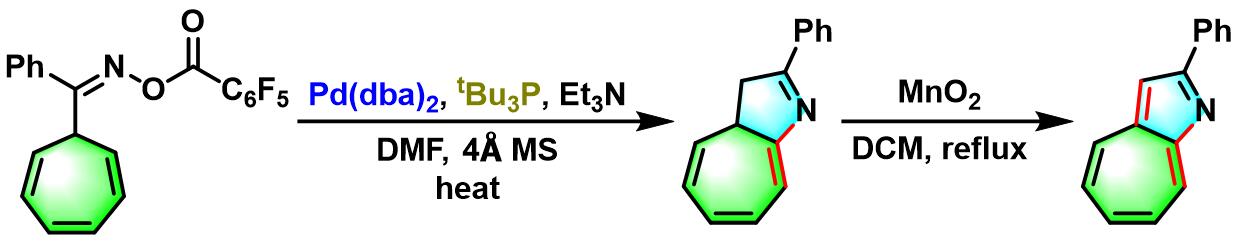
2002年,Narasaka进一步研究了环庚三烯基甲基酮-O-五氟苯甲酰氧基肟参与的Narasaka-Heck环化反应,并应用于1-氮杂薁的合成[5]-[6]。
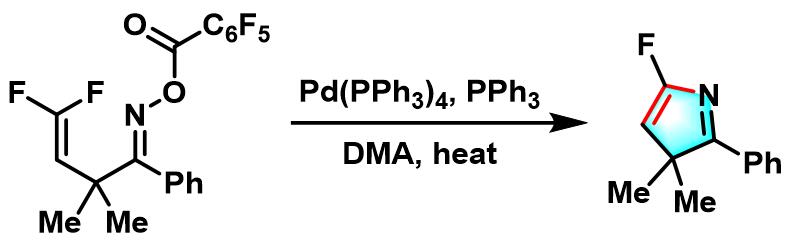
2005年,J. Ichikawa 采用氟乙烯基肟酯底物参与的Narasaka-Heck环化反应,以优良的产率实现了5-氟-3H-吡咯的合成[7]。
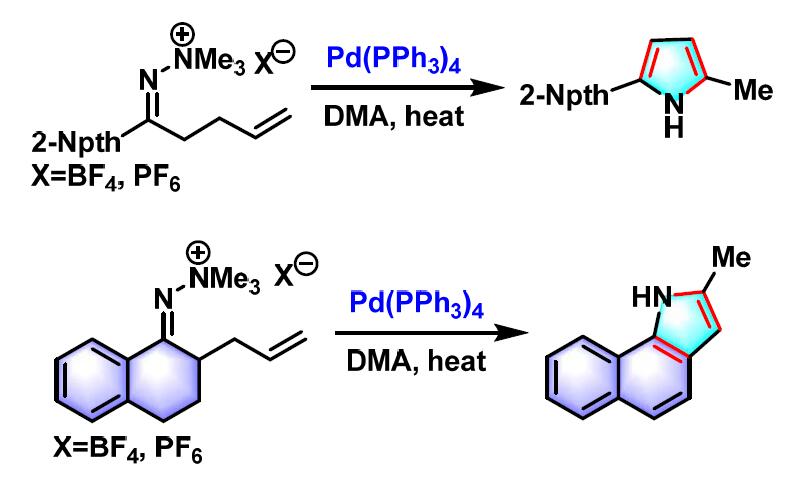
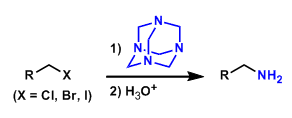
同时,Narasaka 研究发现采用γ,δ-不饱和酮-N,N,N-三甲基肼盐,同样可以完成吡咯与吲哚体系的构建[8]。
A. D. Abell通过O-五氟苯甲酰氧基脒肟的环化反应,成功完成三取代咪唑的合成[9]。
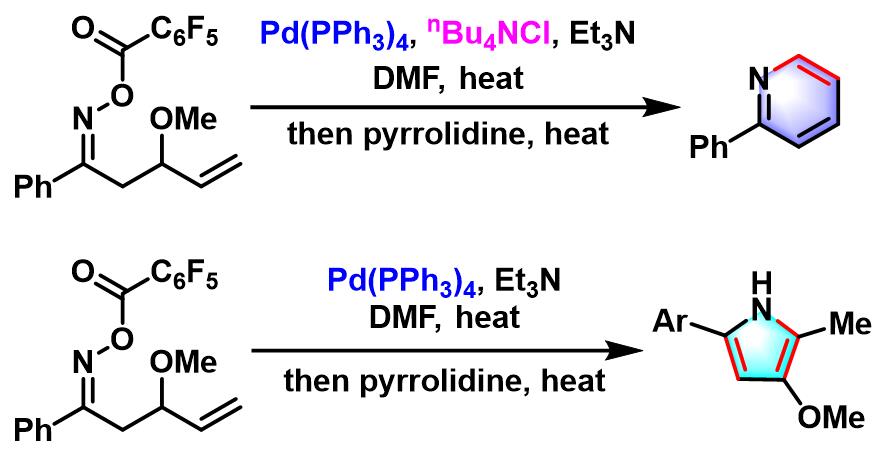
2006年,Narasaka研究了钯催化的β-甲氧基-γ,δ-不饱和酮肟底物的Narasaka-Heck环化反应,发现加入添加剂,如正丁基氯化铵,可以成功获得吡啶类杂环化合物[10]。
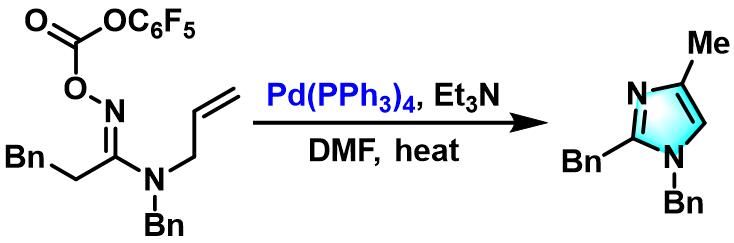
2008年,J. Zhu采用 γ,δ-不饱和酮-O-二乙基亚膦酰肟参与的Narasaka-Heck环化策略,先后完成了取代吡咯[11]与吲哚[11]、吡啶[12]及异喹啉环[13]的构建。
2011年,Kitamura采用(2-炔基)苯酮-O-五氟苯甲酰氧基肟参与的domino Narasaka-Heck环化反应,成功获得异吲哚产物[14]。
2013年,J. F. Bower采用带有1,1-二取代烯基的肟酯参与的Narasaka-Heck环化反应,成功完成二氢吡咯类化合物的合成[15]-[16]。
2014年,Bower报道了首例铜催化剂采用的Narasaka-Heck环化,与钯催化剂相比,价格低廉,具有更高的选择性与底物范围[17]。
2016年,Watson采用O-苯基异羟肟酸酯底物参与的Narasaka-Heck环化,成功完成生物碱全合成过程的关键砌块不饱和内酰胺的构建[18]。
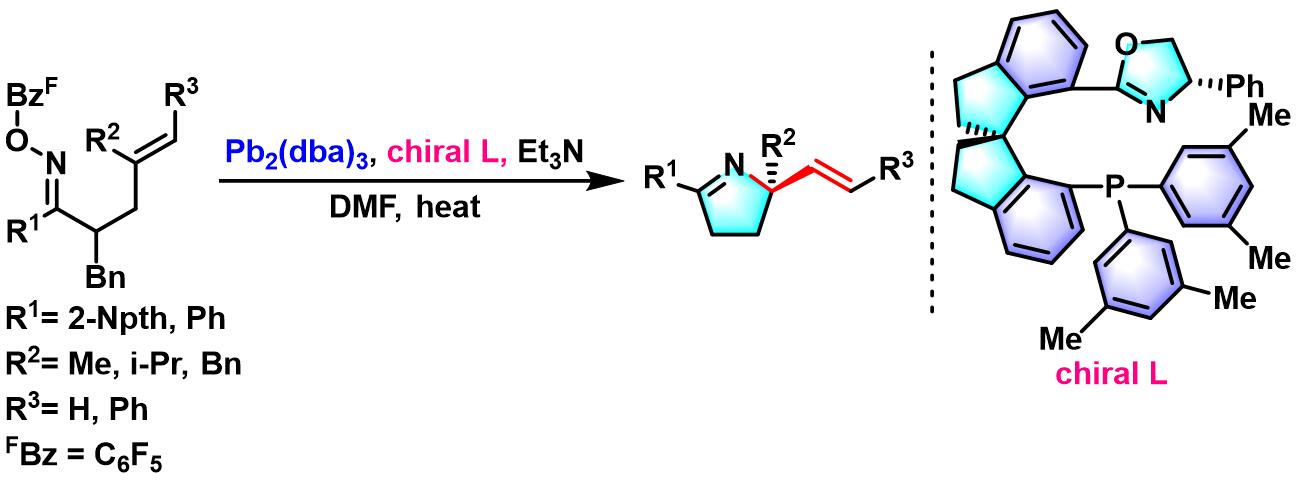
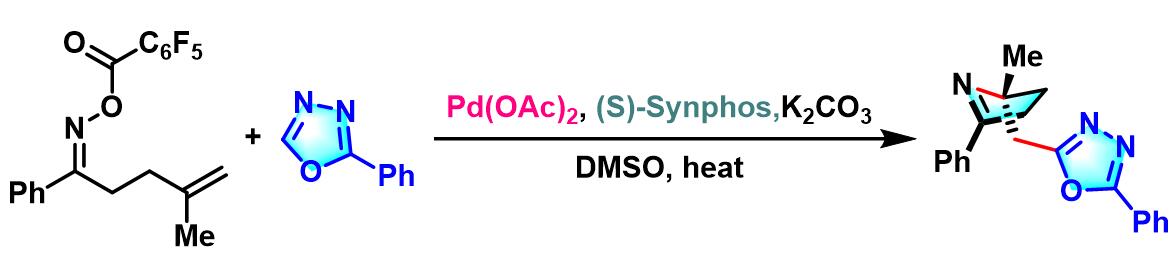
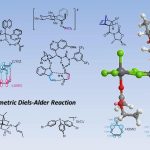
2017年,Bower采用SPINOL衍生的P,N-配体,完成了首例由钯催化促进的对映选择性Narasaka-Heck环化[19]。
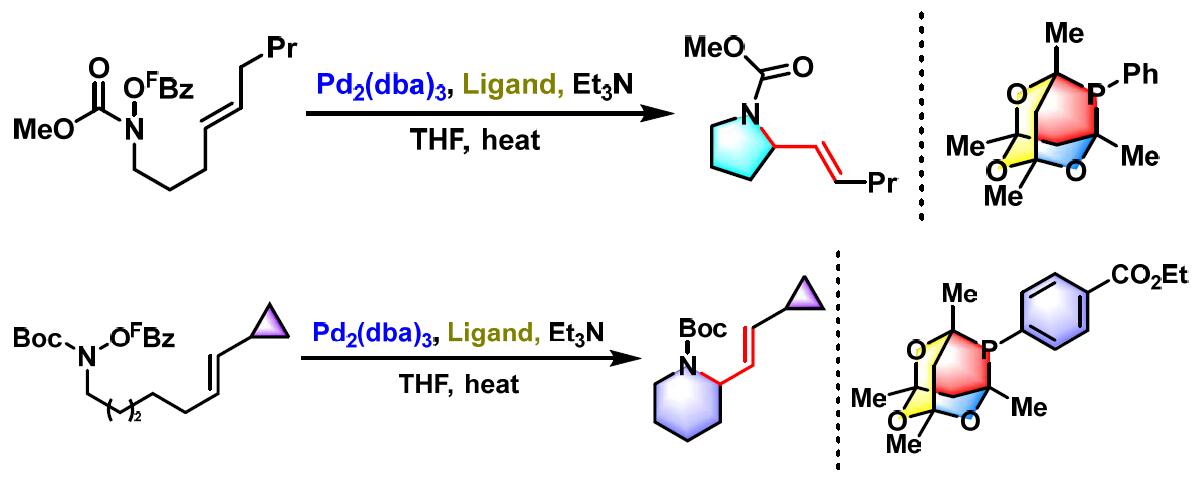
2018年,Bower采用氨基甲酸酯底物(FBz= C6F5)参与的Narasaka-Heck环化反应,成功完成吡咯烷与哌啶类化合物的合成[20]。
目前,该反应已广泛应用于各类含氮杂环体系的高效构建,具有广泛的底物应用范围、良好的反应产率、良好的化学选择性、区域选择性及立体选择性与对映选择性[21]-[27]。
基本文献
- [1] Tsutsui, K. Narasaka, Chem. Lett. 1999, 28, 45. doi: 10.1246/cl.1999.45.
- [2] Tsutsui, K. Narasaka, Chem. Lett. 2001, 30, 526. doi: 10.1246/cl.2001.526.
- [3] Kitamura, S. Zaman, K. Narasaka, Synlett. 2001, 974. doi: 10.1055/s-2001-14637.
- [4] Zaman, M. Kitamura, K. Narasaka, Bull. Chem. Soc. Jpn. 2003, 76, 1055. doi: 10.1246/bcsj.76.1055.
- [5] Kitamura, S. Chiba, O. Saku, K. Narasaka, Chem. Lett. 2002, 31, 606. doi: 10.1246/cl.2002.606.
- [6] Chiba, M. Kitamura, O. Saku, K. Narasaka, Bull. Chem. Soc. Jpn. 2004, 77, 785. doi: 10.1246/bcsj.77.785.
- [7] Sakoda, J. Mihara, J. Ichikawa, Chem. Commun. 2005, 41, 4684. doi: 10.1039/b510039a.
- [8] Kitamura, H. Yanagisawa, M. Yamane, K. Narasaka, Heterocycles 2005, 65, 273. doi: 10.3987/COM-04-10280.
- [9] Zaman, K. Mitsuru, A. D. Abell, Org. Lett. 2005, 7, 609. doi: 10.1021/ol047628p.
- [10] Kitamura, D. Kudo, K. Narasaka, ARKIVOC 2006, 3, 148. doi: 10.3998/ark.5550190.0007.312.
- [11] Zhu, Y. Chan, Synlett 2008, 1250. doi: 10.1055/s-2008-1072728.
- [12] Zhu, Y. Su, Y. Chan, I. Chen, C. Liao, Heterocycles 2009, 78, 369. doi: 10.3987/COM-08-11508.
- [13] Tsao, J. Zhu, Heterocycles 2012, 85, 383. doi: 10.3987/COM-11-12396.
- [14] Kitamura, Y. Moriyasu, T. Okauchi, Synlett 2011, 643. doi: 10.1055/s-0030-1259556.
- [15] Faulkner, J. S. Scott, J. F. Bower, Chem. Commun. 2013, 49, 1521. doi: 10.1039/C2CC38944D.
- [16] J. Race, J. F. Bower, Org. Lett. 2013, 15, 4616. doi: 10.1021/ol4023112.
- [17] Faulkner, N. J. Race, J. S. Scott, J. F. Bower, Chem. Sci. 2014, 5, 2416. doi:
10.1039/C4SC00652F. - [18] A. Shuler, G. Yin, S. B. Krause, C. M. Vesper, D. A. Watson, J. Am. Chem. Soc. 2016, 138, 13830. doi: 10.1021/jacs.6b08932.
- [19] J. Race, A. Faulkner, G. Fumagalli, T. Yamauchi, J. S. Scott, M. Rydén-Landergren, H. A. Sparkes, J. F. Bower, Chem. Sci. 2017, 8, 1981. doi: 10.1039/c6sc04466b.
- [20] R. Hazelden, R. C. Carmona, T. Langer, P. G. Pringle, J. F. Bower, Angew. Chem. Int. Ed. 2018, 57, 5124. doi: 10.1002/anie.201801109.
- [21] Kitamura, K. Narasaka, Chem. Rec. 2002, 2, 268. doi: 10.1002/tcr.10030.
- [22] Narasaka, M. Kitamura, Eur. J. Org. Chem. 2005, 4505. doi: 10.1002/ejoc.200500389.
- [23] Huang, J. Cai, G. Deng, Org. Biomol. Chem. 2016, 14, 1519. doi:
10.1039/C5OB02417J. - [24] Faulkner, J. F. Bower, Angew. Chem. 2012, 124, 1707.doi: 10.1002/ange.201107511.
- [25] H. Tsutsui, M. Kitamura, K. Narasaka, Bull. Chem. Soc. Jpn. 2002, 75, 1451. doi: 10.1246/bcsj.75.1451.
- [26] A. Faulkner, J. F. Bower, Angew. Chem. Int. Ed. 2012, 51, 1675. doi: 10.1002/anie.201107511.
- [27] N. J. Race, I. R. Hazelden, A. Faulkner, J. F. Bower, Chem. Sci. 2017, 8, 5248.doi: 10.1039/C7SC01480E.
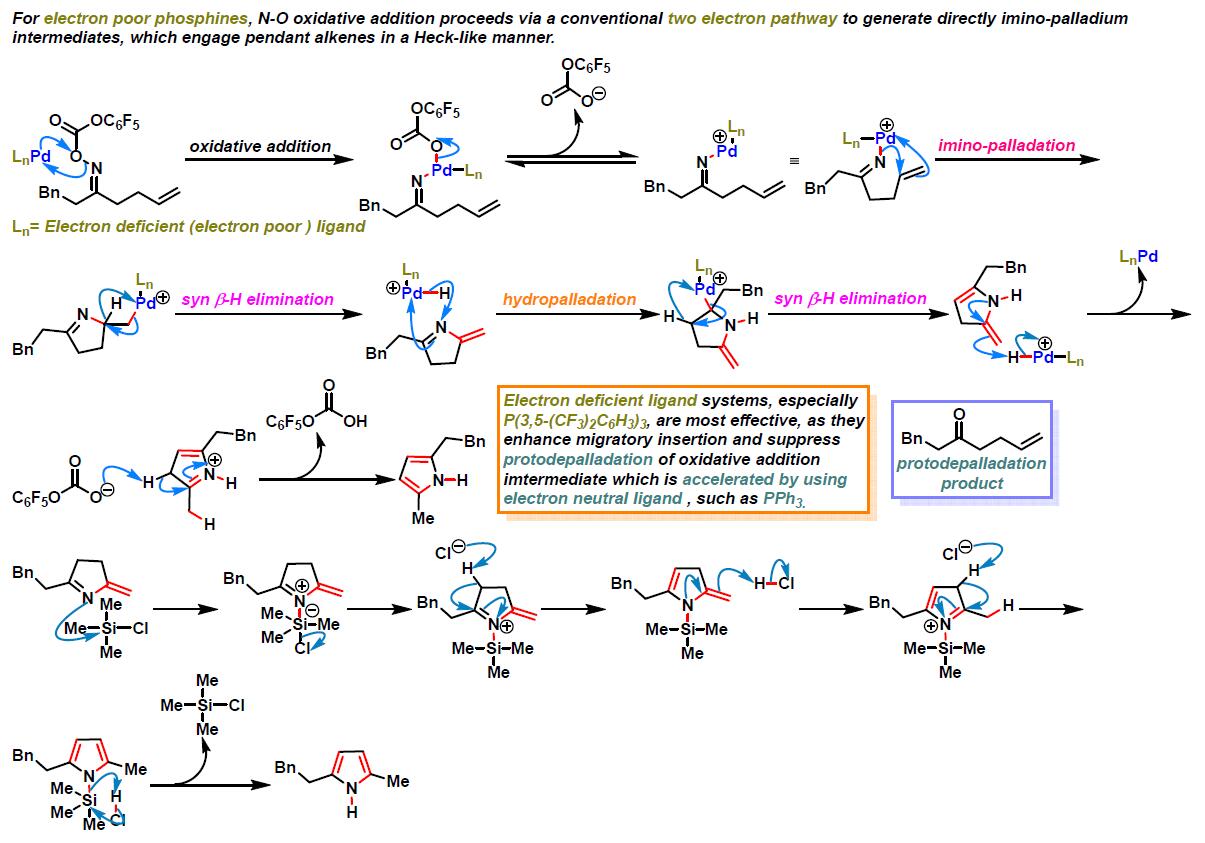
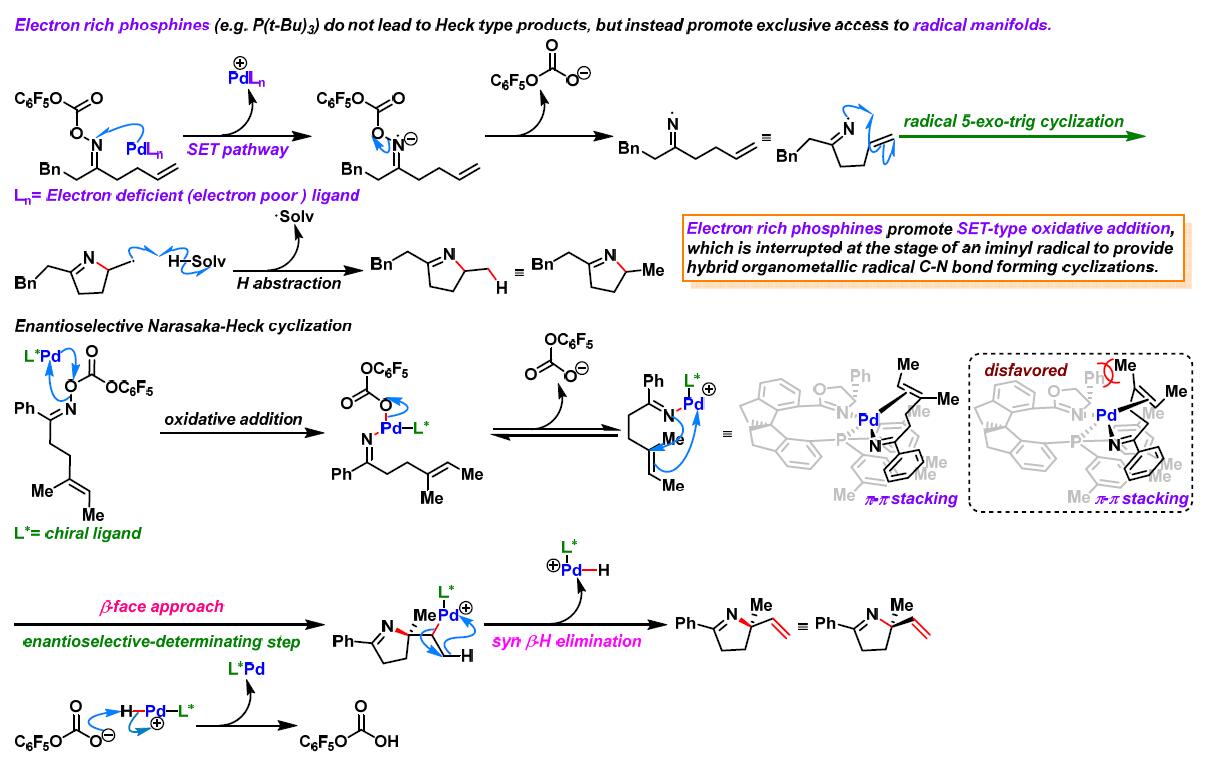
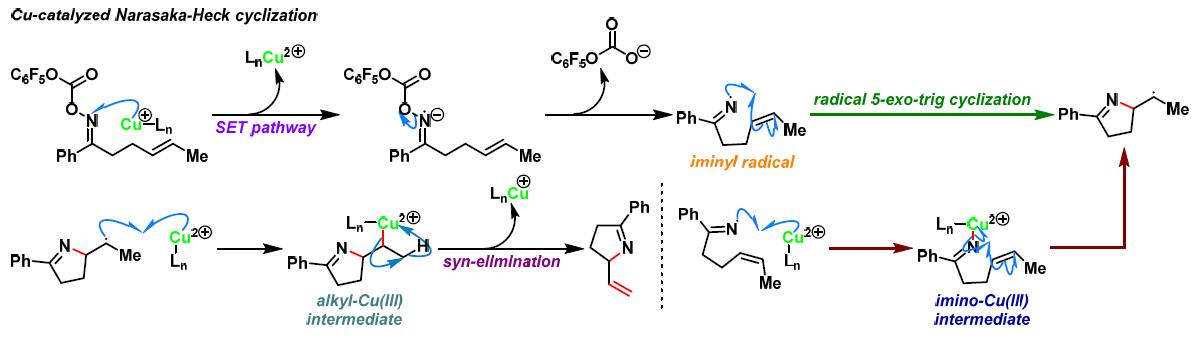
反应机理
参考文献
- [1] N. J. Race, A. Faulkner, M. H. Shaw, J. F. Bower, Chem. Sci. 2016, 7, 1508. doi: 10.1039/c5sc04037j.
- [2] A. Faulkner, J. S. Scott, J. F. Bower, J. Am. Chem. Soc. 2015, 137, 7224. doi: 10.1021/jacs.5b03732.
- [3] W. Kong, Q. Wang, J. Zhu, J. Am. Chem. Soc. 2015, 137, 16028. doi: 10.1021/jacs.5b11625.
- [4] N. J. Race, A. Faulkner, G. Fumagalli, T. Yamauchi, J. S. Scott, M. Rydén-Landergren, H. A. Sparkes, J. F. Bower, Chem. Sci. 2017, 8, 1981. doi: 10.1039/c6sc04466b.
- [5] H. Chen, S. Chiba, Org. Biomol. Chem. 2014, 12, 42. doi: 10.1039/C3OB41871E.
反应实例
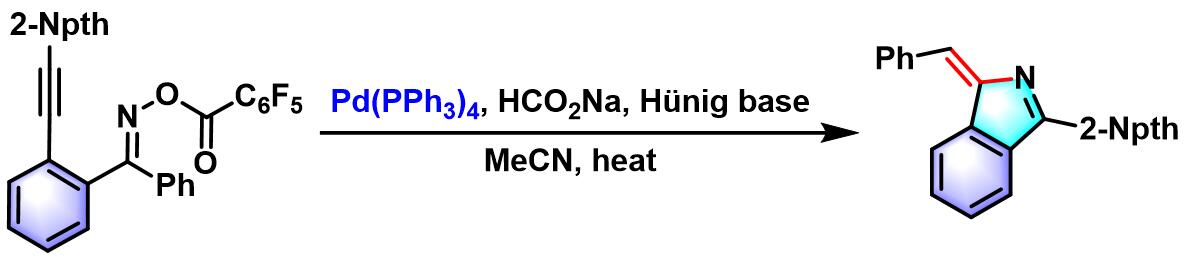
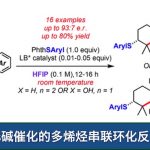
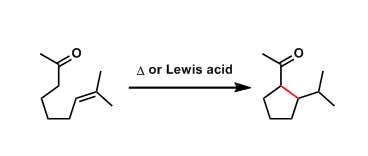
苯并稠环化合物的合成[1]
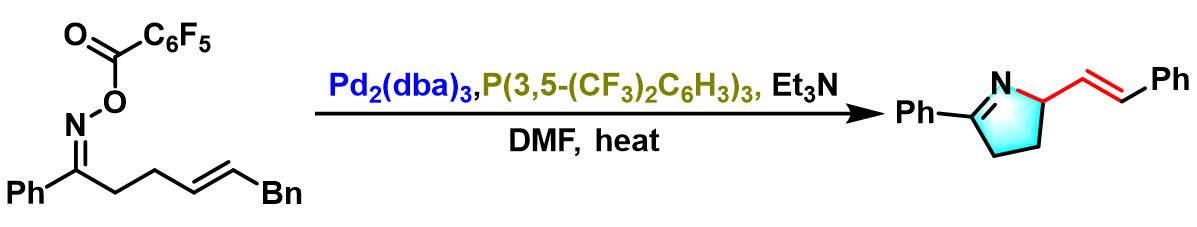
Cascade Narasaka-Heck /芳基C-H键烷基化[2]
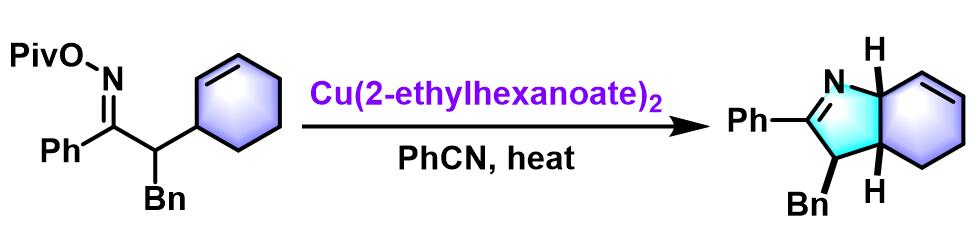
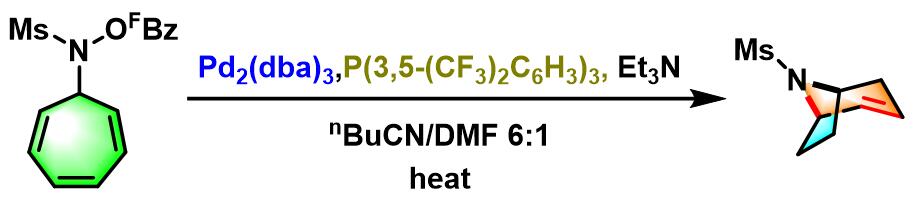
跨环Narasaka-Heck环化[3]
实验步骤
Narasaka-Heck环化
向经烘箱干燥过的反应管中放入磁力搅拌子,之后加入Pd2(dba)3 (0.025 eq.)、P(3,5-(CF3)2Ph)3 0.01 eq.)及肟酯底物 (1 eq.)。将反应管用橡胶塞密封,并充入氩气。再通过注射器加入无水DMF (维持底物浓度为0.1 M)与Et3N (4 eq.)。将上述混合物置于油浴中加热 (根据不同肟酯底物,控制温度范围为60-120 oC)直至反应完成。反应结束后,将反应混合物冷却至室温,减压除去溶剂。残余物采用硅胶柱色谱分离纯化,获得相应含氮杂环产物。
对映选择性Narasaka-Heck环化
向经烘箱干燥过的反应管中放入磁力搅拌子,之后加入Pd2(dba)3 (0.025 eq.)、P(3,5-(CF3)2Ph)3 0.01 eq.)、手性配体(0.075 eq.)及肟酯底物 (1 eq.)。将反应管用橡胶塞密封,并充入氩气。再通过注射器加入无水DMF (维持底物浓度为0.1 M)与Et3N (4 eq.)。将上述混合物置于油浴中加热 (根据不同肟酯底物,控制温度范围为60-120 oC)直至反应完成。反应结束后,将反应混合物冷却至室温,减压除去溶剂。残余物采用硅胶柱色谱分离纯化,获得相应含氮杂环产物。
参考文献
- [1] I. R. Hazelden, X. Ma, T. Langer, J. F. Bower, Angew. Chem. Int. Ed. 2016, 55, 11198. doi: 10.1002/anie.201605152.
- [2] X. Bao, Q. Wang, J. Zhu, Angew. Chem. Int. Ed. 2017, 56, 9577. doi: 10.1002/anie.201705641.
- [3] N. J. Race, I. R. Hazelden, A. Faulkner, J. F. Bower, Chem. Sci. 2017, 8, 5248.doi: 10.1039/C7SC01480E.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



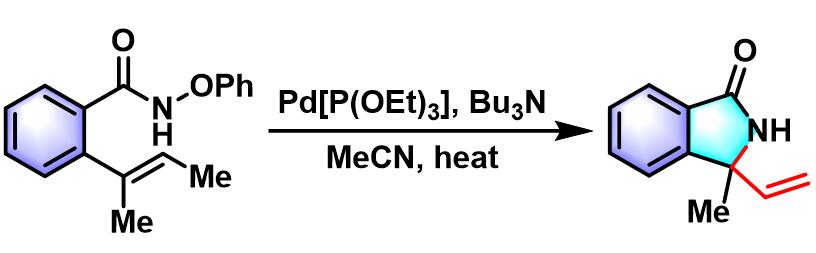












No comments yet.