概要
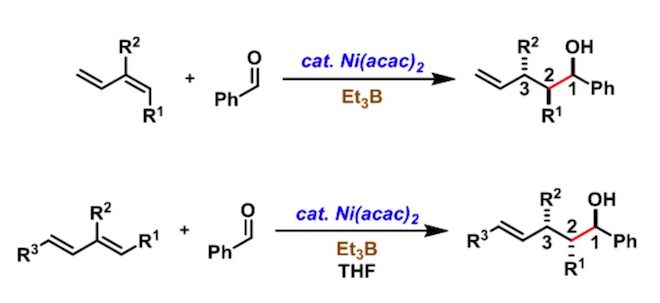
Tamaru-Mori 反应(Tamaru-Mori reaction)是在镍催化剂与三乙基硼作用下,醛与1,3-二烯间进行的具有高度立体与区域选择性的高烯丙基化反应[1]。
该反应在1998年由日本长崎大学(Nakasaki University)的田丸良直研究组(Tamaru Yoshinao)在1998年首次报道[1]-[3]。
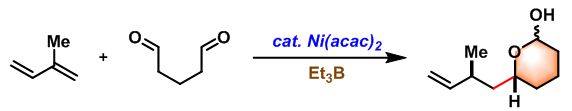
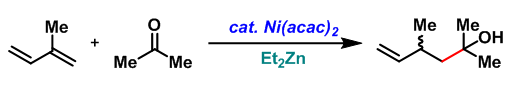
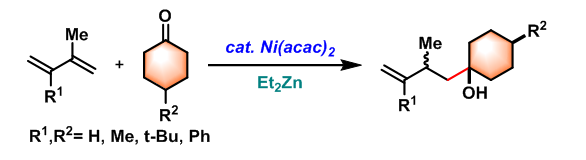
2006年田丸良直(Tamaru Yoshinao)与森正彦(Mori Masahiko)采用二乙基锌代替三乙基硼,将底物范围扩展至立体位阻较大的脂肪醛、酮及1,3-环己二烯[4]。
基本文献
[1] M. Kimura, A. Ezoe, K. Shibata, Y. Tamaru, J. Am. Chem. Soc. 1998, 120, 4033. doi: 10.1021/ja973847c. [2] M. Kimura, H. Fujimatsu, A. Ezoe, K. Shibata, M. Shimizu, S. Matsumoto, Y. Tamaru. Angew. Chem. Int. Ed. 1999, 38, 397. doi: 10.1002/(SICI)1521-3773(19990201)38:3<397::AID-ANIE397>3.0.CO;2-Y. [3] M. Kimura, A. Ezoe, S. Tanaka, Y. Tamaru, Angew. Chem. Int. Ed. 2001, 40, 3600. doi:10.1002/1521-3773(20011001)40:19<3600::AID-ANIE3600>3.0.CO;2-N. [4] M. Kimura, A. Ezoe, M. Mori, K. Iwata,Y. Tamaru, J. Am. Chem. Soc. 2006, 128, 8559. doi: 10.1021/ja0608904.反应机理
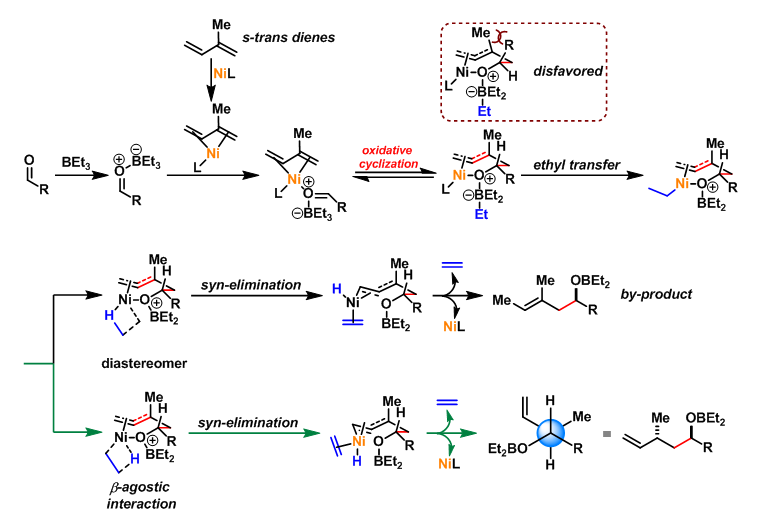
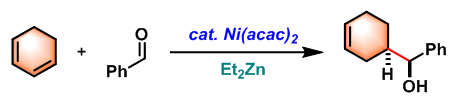
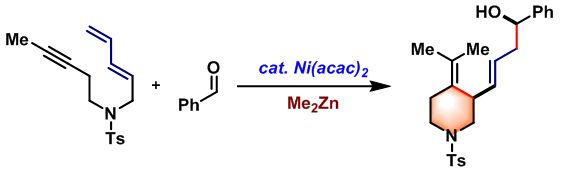
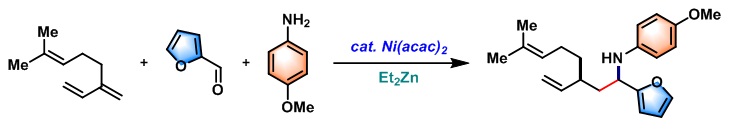
反应实例
含氮杂环的合成[1]
Amphidinolide C 中C1-C9片段的构建[2] [3]
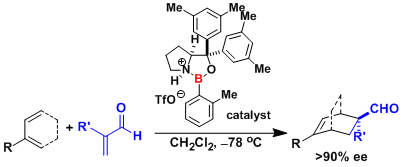
醛亚胺的高烯丙基化[5] [6]
分子内Tamaru-Mori 反应[7]
实验步骤
Et3B:用注射器向已充入N2,并装有Ni(acac)2 (0.01eq.) 的烧瓶中加入干燥的THF (维持底物浓度为1.6 M),1,3-二烯(4 eq.)、醛(1eq.)及Et3B (2.4 eq.)。将上述均相混合物在室温下搅拌,并通过GLC与TLC监控(正己烷/乙酸乙酯4/1 v/v)直至反应结束。反应结束后,将反应液用乙酸乙酯进行稀释,再依次用2 M HCl、饱和NaHCO3溶液及饱和NaCl溶液洗涤,并用无水MgSO4进行干燥,最后减压除去溶剂。将粗产物采用硅胶柱色谱(正己烷/乙酸乙酯16/1 v/v)分离纯化后,获得相应高烯丙醇产物。
Et2Zn:
N2气氛下,用注射器向装有Ni(acac)2(0.1 eq.)的烧瓶中加入无水THF (维持底物浓度为0.2 M),随后依次加入1,3-二烯 (4 eq.)、醛(1eq.)及Et2Zn (2.4 eq.)。将上述反应混合物在室温下搅拌30 min后,加入2 M HCl进行淬灭。充分淬灭后,采用乙酸乙酯进行萃取,将合并的有机相用饱和NaCl溶液洗涤,并用无水MgSO4进行干燥,最后减压除去溶剂。将粗产物采用硅胶柱色谱(正己烷/乙酸乙酯16/1 v/v)分离纯化后,获得相应高烯丙醇产物。
实验实验安全须知
①二乙基锌与三乙基硼极易自燃,取用时需要在氩气手套箱内进行。
②双(乙酰丙酮)合镍(II)为可疑致癌物,使用时需要十分小心。
参考文献
[1] M. Kimura, A. Ezoe, M. Mori, Y. Tamaru, J. Am. Chem. Soc. 2005, 127, 201. doi: 10.1021/ja0469030. [2] M. Kimura, Org. Synth. 2013, 90, 105. doi: 10.15227/orgsyn.090.0105. [3] M. P. Paudyal, N. P. Rath, C. D. Spilling, Org. Lett. 2010, 12, 2954. doi: 10.1021/ol100959a. [4] Y. Tamaru, M. Kimura, Org. Synth. 2006, 83, 88. doi: 10.15227/orgsyn.083.0088. [5] M. Kimura, A. Miyachi, K. Kojima, S. Tanaka, Y. Tamaru, J. Am. Chem. Soc. 2004, 126, 14360. doi: 10.1021/ja0450354. [6] M. Kimura, A. Ezoe, S. Tanaka, Y. Tamaru, Angew. Chem. Int. Ed. 2001, 40, 3600. doi: 10.1002/1521-3773(20011001)40:19<3600::AID-ANIE3600>3.0.CO;2-N. [7] K. Shibata, M. Kimura, M. Shimizu, Y. Tamaru, Org. Lett. 2001, 3, 2181. doi: 10.1021/ol0100879.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





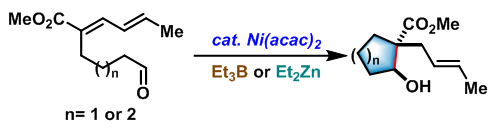















No comments yet.