作者:石油醚
导读:
近日, 名古屋工業大学Norio Shibata教授团队开发了一种无过渡金属参与的由硅硼酸酯介导的非活化有机氟化物与仲胺的选择性脱氟C–N键偶联新策略,进而在室温条件下成功构建了一系列三级胺,并且回收氟化钾。
“Transition-metal-free silylboronate-mediated cross-couplings of organic fluorides with amines”
Jun Zhou, Zhengyu Zhao & Norio Shibata*
Nat. Commun.2023, 14, 1847, ASAP DOI: 10.1038/s41467-023-37466-0
正文
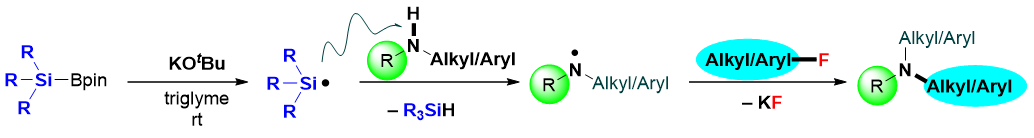
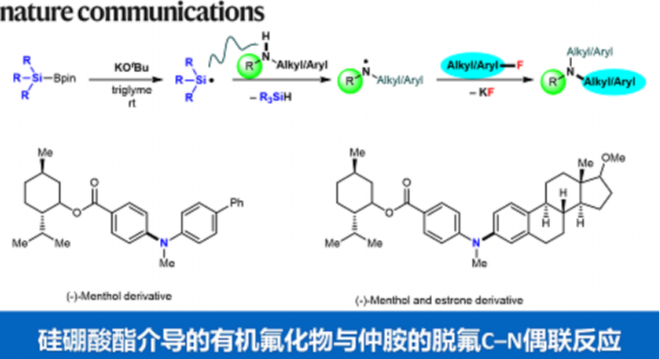
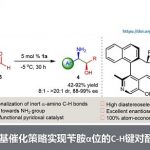
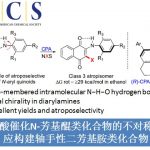
芳香族叔胺的合成是化学工业中使用最频繁的五种反应之一,而常用的Buchwald-Hartwig反应就是一个典型的例子。然而,这一经典的C–N键构筑策略经常需要使用过渡金属催化剂和加热装置。通常Buchwald-Hartwig反应中使用的是芳香族碘化物、溴化物或氯化物,而芳香族氟化合物却鲜有交叉偶联反应的应用。这是因为相比于其他C–X键,C–F键的键能是最高的。因此如何实现通过断键/成键的策略来温和高效的构筑C–N键,仍然具有非常大的吸引力和挑战性。鉴于我们之前关于C–F键功能化研究的成功,我们设想通过硅硼酸酯和叔丁醇钾来引发自由基反应从非活化氟化合物中选择性的去除氟原子,进而在氟原子所在的位置进行功能胺基化。一系列具有功能性和药物活性的叔胺可以在室温下以良好的收率合成,避免了高温条件或过渡金属催化剂的使用。另外,作为这一策略所回收的副产物氟化钾,有效的避免了氟资源的浪费(图1)。未来这一策略亦可拓展到一些多氟、全氟有机物的C–F键选择性功能化而将自然难以降解的含氟废物变废为宝。
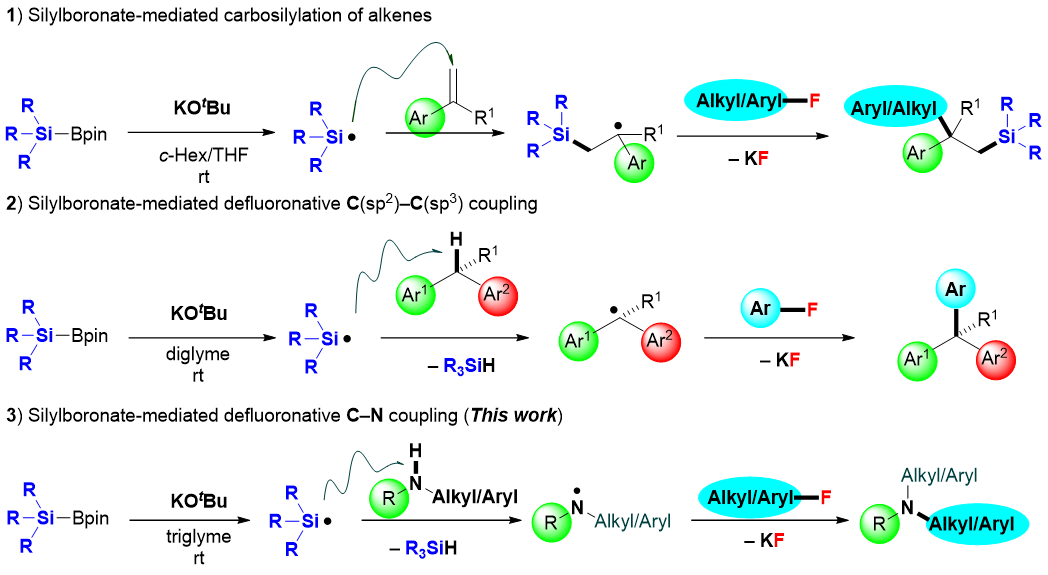
图1: 硅硼酸酯介导的自由基策略脱氟功能化反应
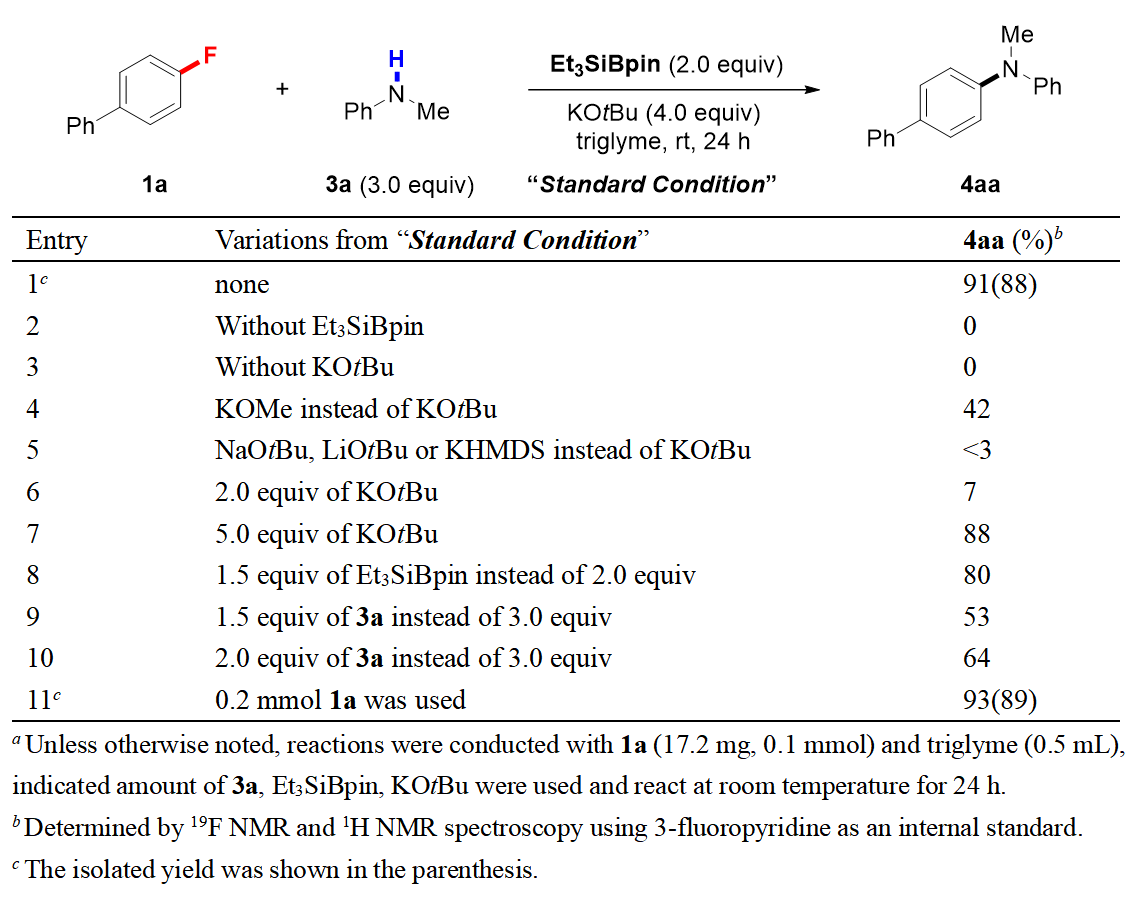
首先,作者系统研究了各类胺化合物在此反应中的反应效率,进而确立了以4-氟代联苯1a和N-甲基苯胺3a作为模板反应底物,在以2.0当量硅硼酸酯和4.0当量叔丁醇钾作自由基诱发剂和极性溶剂三乙二醇二甲醚存在的条件下获得了最佳反应条件。室温搅拌反应24小时后,目标叔胺4aa的产率为91%,而之前容易产生的脱氟硅化副产物因三乙二醇二甲醚的使用被有效的抑制了(表1)。
表1:硅硼酸酯介导的脱氟胺化反应条件优化
在最优反应条件下,作者考察了该反应的底物耐受性范围。当芳基氟代底物1和N-烷基苯胺3的反应规模为0.2 mmol时,一系列具有不同电子特性的芳基氟化物均以良好的产率进行了脱氟胺化反应,并且兼容一些潜在可裂解的C–O,C–Cl,C–Br,杂环C–H,或C–N键以及三氟甲基等官能团。相比之下,具有邻位取代的高位阻底物或低反应性脂肪族仲胺,反应只能给出中等的产率。此外,杂芳基和具有生物活性的氟代芳基底物亦给出了较好的结果(图2)。
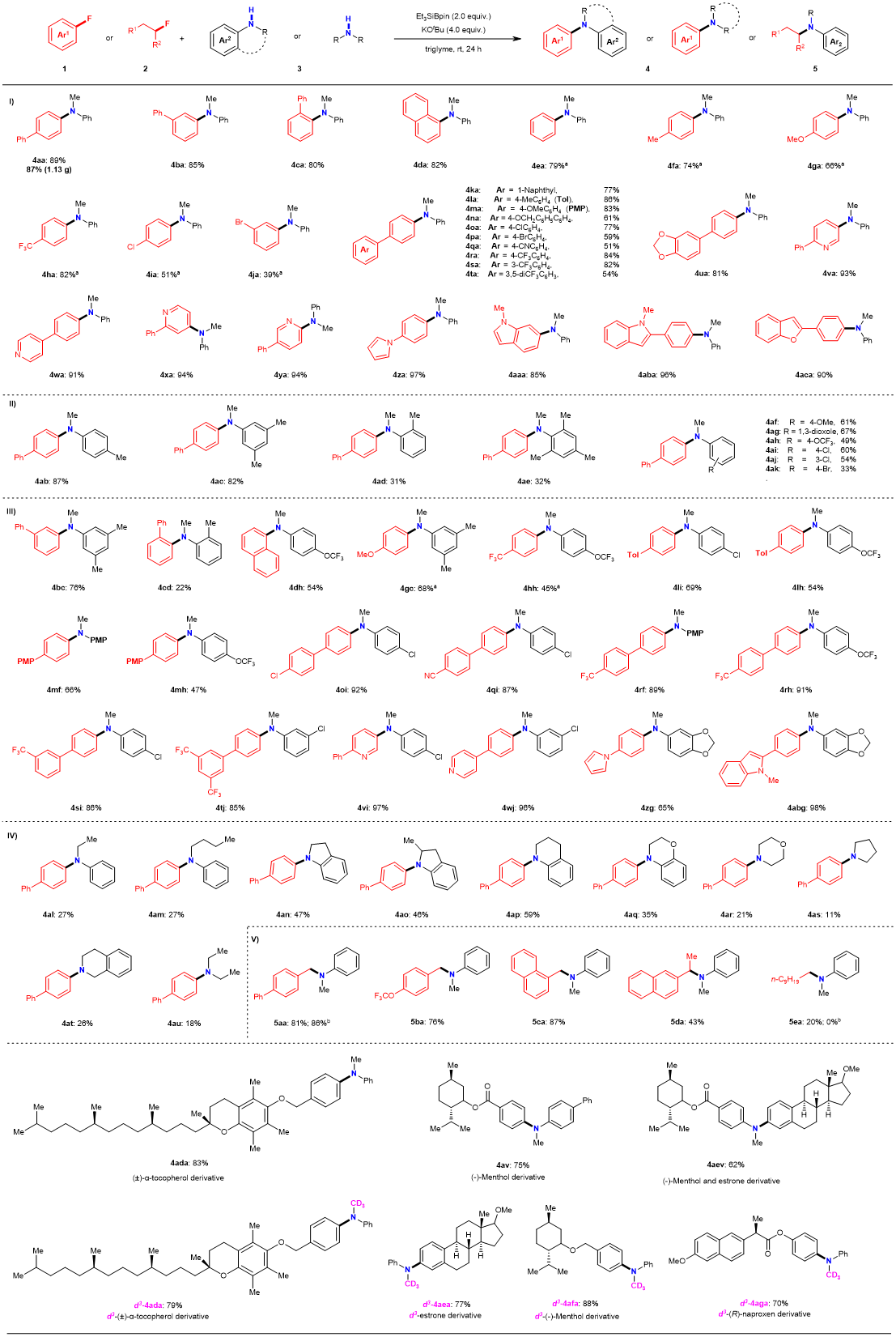
图2: 底物范围
为了阐明该自由基型的脱氟胺化反应的反应机理,作者设计并完成了相关机理验证实验并提出了一种涉及受挫自由基对的单电子转移(SET)/自由基偶联的反应机制。首先,硅硼酸酯和叔丁醇钾在醚类溶剂中可以形成硅自由基(•SiEt3),这一假设可以通过控制实验和ESR实验(Chem. Sci. 2023: 10.1039/d3sc00154g)来证明。其次,所形成的硅自由基可有效的从仲胺3中攫取一个氢原子而形成氮中心自由基,进而在键能匹配的条件下选择性的断裂有机氟化物中的C–F键来构筑新的C–N键(图3)。

图3: 控制实验及可能的反应机理
总结:
名古屋工業大学的Norio Shibata课题组开发了一种室温下硅硼酸酯介导的以非活化有机氟化物和芳基或烷基仲胺为底物的自由基型脱氟C–N偶联反应。该反应的关键在于:(1)构建了多种功能化的芳基或烷基叔胺,包括拓展到合成具有生物活性的衍生物及其氘代产物;(2)首次使惰性的C–F键和N–H键在无过渡金属催化剂存在下的室温偶联反应成为可能;(3)选择性C–F键功能化而兼容一系列潜在的可裂解官能团;(4)无机副产物氟化钾可回收循环利用。
(Norio Shibata教授供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载



















No comments yet.