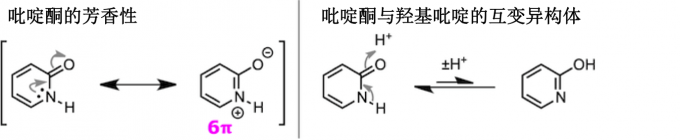
聚氮杂吲嗪或嘧啶、通过亲核催化剂的作用,6元环内的氮原子和与6元环结合的原子X的位置发生互换引起异构化。
基本文献
Review
- Fujii, T.; Itaya, T. Heterocycles 1998, 48, 359–390. DOI: 10.3987/REV-97-494
- El Ashry, E. S. H.; El Kilany, Y.; Rashed, N.; Assafir, H. Advances in Heterocyclic Chemistry 1999, 75, 79–165. DOI: 10.1016/S0065-2725(08)60984-8
Dimroth 重排的概要与分类
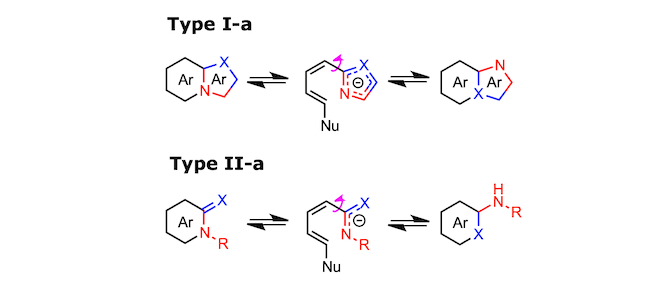
杂环化合物中的环中的杂原子和与环结合的杂原子的位置互换的异构化反应被统称为Dimroth重排反应。Dimroth重排可以从反应底物,反应类型和反应机理的角度分为几种类型,如下图所示[1]。首先,从反应底物的角度来看可以分为 Type I 与 Type II 。其中Type I 从反应形式的观点来看,又能分为3种类型。而Type II 可以分成2种不同类型[2]。
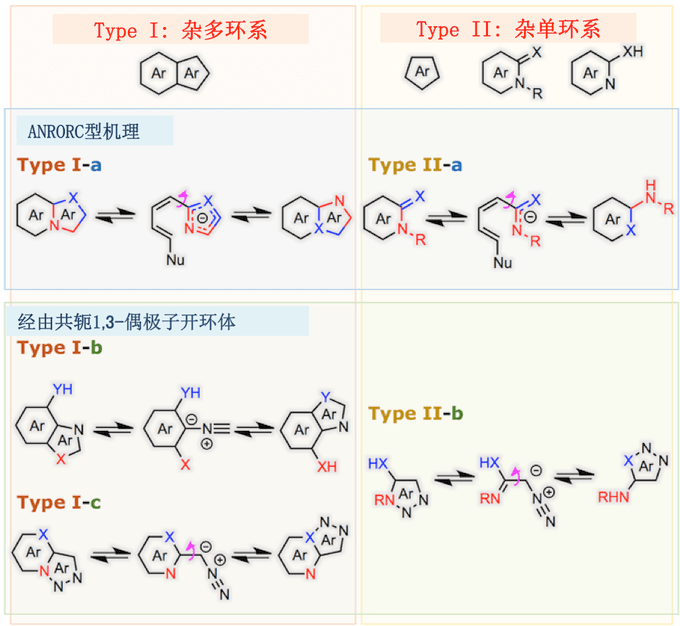
对于Dimroth 重排分类与概要,请大家主要目光集中在断键与再成键的位置 (注意: 像吡啶酮这种在文中也用Ar表示[3].)
严格地说,即使反应底物是杂稠合化合物,Type-II型反应也会发生。这是因为除非稠环部分参与反应,否则它可以被认为是II型。典型的一个例子就是腺嘌呤嘧啶位点的异构化[5]。

腺嘌呤虽然是一种杂稠合的化合物,但该反应不涉及其五元环部分,因此分类为Type-II型。
就反应机理而言,它是分成两部分,一部分是外部亲核攻击(所谓的ANRORC型反应机制[4]),另一部分是平衡状态时轻微存在的共轭1,3-偶极开环。前者就反应形式而言包括 Type I-a 与 Type II-a 、后者包括 Type I-b, Type I-c与Type II-b。 这些机制之间的区别在于,ANRORC型Dimroth重排在初始阶段需要外部亲核催化剂,而通过共轭1,3-偶极开环的Dimroth重排单分子下进行也是可能的。
在这篇文章中,主要描述ANRORC 型机理下进行的 Dimroth 重排反应。
反应机理
ANRORC缩写指的是Addition of the Nucleophile, Ring Opening, and Ring Closure。具体的过程包括、(1) 亲核催化剂的加成、 (2) 开环、(3) 单键的旋转 、(4) 关环、最后 (5) 亲核催化剂的离去 这五个步骤。
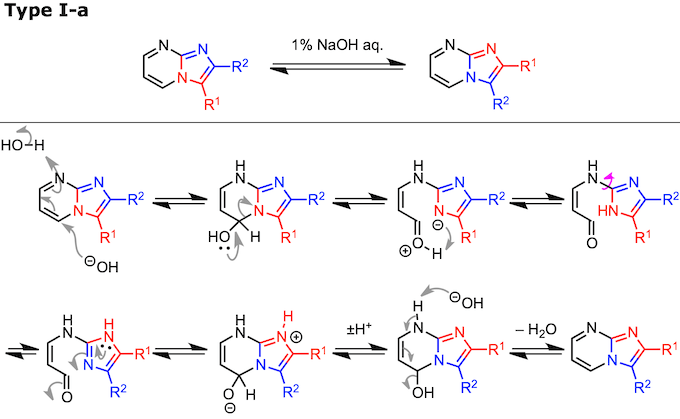
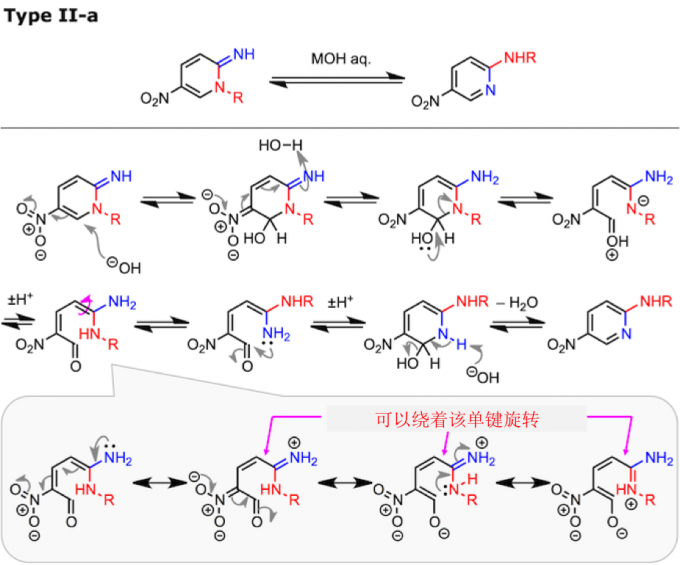
底物
Type I-a 的Dimroth 重排发生在稠合位点具有氮原子的杂稠合化合物(即吲哚嗪类)。Type II-a 的 Dimroth 重排、底物为拥有可以参与环化反应取代基的吡啶类或者嘧啶类化合物。具体而言,N-烷基-2-亚氨基嘧啶(X:= NH)经历II-a型的Dimroth重排并容易异构化为2-(烷基氨基)嘧啶(参见上述反应机理中所示的实例)。
影响反应的几大因素
Dimroth 重排多为可逆反应。作为影响反应进行关键因素,主要有初始阶段的亲核加成的活性,闭环时的亲核性,空间效应等。
(1) 亲核加成的活性
随着环中N原子的数量增加,环的亲电性得到改善并且起始步骤中的亲核加成得到促进。Type I-a 的场合 、对中氮茚5位的亲核进攻是该反应的起始步骤,如下图所示的底物在受到氢氧基的进攻后,形成的中间体中有N原子存在的话,5位的π电子密度降低。也就是说1,2,4-四唑并[4,3-a]嘧啶会异构化成1,2,4-四唑并[1,5-a]嘧啶(如下图所示1,8位间的单键旋转)。而得到的1,3,8-三氮杂吲嗪类产物比起始原料更难发生加成反应,因此难以发生逆反应。

Type II-a 的场合、对吡啶的 6 位的亲核进攻作为起始步,在吡啶的3位导入N原子可以促进Dimroth 重排的发生。也就是说对于底物来说嘧啶类化合物容易发生Type II的Dimroth重排。

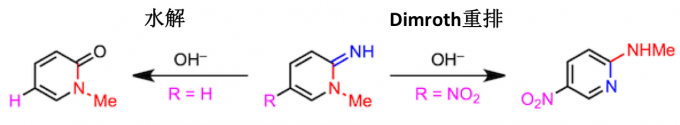
吸电子取代基的存在同样可以促进起始步骤的亲核催化剂的进攻,从而促进Dimroth重排的进行。例如,以下的1,2-二氢-2-亚氨基-1-甲基吡啶衍生物,如果5位的取代基R是硝基的话,在碱性条件下会发生Dimroth重排。而相对的如果R是H的情况,只是发生烯胺的水解。
(2) 关环时的亲核性
X原子的亲核性很强的话,对于关环步骤是有利的。例如,下图中的吡唑并[1,5-a]嘧啶可以异构化为吡唑并[3,4-b]吡啶。这是因为C4原子比吡唑酯中的氮原子具有更高的亲核性。请注意,该反应底物中的X原子不是杂原子而是C原子也是非常稀少的一个例子。

(3) 立体效应
对于同一底物的自身的异构化来说、取代基的立体效应决定了底物-生成物相互的平衡关系。例如、下图所示的 3-甲基-1,8-二氮杂中氮茚、以3,5位两个取代基之间的立体位阻为动力,经由Dimroth 重排异构成 2-甲基-1,8-二氮杂中氮茚。

反应实例

Dimroth 重排的底物可以通过单纯的缩合反应就能简单制备的杂原子多环化合物,通过异构化变换成异构化产物的一种反应。例如、上图中的杂环底物2可以通过4-肼基噻吩并[2,3-d]嘧啶1 与原酸酯进行缩合制备。而 2 的1,2,4-四唑并[4,3-a]嘧啶部位容易发生Type I-a 型的 Dimroth 重排。也就是说在酸或者碱的条件下可以实现2 到 3 的转换。
需要注意的是,如果不考虑重排,通过底物1与甲酸进行缩合合成2的话,2会进一步在酸性条件下转换成异构化产物3。
参考文献
-
- El Ashry, E. S. H.; El Kilany, Y.; Rashed, N.; Assafir, H Advances in Heterocyclic Chemistry 1999, 75, 79–165. DOI: 10.1016/S0065-2725(08)60984-8
- Clayden, J.; Greeves, N.; Warren, S.; Wothers, P. 第44章 芳香族ヘテロ環化合物 I: 合成「ウォーレン有機化学 (下)」, 野依良治, 奥山格, 柴﨑正勝, 檜山爲次郎訳, 東京化学同人, 2003, pp 1187–1224.
- Henk, C. Van der Plas Acc. Chem. Res. 1978, 11, 462–468. DOI: 10.1021/ar50132a005
- Fujii, T.; Itaya, T. Heterocycles 1998, 48, 359–390. DOI: 10.3987/REV-97-494
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!















No comments yet.