本文作者:杉杉
导读:
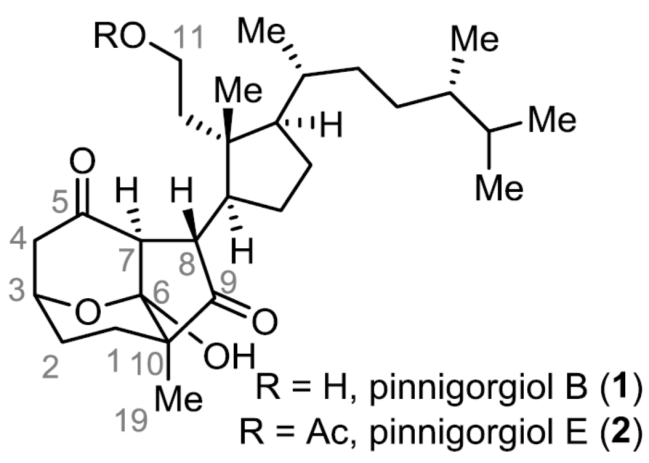
Pinnigorgiols B和E是一种9,11-甾醇(Secosteroids),具有独特的三环γ-二酮骨架。近日,上海有机化学研究所桂敬汉课题组在JACS上发表论文,报道了通过以廉价易得的麦角甾醇(ergosterol)为底物,成功实现了Pinnigorgiols B和E的首次全合成。同时,该反应涉及半频哪醇(semipinacol)重排、酰基自由基环化/半缩酮反应(hemiketalization)的串联反应。值得注意的是,后者可通过一步操作构建具有两个环和三个连续的立体中心的三环γ-二酮骨架。
Concise Synthesis of 9,11-Secosteroids Pinnigorgiols B and E
Xinghui Li, Zeliang Zhang, Huafang Fan, Yinlong Miao, Hailong Tian, YuchengGu, and Jinghan Gui*
J.Am. Chem. Soc.ASAP DOI:10.1021/jacs.0c13426
正文
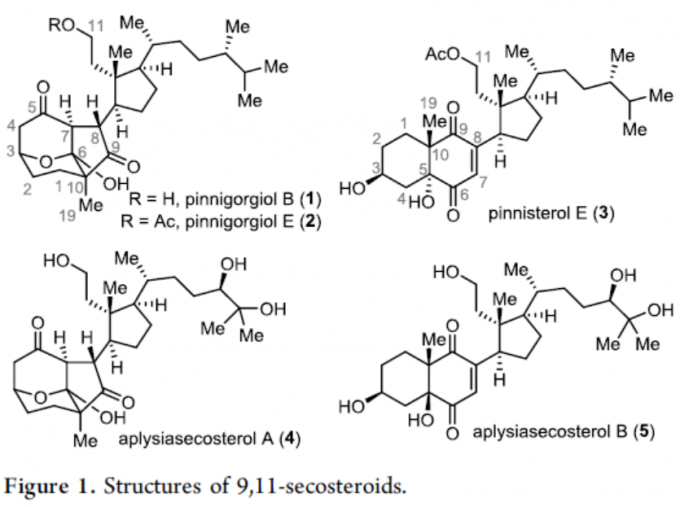
类固醇天然产物的重排,包括甾类固醇(secosteroids)(其中至少一个环被裂解)和abeo-类固醇(其中经典的四环骨架中至少有一个C-C键迁移),由于这些化合物的结构多样性和生物学重要性,近来受到合成化学家的极大关注。同时,一些类固醇可自发进行重排,如环巴胺、glaucogenins、cortistatins、nakiterpiosin、strophasterol A等。其中,9,11-半甾体类固醇Pinnigorgiol B(1)和Pinnigorgiol E(2),由于具有独特的三环[5,2,1,1]癸烷骨架以及含有γ-二酮部分,从而导致合成极具挑战(Figure 1)。2016年,Sung等[1]从Pinnigorgia coral物种中分离出Pinnisterol E(3)。Pinnisterol E是具有一个C-C裂解键的典型甾类固醇,而Pinnigorgiol B既是一种甾类固醇(C9-C11键可裂解)又是abeo-类固醇(A/B双环骨架的几个键可进行迁移),因此作为迄今为止报道较多重排的类固醇天然产物之一。值得注意的是,Kigoshi等[2-3]从Agplysiakurodai中分离出了与1和3具有相同核心骨架的aplysiasecosterol A(4)和aplysiasecosterol B(5)。此外,pinnigorgiols已被证明可诱导肝星状细胞凋亡,而apsecsiasecosterol A对人粒细胞白血病细胞(HL-60)具有中等细胞毒性。2018年,Li等[4]报道通过去对称乳酸化(desymmetrizinglactolization)、Aggarwal锂化-硼化和基于氢原子转移的自由基环化,从而实现天然产物4的全合成。然而,对于1和2的全合成则更具挑战,由于需寻找合适的类固醇前体,可进行C9-C11键的选择性断裂,以及可控的骨架重排,从而将普通十氢化萘A/B环转变为三环γ-二酮核心骨架。
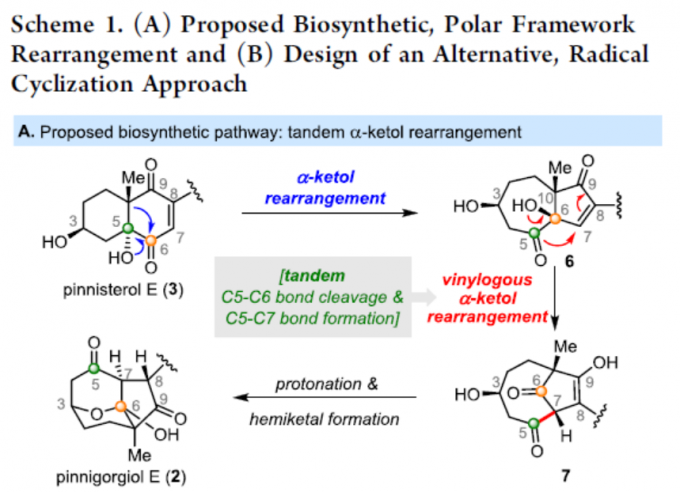
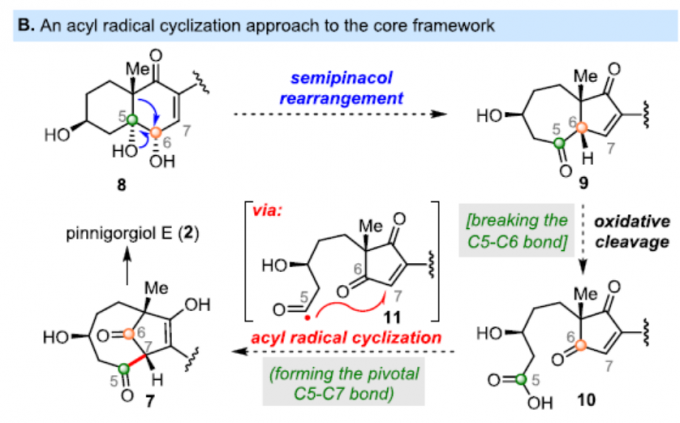
通过Kigoshi和Kita等[2-3]报道生物合成途径逆合成分析发现,2中的三环γ-二酮骨架可通过3的α-酮醇重排生成6,6中的乙烯基α-酮醇重排生成7,7的质子化和半缩酮反应(hemiketal)从而形成2。受此启发,作者设想,以二醇8为底物,经半频哪醇重排形成酮9(该酮可能比6更稳定且易被分离)。同时,与6的乙烯基α-酮醇重排不同,后者涉及串联的C5-C6键断裂和C5-C7键形成,作者推测9的氧化裂解会破坏C5-C6键以提供10,而关键的C5-C7键形成至7的反应可通过酰基自由基环化来完成(Scheme 1B)。
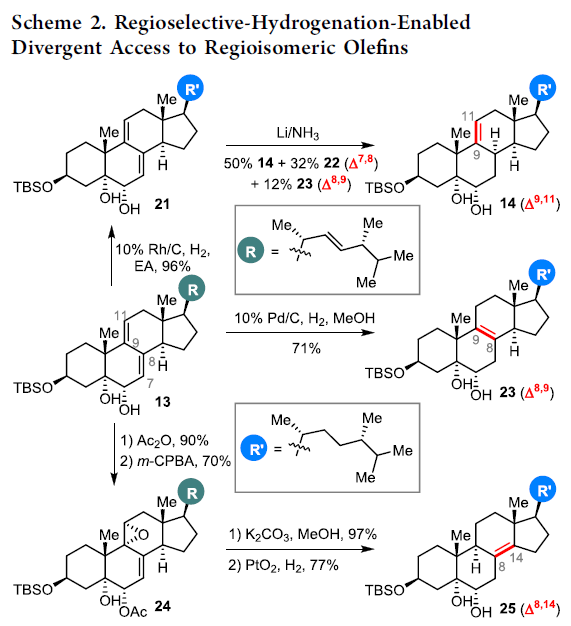
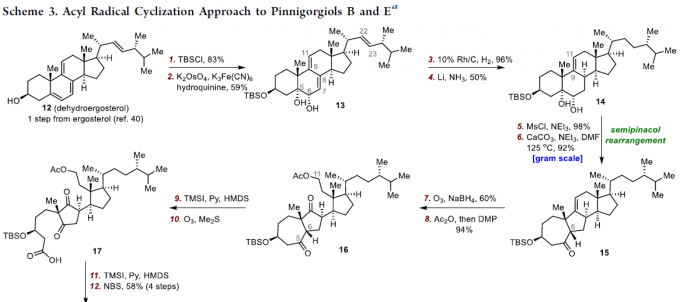
对于通过脱氢麦角固醇(12)进行1和2的全合成的反应中(Scheme 3),首先需对12中的C3羟基进行保护(TBS),再进行C5-C6烯烃进行不对称二羟基化,生成二醇13。然而,对于二醇13的选择性氢化则极具难度,由于存在三个可被氢化的双键,即C9-C11、C7-C8和C22-C23。通过大量条件的筛选,当使用10%Rh/C催化剂,13中的C22-C23双键可被选择性氢化,以96%的收率获得二烯21。二烯21可通过Li/NH3的还原,生成所需的烯烃14作为主要产物,以及C7-C8烯烃(22)和23作为次要产物。同时,当使用10%Pd/C催化剂时,13中的C9-C11、C7-C8和C22-C23均被氢化,获得71%收率的单烯23。此外,13中的C9-C11双键可进行区域选择性环氧化形成了环氧化物24,再除去C6的乙酰基后,可使用PtO2进行氢化获得25。值得注意的是,以13为底物,可分别实现C9-C11,C8-C9和C8-C14双键的区域选择性还原,获得烯烃14、23和25,可为合成其他天然类固醇产物提供了便捷的途径(Scheme 2)。
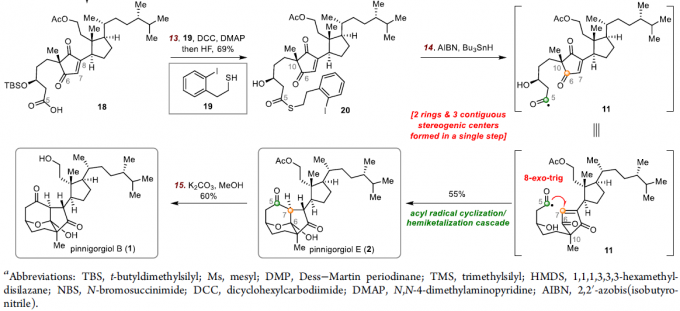
在获得关键的中间体14之后,作者开始对1和2进行了相关的全合成(Scheme 3)。首先,14选择性的甲磺酸化可获得所需的C6甲磺酸酯,将其在CaCO3和NEt3的DMF溶剂中加热,以92%的产率获得酮15。15经臭氧分解和NaBH4还原得到5,11-二醇中间体,再经选择性乙酰化和原位Dess-Martin氧化可转化为16。随后,16中的C5-C6键经氧化裂解获得酸17,通过溴化C6-C7甲硅烷基烯醇醚,可实现17的1,3-环戊二酮的脱氢,在这四个步骤中以58%的收率得到18。紧接着,通过18与巯基19之间的偶联反应,然后用HF除去TBS基团,可获得巯基酯20。最后,将20置于Bu3SnH和AIBN的苯溶液中,可获得55%收率的Pinnigorgiols B(2),涉及酰基自由基环化/半缩酮化串联反应,有效地构建了三环γ-二酮骨架,并在一个步骤中形成了两个环和三个连续的立体中心。此外,通过进一步水解可获得Pinnigorgiols E(1)。
总结
上海有机化学研究所桂敬汉课题组报道了通过以廉价易得的麦角甾醇(ergosterol)为底物,成功实现了Pinnigorgiols B和E的首次全合成。同时,该反应涉及半频哪醇重排、酰基自由基环化/半缩酮反应的串联反应。值得注意的是,可通过一步操作实现具有两个环和三个连续的立体中心的三环γ-二酮骨架的构建。














No comments yet.