本文作者:石油醚
引言
在有机化学历史的长河中,自由基化学的重要性1,总是在离子化学之后。在有机合成的基础课程中,Aldol 反应,Grignard加成,Diels–Alder 周环反应等都处于重要的地位,当代有机化学中,过渡金属催化的交叉偶联反应也常常被人提及(以上都是诺奖级反应),而自由基化学是被遗弃在角落里的孩子一样被人所“歧视”2,3。虽然对于自由基化学有误解,有歧视,认为自由基是神秘,不可控制的。但是还是有很多自由基被优雅的开发出来,并在我们日常的合成有举足轻重的作用,来不断丰富自由基化学。随着自由基化学慢慢被揭开神秘的面纱未来一定会有更加广阔的应用前景,美丽化学创造美丽人生。上一期我们介绍了DFT计算在有机化学反应机理的应用,本期我们将介绍如何研究自由基反应机理的方法。
自由基化学的发展
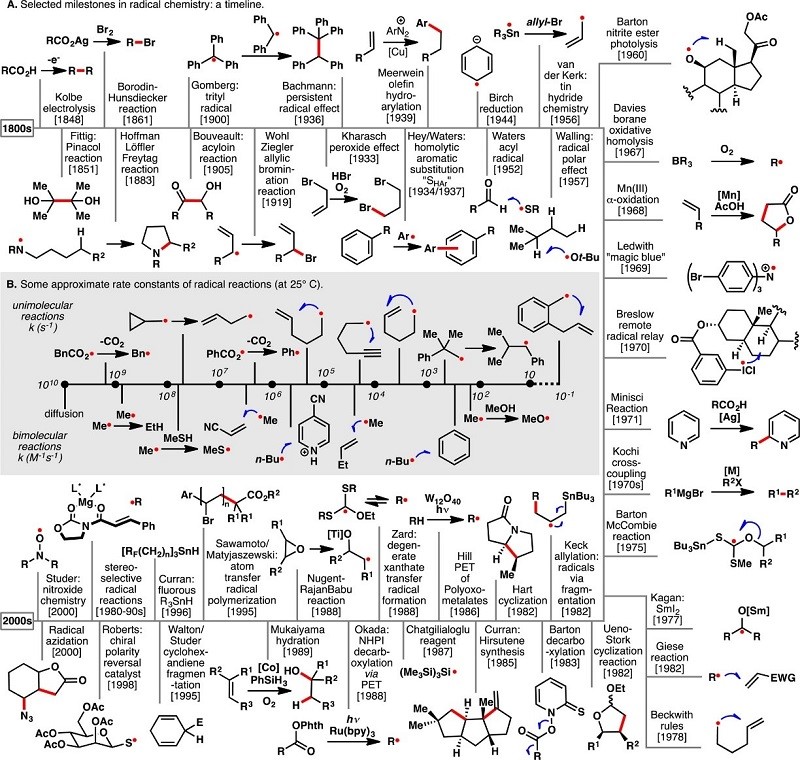
自由基的历史可以追溯到19世纪,但是第一个有用的自由基出现实际上早于Kolbe电化学脱羧基反应4,Borodin-hunsdicker5反应所见以及HFL6碳氢键官能团化等反应,片呐醇偶联反应的发现催生利用羰基自由基的广泛使用,如McMurry偶联和Kagan试剂(1977年首次报道),而机理类似于acyloin缩合反应使Sheehan在甾体合成方面取得了巨大进展。当Wohl-Ziegler反应的自由基机理不清楚,但也得到了广泛的应用(Fig. 1)。
Figure 1 自由基的发展史
自由基化学的“理性”时代发展十分缓慢。 Gomberg7发现了三苯甲基自由基而Kharasch意识到在原子转移反应自由基会产生反马式加成的选择性。之后,Bachmann提出了持久性自由基效应(PRE),从而为合理设计自由基反应奠定基础。Hey and Waters的研究芳烃均裂取代的复杂性,Birch8还原为芳烃的合成应用提供了新的工具。
1952年,Water9的硫醇催化醛均裂反应为获取酰基自由基的提供了有效途径,还对自由基极性效应进行研究。Walling对此进行了广泛的研究并提出了极性反转的催化概念。对于对锡烷产生自由基和烷基硼的氧化均裂产生自由基,为后来的合成应用奠定了基础。与此同时, Barton亚硝酸酯的光解实现了甾体上的自由基转移反应和Breslow10的远程自由基官能团化反应显示了自由基迁移的强大能力。20世纪60年代,随着自由基化学发展,三价锰介导的烯烃的氧化加成反应后来衍生出了非常有用的转化:自由基介导的环加成反应、Minisci Reaction。
20世纪80年代,Walling, Beckwith, 和 Ingold等人通过动力学的方法研究自由基,从而推动了自由基化学长足的发展。如Giese反应是从自由基-烯烃相互作用的研究发展而来的,Bechwith对自由基关环规则的研究则为Ueno-Stork和Hart环化反应奠定了基础,Keck烯丙基化通过研究裂解途径避免了过早的自由基终止,Ingold、Newcomb和其他人开发的各种“自由基时钟”为许多自由基过程提供了绝对速率常数。20世纪80年代末,自由基的前体的范围明显扩大11。
在21世纪到来之际,化学家发明的原子转移自由基聚合反应(ATRP)在材料中得到了广泛的应用12。Curran, Giese, Porter, Sibi, and Renaud13-15 等人开创了立体控制自由基加成的方法。Renaud实验室发展的基于自由基的叠氮转移,则是高效高选择性地构建了碳氮键。自由基化学在这几百年的已经了有了长足的发展,并且在科学家不断的努力,正在揭开这位美丽的少女脸上神秘的面纱,为我们世人所欣赏。科学家是如何验证自由基反应的呢?我们去看看有机化学中自由基化学的检测方法
自由基化学检测方法
- 自由基捕获试剂
在反应中加入自由基捕获试剂(TMPO,BHT,苯醌,DPPH,硝基苯醌,四甲基苯醌, 苯基-N-叔丁基硝酮等)来看主反应是否被抑制和观察有被捕捉后的产物。
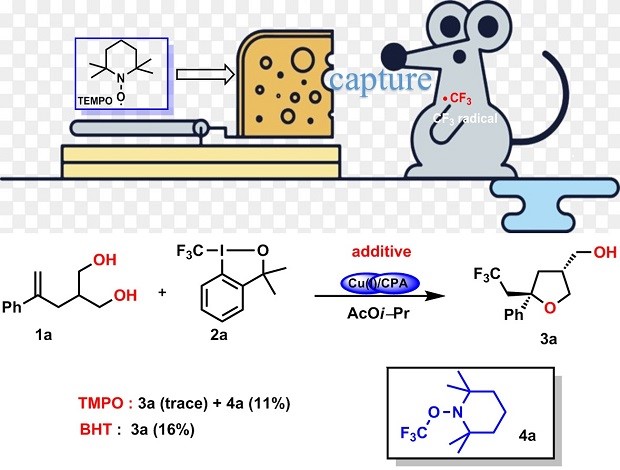
2020年在《Nature Catalysis》16发表了题为“Catalytic enantioselective desymmetrising functionalization of alkyl radicals via Cu(I)/CPA cooperative catalysis”( 铜/手性磷酸催化的烷基自由基的不对称去对称化官能团化反应)一文中,刘心元教授首先在反应中,加入了自由基捕获剂TMPO和BHT,发现主反应被明显抑制,还加入TMPO后还观察到自由基捕获产物CF3-TMPO。(Fig.2)
Figure 2 刘心元教授使用自由基捕获三氟甲基
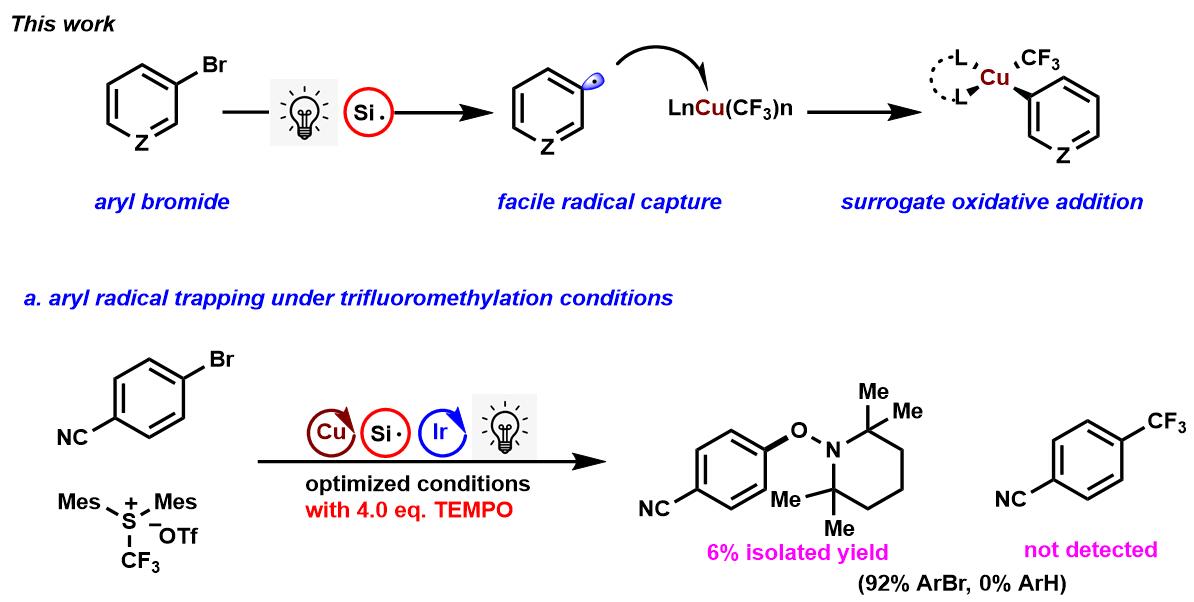
2018年普林斯顿大学的默克催化研究中心17的David W. C. MacMillan教授小组在《Science》发表了题为“A radical approach to thecopper oxidative addition problem: Trifluoromethylation of bromoarenes ”(通过自由基来解决铜氧化加成中问题的根本方法:溴代芳烃的三氟甲基化)。文中,MacMillan教授在反应中加入自由基捕获剂TEMPO,发现主反应被明显抑制。(Fig. 3)
Figure 3 麦克米兰教授使用自由基捕获三氟甲基
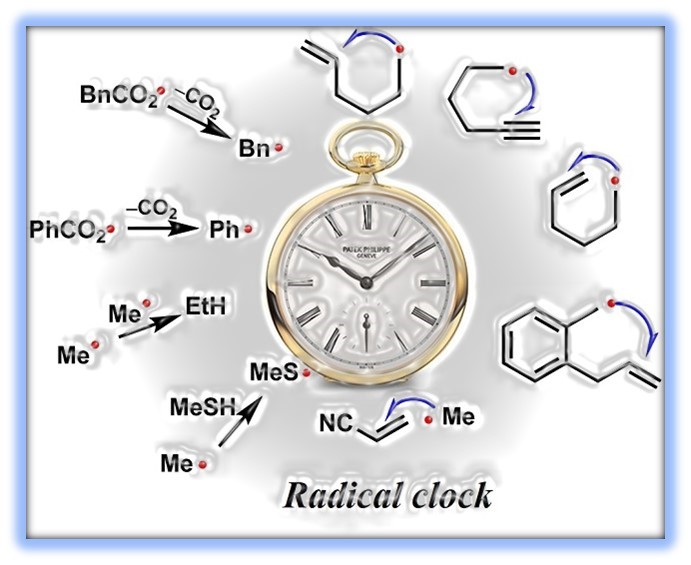
- 自由基钟实验
自由基钟的实质是一种已知的速率反应的化合物,来确定另一个反应的速率提供了校准,为间接测定自由基反应动力学提供了依据。(Fig.4)
Figure 4 自由基钟
2018年李福伟老师18课题组在《Nature Commonications》发表了题为“ Iodine-catalyzed diazo activation to access radical reactivity ”( 碘催化重氮活化获得自由基反应性)。文中,李福伟课题组通过自由基促进环丙烷开环的实验,证明在典型的自由基钟实验中自由基中间体D和E的形成,而且还揭示了自由基E的碘化速度快于氢自由基消除或自由基环化反应,并且进一步验证了反应是自由基反应的机制。(Fig.5)
Figure 5 李福伟研究员应用自由基钟
2018年普林斯顿大学的默克催化研究中心17的David W. C. MacMillan教授小组在《Science》发表了题为“A radical approach to thecopper oxidative addition problem: Trifluoromethylation of bromoarenes ”(通过自由基来解决铜氧化加成中问题的根本方法:溴代芳烃的三氟甲基化)。文中,MacMillan教授采通过以邻-O-(3-甲基-烯丙基)溴苯(5:1反式:顺式混合物)(1a)为底物的自由基时钟实验(Fig.6)。将烯烃混合物置于标准条件下,只得到产率良好的(3a,60%)。环化产物3a以及CF3芳烃产物4a的缺失进一步支持反应过程中芳基自由基生成的假设。(Fig.6)
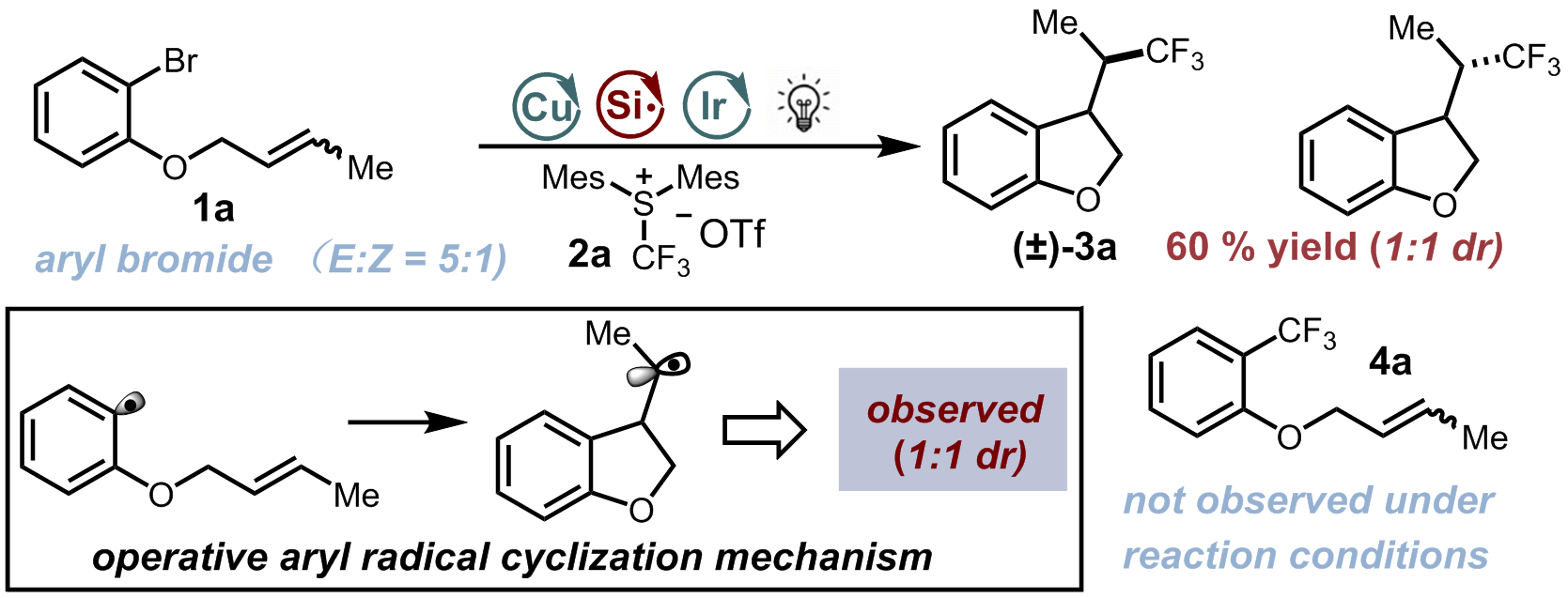
Figure 6 David W. C. MacMillan教授采用的自由基钟实验
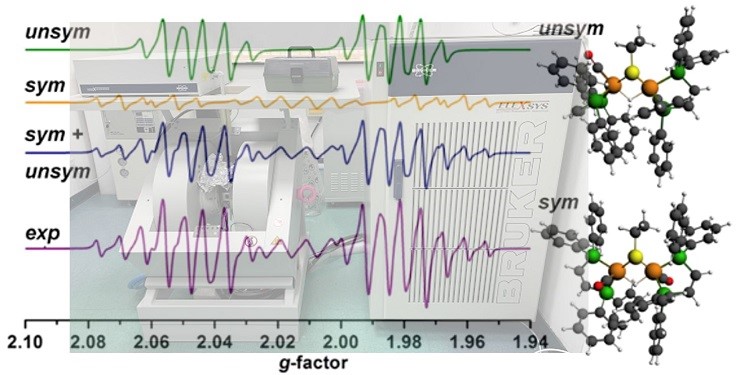
- EPR检测自由基
EPR:电子顺磁共振,又称电子自旋共振(electron spin resonance,ESR),是属于自旋1/2粒子的电子在静磁场下发生的磁共振现象。因为类似静磁场下自旋1/2原子核核磁共振的现象,又因利用到电子的顺磁性,故曾称作“电子顺磁共振”。EPR首先是由前苏联物理学家 E·K·扎沃伊斯基于1944年从MnCl2、CuCl2等顺磁性盐类发现的。物理学家最初用这种技术研究某些复杂原子的电子结构、晶体结构、偶极矩及分子结构等问题。以后化学家根据电子顺磁共振测量结果,阐明了复杂的有机化合物中的化学键和电子密度分布以及与反应机理有关的许多问题。由于仪器的不断发展和技术进步,EPR技术已经在物理学、半导体、有机化学、络合物化学、辐射化学、化工、海洋化学、催化剂等多个领域内广泛的应用。
Figure 7 EPR实验
2019年上海有机所得刘国生研究员课题组在《Nature》上发表了题为“ Site-specific allylic C–H bond functionalization with a copper-bound N-centred radical “(精准剪切铜催化的烯丙位C-H键选择性官能团化)19。文中,刘国生研究员猜想Cu(II)可以与含有磺酰胺结构和双齿配体的N-中心自由基(NCR)结合。为了验证这一猜想,进行了EPR测试,监测到N-F试剂对 (L1)Cu(I) 的氧化,得到了Cu(II)信号(Cu (II) EPR信号)(Fig. 7 (i)),通过自由捕获试剂DMPO试剂也探测到NCR(Fig. 7(ii)).
Figure EPR检测自由基
参考文献
- [1] Yan, M., Lo, J. C., Edwards, J. T. & Baran, P. S. Radicals: Reactive Intermediates with Translational Potential. J. Am. Chem. Soc. (2016) 138, 12692-12714, doi:10.1021/jacs.6b08856.
- [2] Walling, C. Some properties of radical reactions important in synthesis. Tetrahedron (1985) 41, 3887-3900, doi:https://doi.org/10.1016/S0040-4020(01)97172-8.
- [3] Curran, D. P. The Design and Application of Free Radical Chain Reactions in Organic Synthesis. Part 1. Synthesis (1988) 1988, 417-439, doi:10.1055/s-1988-27600.
- [4] Zersetzung der Valeriansäure durch den elektrischen Strom. Justus Liebigs Annalen der Chemie (1848) 64, 339-341, doi:10.1002/jlac.18480640346.
- [5] Borodine, A. Ueber Bromvaleriansäure und Brombuttersäure. Justus Liebigs Annalen der Chemie (1861) 119, 121-123, doi:10.1002/jlac.18611190113.
- [6] Hofmann, A. W. Zur Kenntniss des Piperidins und Pyridins. Ber. Dtsch. Chem. Ges. (1879) 12, 984-990, doi:10.1002/cber.187901201254.
- [7] Gomberg, M. AN INSTANCE OF TRIVALENT CARBON: TRIPHENYLMETHYL. J. Am. Chem. Soc. (1900) 22, 757-771, doi:10.1021/ja02049a006.
- [8] Birch, A. J. 212. Reduction by dissolving metals. Part II. Journal of the Chemical Society (Resumed) (1945), 809-813, doi:10.1039/JR9450000809.
- [9] Harris, E. F. P. & Waters, W. A. Thiol Catalysis of the Homolytic Decomposition of Aldehydes. Nature (1952) 170, 212-213, doi:10.1038/170212a0.
- [10] Davies, A. G. & Roberts, B. P. Bimolecular homolytic substitution at a metal center. Acc. Chem. Res. (1972) 5, 387-392, doi:10.1021/ar50059a005.
- [11] Ollivier, C. & Renaud, P. Formation of Carbon−Nitrogen Bonds via a Novel Radical Azidation Process. J. Am. Chem. Soc. (2000) 122, 6496-6497, doi:10.1021/ja000673h.
- [12] Wang, J.-S. & Matyjaszewski, K. Controlled/”living” radical polymerization. atom transfer radical polymerization in the presence of transition-metal complexes. J. Am. Chem. Soc. (1995) 117, 5614-5615, doi:10.1021/ja00125a035.
- [13] Porter, N. A., Giese, B. & Curran, D. P. Acyclic stereochemical control in free-radical reactions. Acc. Chem. Res. (1991) 24, 296-304, doi:10.1021/ar00010a003.
- [14] Sibi, M. P. & Porter, N. A. Enantioselective Free Radical Reactions. Acc. Chem. Res. (1999) 32, 163-171, doi:10.1021/ar9600547.
- [15] Beckwith, A. L. J. Centenary Lecture. The pursuit of selectivity in radical reactions. Chem. Soc. Rev. (1993) 22, 143-151, doi:10.1039/CS9932200143.
- [16] Cheng, Y.-F. et al. Catalytic enantioselective desymmetrizing functionalization of alkyl radicals via Cu(i)/CPA cooperative catalysis. Nat. Catal. (2020), doi:10.1038/s41929-020-0439-8.
- [17] Le, C., Chen, T. Q., Liang, T., Zhang, P. & MacMillan, D. W. C. A radical approach to the copper oxidative addition problem: Trifluoromethylation of bromoarenes. Science. (2018) 360, 1010-1014, doi:10.1126/science.aat4133
- [18] Li, P. et al. Iodine-catalyzed diazo activation to access radical reactivity. Nat. Commun. (2018) 9, 1972, doi:10.1038/s41467-018-04331-4.
- [19] Li, J. et al. Site-specific allylic C–H bond functionalization with a copper-bound N-centred radical. Nature (2019) 574, 516-521, doi:10.1038/s41586-019-1655-8.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



























No comments yet.