本文作者:自由基先生
导读:
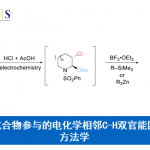
近日,日本Waseda大学的Shibata Takanori (柴田 高範)课题组在Org. Lett.中发表论文,报道一种采用阳离子铱催化剂促进的一系列N-亚苄基苯胺分子参与的远程C-H官能团化反应方法学,进而顺利实现各类邻位取代苯甲醛衍生物的构建。
Ir-Catalyzed Remote Functionalization by the Combination of Deconjugative Chain-Walking and C−H Activation Using a Transient Directing Group, K. H. N. Tang, K. Uchida, K. Nishihara, M. Ito, T. Shibata, Org. Lett. 2022, 24, 1313. doi: 10.1021/acs.orglett.1c04321
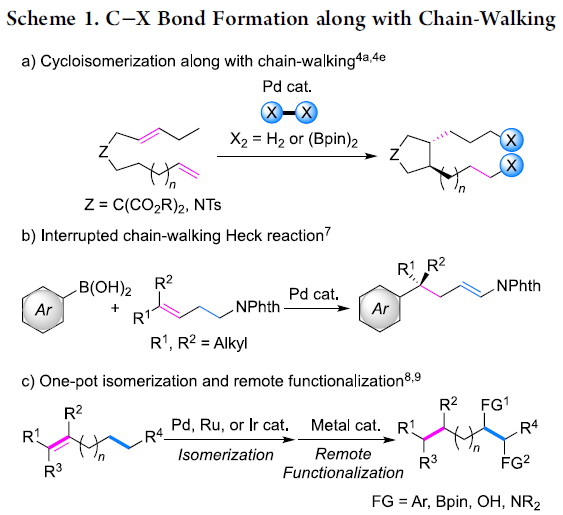
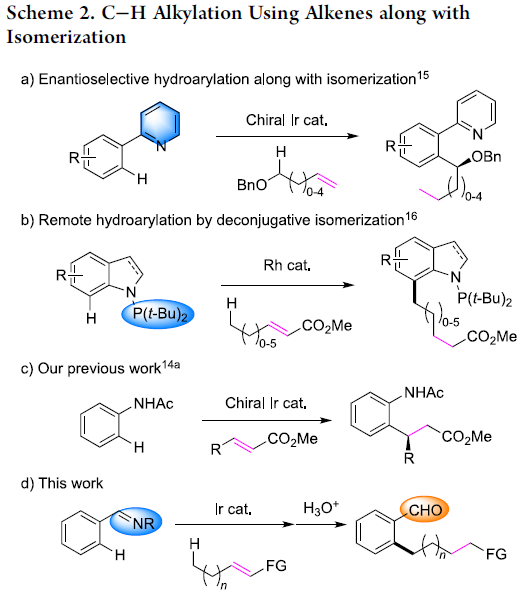
近年来,chain walking [1]策略的相关研究,已经备受有机合成化学家的广泛关注 (Scheme 1) [2]-[6]。这里,受到通过C-H键活化过程引发的伴随双键异构化的氢芳基化反应方法学[7]-[8] (Scheme 2a-2b)以及本课题组前期对于铱催化剂促进的C-H键烷基化方法学相关研究报道[9](Scheme 2c)的启发,Shibata研究团队成功设计出一种全新的采用阳离子铱催化剂促进的一系列N-亚苄基苯胺分子的远程C-H官能团化反应方法学,进而顺利实现各类邻位取代的苯甲醛衍生物的构建 (Scheme 2d)。
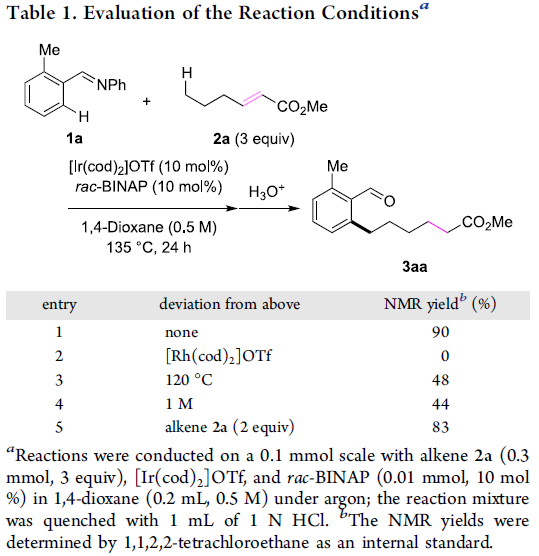
首先,作者采用亚胺1a与(E)-2-己烯酸甲酯2a作为模型底物,进行相关反应条件的优化筛选 (Table 1),进而确定最佳的反应条件为:采用[Ir(cod)2]OTf与rac-BINAP作为催化剂,1,4-二氧六环作为反应溶剂,反应温度为135 oC,并通过采用盐酸 (1 N)进行淬灭,最终获得相应的远程官能团化产物3aa。
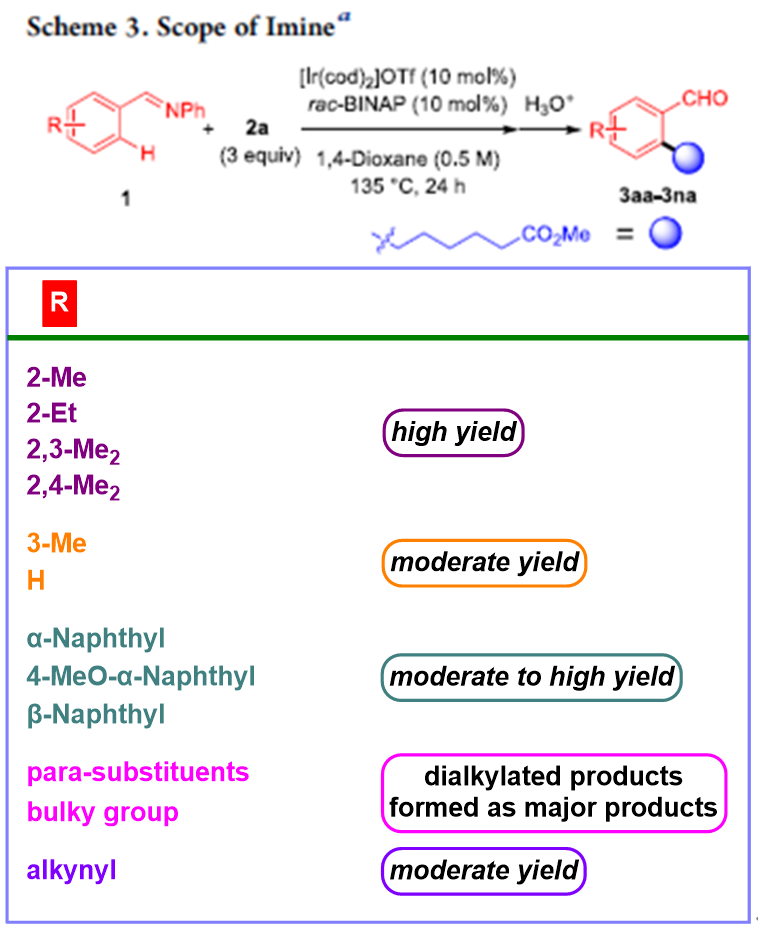
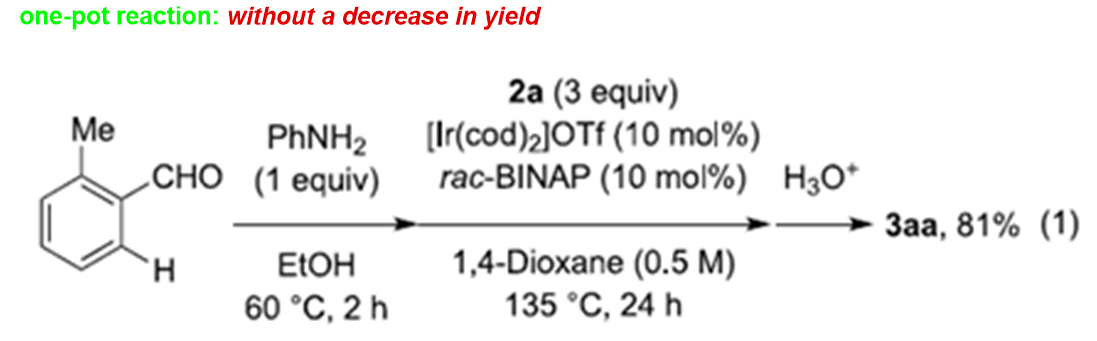
在上述的最佳反应条件下,作者进一步对一系列亚胺 (Scheme 3)以及烯基底物(Scheme 4)的应用范围进行深入研究。

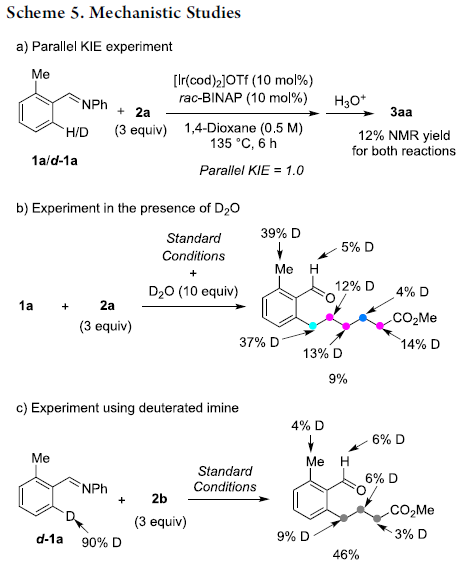
之后,作者通过平行KIE实验 (parallel KIE experiment, Scheme 5a)的相关研究表明,C-H键活化步骤为可逆反应过程,同时,并非反应过程中的决速步骤。并且,该小组通过在重水存在条件下进行的实验研究进一步发现,chain-walking步骤同样为可逆过程 (Scheme 5b)。同时,铱氢化 (hydroiridation)步骤同样为可逆过程,而且无法通过铱氢化步骤形成的反应中间体进一步参与后续的还原消除过程。接下来,该小组通过H/D置乱实验 (H/D scrambling experiment)的相关研究,进一步支持上述结论 (Scheme 5c)。
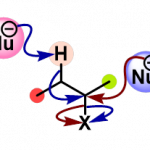
基于上述的实验研究,作者提出如下合理的反应机理 (Figure 1)。
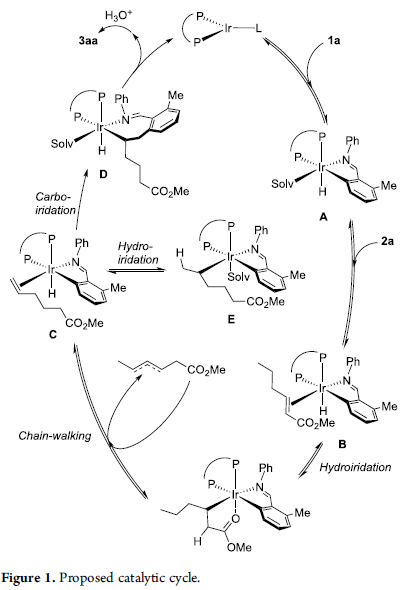
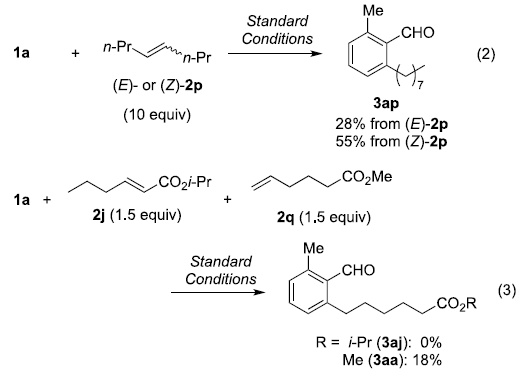
基于上述合理的反应机理,作者进一步提出在chain-walking过程中,烯基组分可能由金属中心进行解离。同时,在去共轭 (deconjugation)过程完成之后, chain-walking过程方可顺利进行 (eq 2-3)。进而表明,上述的端烯基化合物具有较高的反应活性。
总结:
Shibata 研究团队成功设计出一种全新的采用阳离子铱催化剂促进的通过一系列N-亚苄基苯胺分子参与的远程C-H官能团化反应方法学,进而顺利实现各类邻位取代的苯甲醛衍生物的构建。在这一全新的远程C-H官能团化策略中,关键的机理步骤涉及通过Ir-H配合物参与的去共轭异构化 (deconjugative isomerization)以及后续的chain-walking过程。
参考文献:
- [1] V. M. Möhring, G. Fink, Angew. Chem., Int. Ed. 1985, 24, 1001. doi: 10.1002/anie.198510011.
- [2] T. Kochi, T. Hamasaki, Y. Aoyama, J. Kawasaki, F. Kakiuchi, J. Am. Chem. Soc. 2012, 134, 16544. doi:10.1021/ja308377u.
- [3] S. Kanno, F. Kakiuchi, T. Kochi, J. Am. Chem. Soc. 2021, 143, 19275. doi: 10.1021/jacs.1c09705.
- [4] S. P. Ross, A. A. Rahman, M. S. Sigman, J. Am. Chem. Soc. 2020, 142, 10516. doi: 10.1021/jacs.0c03589.
- [5] C. Romano, C. Mazet, J. Am. Chem. Soc. 2018, 140, 4743. doi: 10.1021/jacs.8b02134.
- [6] C. Romano, D. Fiorito, C. Mazet, J. Am. Chem. Soc. 2019, 141, 16983. doi: 10.1021/jacs.9b09373.
- [7] Y. Ebe, M. Onoda, T. Nishimura, H. Yorimitsu, Angew. Chem., Int. Ed. 2017, 56, 5607. doi: 10.1002/anie.201702286.
- [8] A. J. Borah, Z. Shi, J. Am. Chem. Soc. 2018, 140, 6062. doi: 10.1021/jacs.8b03560.
- [9] T. Shibata, M. Michino, H. Kurita, Y. Tahara, K. S. Kanyiva, Chem.-Eur. J. 2017, 23, 88. doi: 10.1002/chem.201604962.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载

















No comments yet.