本文作者:杉杉
导读
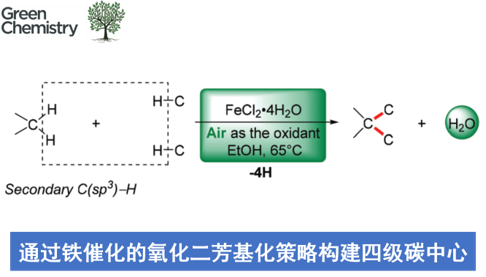
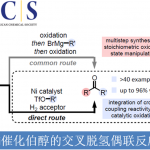
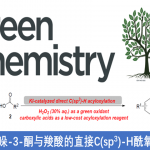
近日,南开大学的徐大振课题组在Green Chem.中发表论文,报道一种采用具有二级C(sp3)-H键的相关底物参与的脱氢交叉偶联反应方法学,进而成功实现相应全碳四级中心的构建。这一策略中,采用FeCl2•4H2O作为催化剂,空气中的氧气作为终端氧化剂,能够在较为温和、无配体以及无碱存在的反应条件下,顺利实现各类吲哚-2-酮与吲哚之间的交叉偶联过程,并以优良的化学选择性,获得一系列具有全碳四级中心的3,3-二取代羟吲哚衍生物。
Iron-catalyzed oxidative bis-arylation of indolin-2-ones for direct construction of quaternary carbons
K. Wu, Y. Xu, L. Cheng, R. Wu, P. Liu, D. Xu, Green Chem. 2021 ASAP. doi: 10.1039/D1GC02886C.
正文
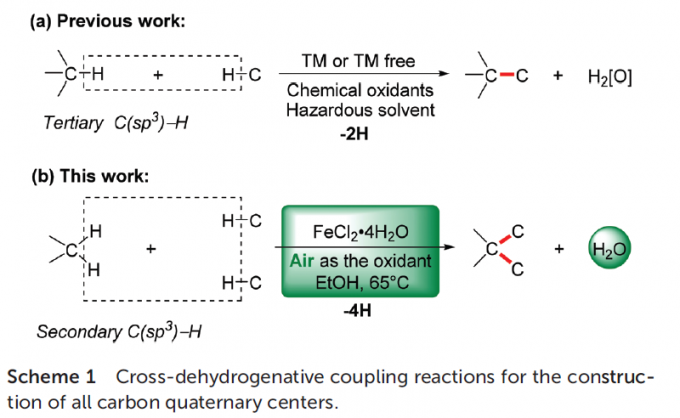
过渡金属催化的交叉偶联反应方法学是当代有机合成化学中构建C-C键的有效策略之一。其中,在氧化条件下,实现两种不同类型的C-H键之间的交叉偶联过程,已经开始受到诸多研究团队的关注[1]。然而,这一类型的氧化CDC策略中,需要选择化学计量的氧化剂,形成反应过程中较为关键的自由基中间体,进而极大降低这一转化过程中的原子经济性。同时,在大规模的工业合成中,采用上述的氧化CDC策略,容易产生较为严重的安全问题。因此,仍需要开发一种更为绿色并且环境友好的C-C键构建的全新策略。
由于四重碳取代基之间存在高度的立体位阻,因此,通过交叉偶联策略构建全碳四级中心的相关研究仍面临巨大挑战[2]。并且,在目前已经报道的各类CDC策略 (Scheme 1a)[3]中,主要存在如下弊端:(1) 需要采用化学计量的各类化学氧化剂 (2) 采用有毒有害的有机溶剂 (3)需要强碱的参与,并涉及较为苛刻的反应条件。为解决上述策略中存在的诸多弊端,作者开始致力于设计全新的合成转化策略,进而能够在无碱存在的反应条件下,选择空气作为氧化剂,并采用一系列具有二级C(sp3)-H键的有机底物,进而顺利实现全碳四级中心的构建。然而,通过具有二级C(sp3)-H键的有机底物,化学选择性地构建全碳四级中心,同样面临如下挑战:(1) 与三级碳自由基相比,二级碳自由基的形成更为困难,并缺乏一定程度的稳定性 (2) 在涉及不同自由基中间体参与的合成转化过程中,反应体系可能十分复杂,并存在诸多不同类型的副反应,进而形成一系列不同形式的副产物。
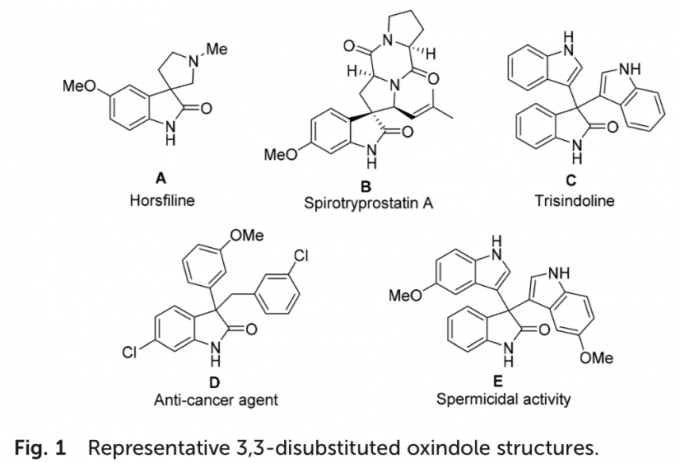
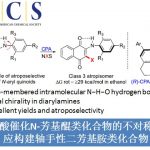
同时,羟吲哚结构单元广泛存在于一系列天然产物以及合成药物分子中。尤其具有全碳四级中心的3,3-二取代羟吲哚为构成一系列生物碱类天然产物与非天然活性分子的重要结构单元 (Fig. 1)。这里,受到本课题组前期研究报道[4]的启发,南开大学的徐大振课题组报道首例铁催化的交叉脱氢偶联反应方法学,进而成功实现一系列3,3-二取代羟吲哚衍生物的合成 (Scheme 1b)。
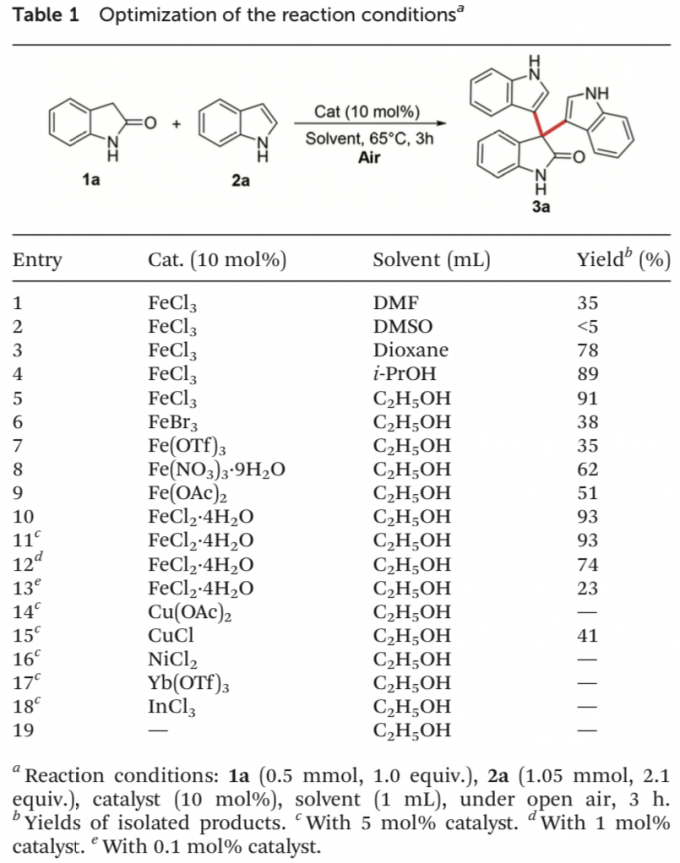
首先,作者采用吲哚-2-酮1a与吲哚2a作为模型底物,进行相关偶联反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用FeCl2•4H2O作为催化剂,空气中的氧气作为终端氧化剂,在乙醇溶剂中,反应温度为65oC,最终获得93%收率的交叉脱氢偶联产物3a。
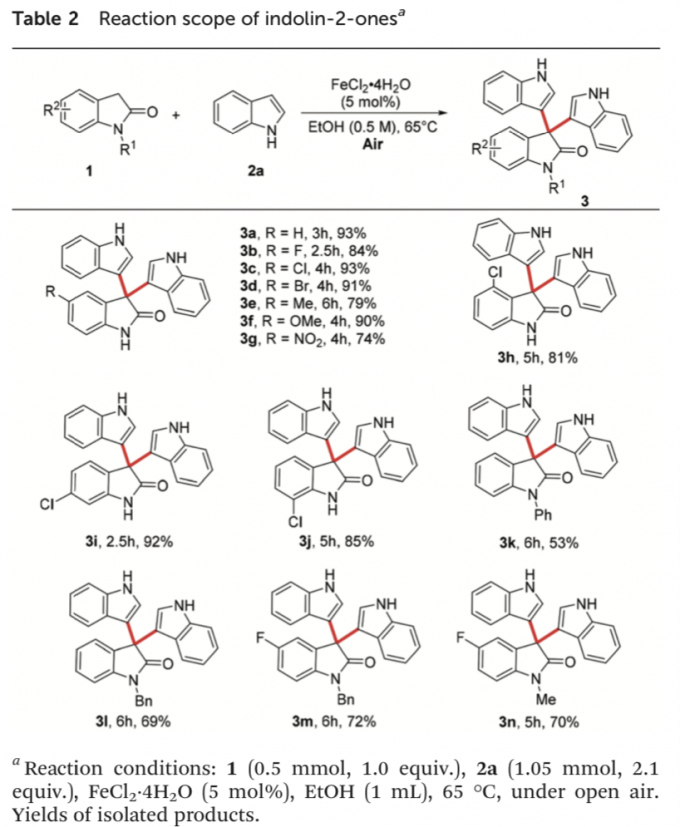
在上述的最佳反应条件下,作者首先对相应吲哚-2-酮底物的应用范围进行考察 (Table 2)。研究表明,一系列具有不同基团取代的吲哚-2-酮底物1均能够较好地与上述的标准反应条件良好地兼容,并获得相应的交叉脱氢偶联产物3a–3n (53-93% 反应收率)。同时,研究发现,C-5位具有供电子与吸电子基团取代的吲哚-2-酮底物,同样能够以较高的反应收率,获得相应的二芳基化产物3a–3g。之后,该小组进一步观察到,在芳基不同位置具有氯基团取代以及不同类型N-保护基团取代的吲哚-2-酮底物均能够有效地参与上述的交叉脱氢偶联过程,并获得中等至优良的反应收率 (3l–3n)。
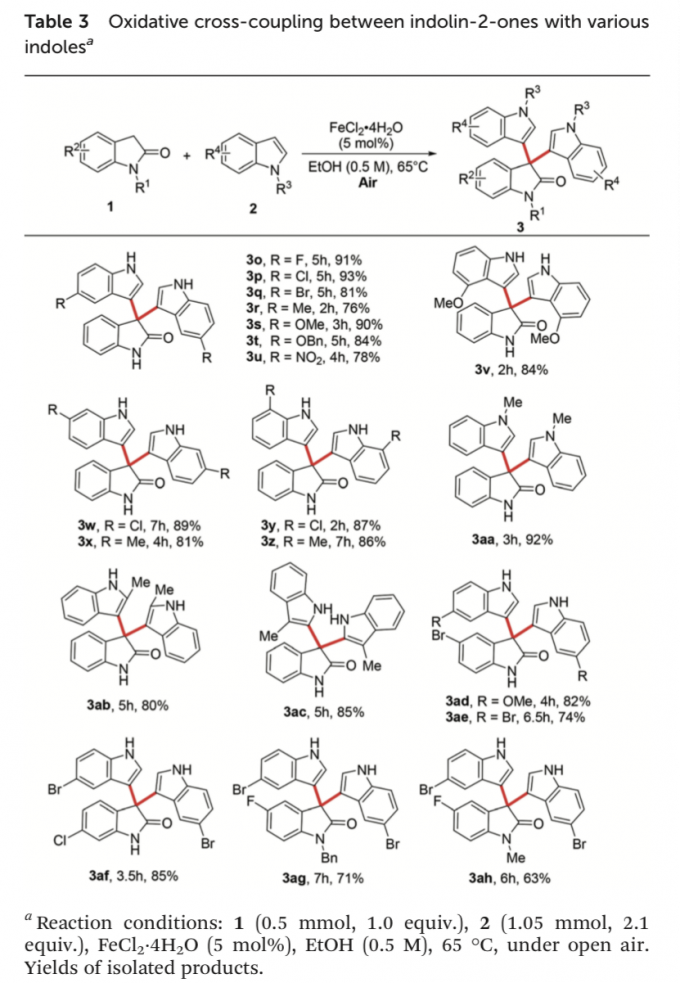
接下来,作者进一步对一系列吲哚底物的应用范围进行考察 (Table 3)。研究表明,芳基中具有不同基团取代的吲哚底物,均能较好地与上述的最佳反应条件进行兼容,并获得相应的二芳基化产物3o–3z (76-93% 反应收率)。尤其对于具有强吸电子基团硝基取代的吲哚底物,同样能够表现出较为优良的官能团兼容性 (3u)。同时,上述的标准反应条件对于1-与2-位取代的吲哚以及3-甲基吲哚底物,同样能够有效地兼容,并获得相应的二芳基化产物3aa–3ac (80-92% 反应收率)。接下来,该小组进一步观察到,其它不同位置取代的吲哚底物,同样能够顺利参与上述的CDC反应过程,并获得相应的目标产物3ad–3ah (63-85% 反应收率)。
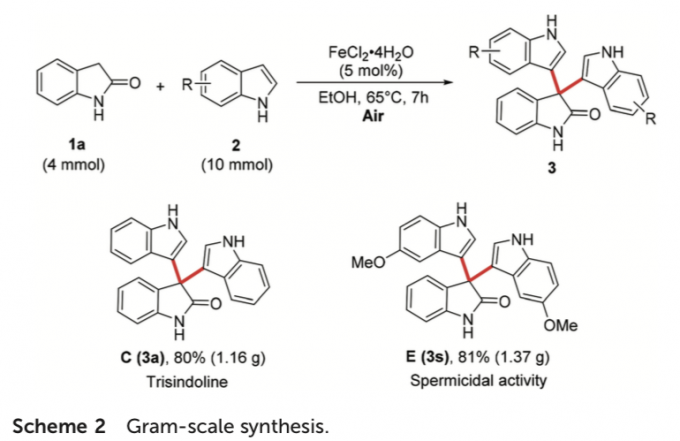
之后,作者对这一全新的CDC反应方法学的合成实用性进行研究 (Scheme 2)。该小组发现,将底物的用量扩大至4 mmol时,能够顺利完成海洋天然产物3a (1.16 g, 80% 反应收率)以及spermicidal 化合物3s的制备 (1.37 g, 81% 反应收率)。
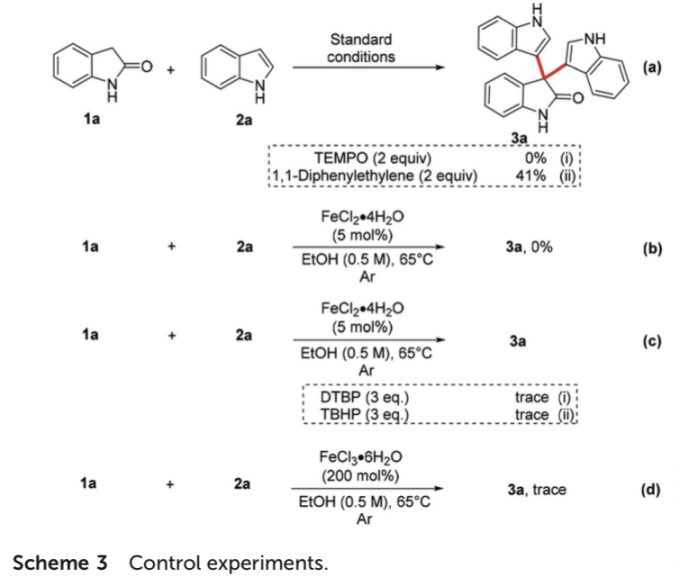
接下来,为提出合理的反应机理,作者进行一系列相关的控制实验研究 (Scheme 3)。首先,作者发现,在1a与2a的标准反应体系中,加入2 eq. 自由基捕获剂时,反应过程受到较为显著的抑制。进而表明这一全新的CDC反应过程中涉及自由基中间体的形成 (Scheme 3a)。之后,该小组发现,将上述的CDC过程在在氩气气氛中进行时,则无法获得相应的二芳基化产物3a。这一实验观察表明,反应过程中,空气 (分子氧)的作用尤为关键 (Scheme 3b)。同时,作者进一步发现,在氩气气氛中,采用其它类型的氧化剂 (例如DTBP与TBHP)或将上述反应过程在200 mol% FeCl3•6H2O存在的条件下进行时,则仅能够获得痕量的偶联产物3a。这一事实表明,上述的合成转化过程中可能涉及含氧中间体的参与 (Schemes 3c-3d)。
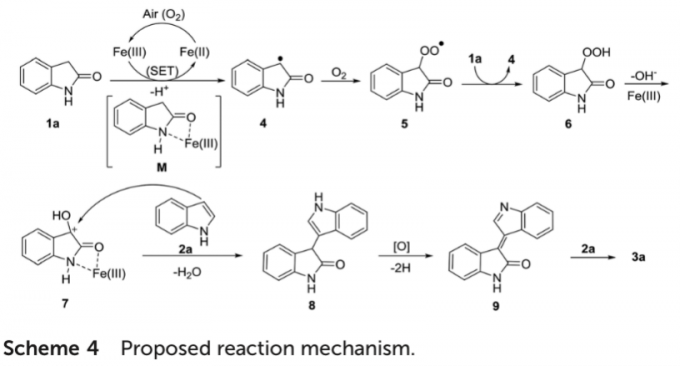
基于上述的实验研究,作者提出一种合理的反应机理 (Scheme 4)。首先,通过螯合型Fe配合物M与1a之间的SET过程,形成相应的自由基中间体4。之后,通过自由基中间体4与氧气之间的偶联过程,形成过氧基中间体5。接下来,通过中间体5攫取1a中的氢原子,形成自由基中间体4与过氧化物6。其中,通过过氧化物6进一步失去羟基之后,再与Fe(III)进行配位,形成中间体7。再通过吲哚对于中间体7的亲核进攻以及后续的消除过程,形成化合物8。最终,通过化合物8的氧化脱氢过程,形成中间体9,并进一步与另一分子的吲哚底物作用,最终获得相应的目标产物3a。
总结
南开大学徐大振课题组成功设计出一种通过具有二级C(sp3)-H键的有机底物构建全碳四级中心的CDC反应策略。这一全新的CDC策略中,采用铁(II)盐FeCl2•4H2O作为催化剂,空气中的氧气作为终端氧化剂。同时,这一全新的CDC策略具有反应条件温和,优良的化学选择性,无需相应的配体以及碱的参与等优势。并且,这一全新的CDC方法学为一系列具有全碳四级中心的3,3-二取代羟吲哚分子的构建,开辟出一条更为简洁有效的反应途径。
参考文献
[1] (a) H. Yi, G. Zhang, H. Wang, Z. Huang, J. Wang, A. K. Singh, A. Lei, Chem. Rev. 2017, 117, 9016. doi: 10.1021/acs.chemrev.6b00620.(b) M. S. Segundo, A. Correa, Synthesis, 2018, 2853. doi: 10.1055/s-0037-1610073.
[2] (a) K. W. Quasdorf, L. E. Overman, Nature, 2014, 516, 181. doi: 10.1038/nature14007.(b) H. Xie, J. Guo, Y. Wang, K. Wang, P. Guo, P. Su, X. Wang, X. Shu, J. Am. Chem. Soc. 2020, 142, 16787. doi: 10.1021/jacs.0c07492.
[3] (a) J. E. M. N. Klein, A. Perry, D. S. Pugh, R. J. K. Taylor, Org. Lett. 2010, 12, 3446. doi: 10.1021/ol1012668.(b) J. Wang, Y. Yuan, R. Xiong, D. Zhang-Negrerie, Y. Du, K. Zhao, Org. Lett. 2012, 14, 2210. doi: 10.1021/ol300418h.
[4] (a) R. Hu, D. Han, N. Li, J. Huang, Y. Feng, D. Xu, Angew. Chem. 2020, 59, 3876. doi: 10.1002/anie.201913400.(b) Y. Lai, R. Wu, J. Huang, J. Huang, D. Xu, Org. Lett. 2020, 22, 3825. doi: 10.1021/acs.orglett.0c01066.
(c) Z. Tan, K. Wu, L. Huang, R Wu, Z. Du, D. Xu, Green Chem. 2020, 22, 332. doi: 10.1039/C9GC03639C.
(d) L. Huang, D. Han, D. Xu, Adv. Synth. Catal. 2019, 361, 4016. doi: 10.1002/adsc.201900400.
(e) R. Hu, Y. Lai, D. Xu, Synlett 2020, 1753. doi: 10.1055/s-0040-1707195.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载


















No comments yet.