作者:石油醚
导读:
近日,瑞士洛桑联邦理工学院祝介平教授团队在J. Am. Chem. Soc上,以“ EnantioselectiveTotalSynthesisof (+)-Stephadiamine ”为题,报道了天然产物 (+)-Stephadiamine全合成路线。其中,关键步骤主要涉及去芳构化对映选择性的Michael加成;原位硝酮生成串联[3+2]环加成;Curtius重排反应;可见光促进的苄位碳氢键氧化;后期分子内酯交换。
“EnantioselectiveTotalSynthesisof (+)-Stephadiamine
Baochao Yang, Guang Li, Qian Wang, and Jieping Zhu* J. Am. Chem. Soc., 2023, 145, 5001-5006. ASAP. doi:10.1021/jacs.3c04493“
正文:
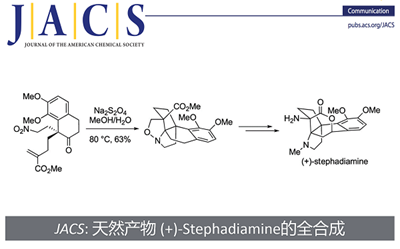
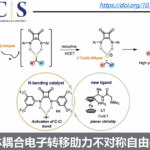
传统中药中,千金藤属植物常被广泛用于治疗哮喘、痢疾、发烧和疟疾等疾病。因此,对自千金藤属植物的哈苏巴南类生物碱分离研究受到合成化学家们的广泛关注[1]。天然产物norhasubanan类生物碱Stephadiamine是由日本科学家Ibuka及其同事于1984年从千金藤Stephania japonica分离获得 (Figure 1)[2],其绝对构型通过自身及其衍生物的X-ray单晶确定。近日,祝介平教授课题组报道了天然产物 (+)-stephadiamine全合成路线设计,并发表于J. Am. Chem. Soc上。
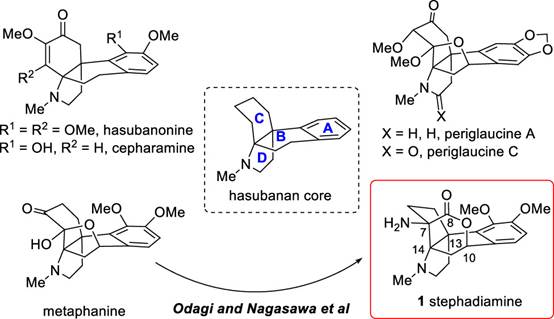
Figure 1. Structures of stephadiamine and representative examples of hasubanan alkaloids.
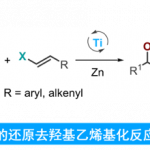
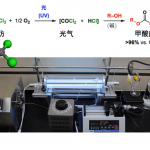
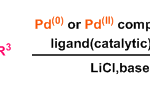
通常,哈苏巴南类生物碱含有一个共同的氮杂[4.4.3]propellane核心骨架。然而, stephadiamine是其中唯一一个核心骨架结构比较特殊的生物碱,结构上结构上具有 [4.3.3]propellane核心骨架和跨环的δ-内酯结构,同时含有四个立体中心,包括一个全碳季碳 (C13) 和两个α-叔胺的杂季碳 (C7和C14)[3]。基于上述Stephadiamine骨架的,作者对天然产物(+)-Stephadiamine进行了相关的逆合成分析(Figure 1A 和1C),即α-烯丙基-β-萘酚 (6)与硝基乙烯(7)发生去芳构化的对映选择性Michael加成反应获得中间体(5)。(5)发生选择性硝基还原环化生成硝酮串联[3+2]环加成反应构建[4.3.3]propellane核心骨架获得(3),(3)再通过Curtius重排反应成功引入α-叔胺获得砌块(2)。最后,中间体(2)发生可见光促进的苄位碳氢键氧化和分子内酯交换反应即可合成天然产物(+)-stephadiamine。
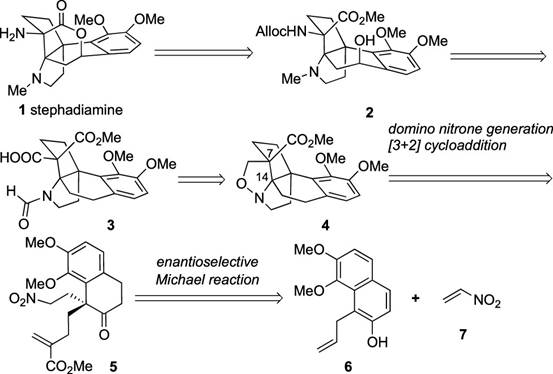 Figure 2. Retrosynthetic Analysis of (+)-Stephadiamine
Figure 2. Retrosynthetic Analysis of (+)-Stephadiamine
首先,作者进行了关键的中间体(4)的构建,如图Figure 3所示。
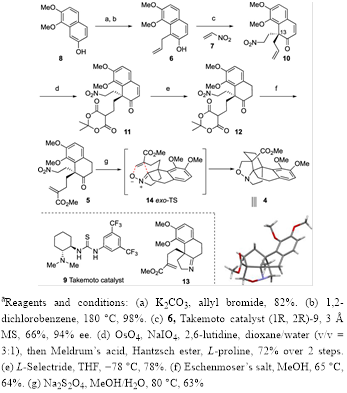
Figure 3. Synthesisof PentacyclicPropellane 4.

其次,该小组完成了(+)-Stephadiamine全合成路线设计,如Figure 4。
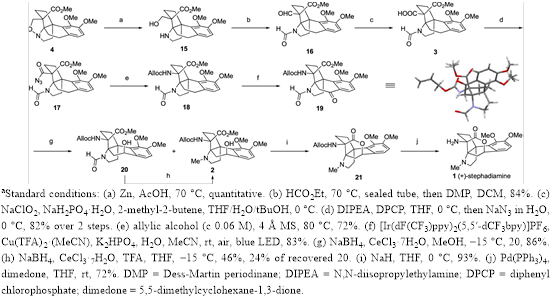
Figure 4. Total Synthesis of (+)-Stephadiamine (1)

总结:祝介平教授报道了天然产物(−)-Stephadiamine全合成路线。其中,关键步骤主要涉及去芳构化对映选择性的Michael加成;原位硝酮生成串联[3+2]环加成;Curtius重排反应;可见光促进的苄位碳氢键氧化;后期分子内酯交换。
参考文献:
- [1] R. H. F. Manske, H. L. Holmes, The alkaloids: chemistry and physiology, Elsevier, 2014; Vol. 73, pp 161– 222.
- [2] T. Taga, N. Akimoto, T. Ibuka, Chem. Pharm. Bull. 1984, 32, 4223. doi:10.1248/cpb.32.4223.
- [3] A. Hager, N. Vrielink, D. Hager, J. Lefranc, D. Trauner, Nat. Prod. Rep. 2016, 33, 491. doi:10.1039/C5NP00096C.
- [4] S.-G. Wang, X.-J. Liu, Q.-C. Zhao, C. Zheng, S.-B. Wang, S.-L. You, Angew. Chem. Int. Ed. 2015, 54, 14929. doi:10.1002/anie.201507998.
- [5] D. B. Ramachary, M. Kishor, Y. V. Reddy, Eur. J. Org. Chem. 2008, 2008, 975. doi:10.1002/ejoc.200701014.
- [6] D. Sádaba, I. Delso, T. Tejero, P. Merino, Tetrahedron Lett. 2011, 52, 5976. sdoi:10.1016/j.tetlet.2011.08.138.
- [7] J. Bonjoch, D. Solé, Chem. Rev. 2000, 100, 3455. doi:10.1021/cr9902547.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载.














No comments yet.