本文作者:杉杉
导读:
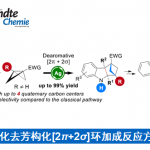
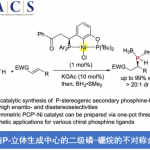
近日,德国Westfälische Wilhelms-Universität Münster的F. Glorius课题组在J. Am. Chem. Soc.中发表论文,报道一种全新的通过可见光诱导EnT (visible-light-induced energy transfer) 过程促进的苯甲酰甲酸酯衍生物与BCB (bicyclo[1.1.0]butane)之间的的形式[2π + 2σ]光环加成/C−H 攫取/芳基迁移反应方法学,进而成功完成一系列多取代2-oxa-BCH (2-oxabicyclo[2.1.1]hexane)分子的构建。
Synthesis of Polysubstituted 2‑Oxa bicyclo[2.1.1]hexanes via Visible-Light-Induced Energy Transfer
Y. Liang, R. Kleinmans, C. G. Daniliuc, F. Glorius, J. Am. Chem. Soc.2022, 144, 20207. doi: 10.1021/jacs.2c09248.
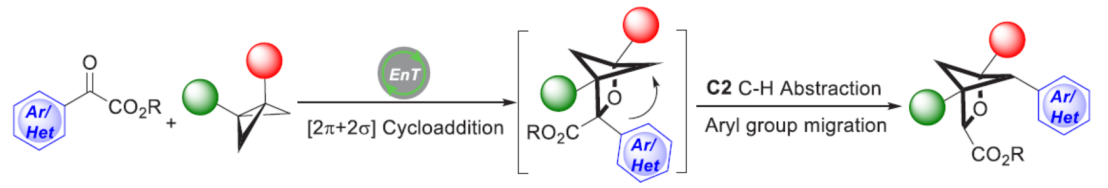
正文:
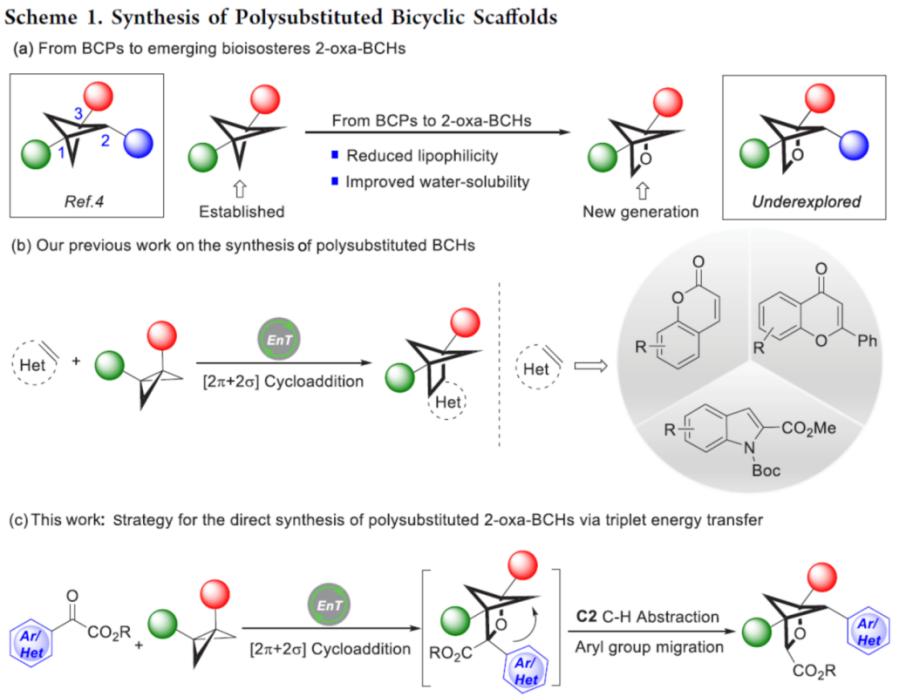
目前,对于构建多取代BCP (bicyclo[1.1.1]pentane)[1](Scheme 1a) 与单取代以及二取代2-oxa-BCH分子[2]的合成转化方法学研究,已经受到诸多课题组的广泛关注。然而,对于多取代2-oxa-BCH分子的构建,却较少有相关的研究报道。这里,受到近年来对于[2+2]光环加成反应方法学[3]-[5]以及本课题组前期对于构建多取代BCH 分子 (Scheme 1b)的合成转化方法学[5]相关研究报道的启发,德国Westfälische Wilhelms-Universität Münster的F. Glorius团队成功设计出一种全新的通过可见光诱导EnT过程促进的苯甲酰甲酸酯衍生物与BCB (bicyclo[1.1.0]butane)之间的的形式[2π + 2σ]光环加成/C−H 攫取/芳基迁移反应方法学 (Scheme 1c)。
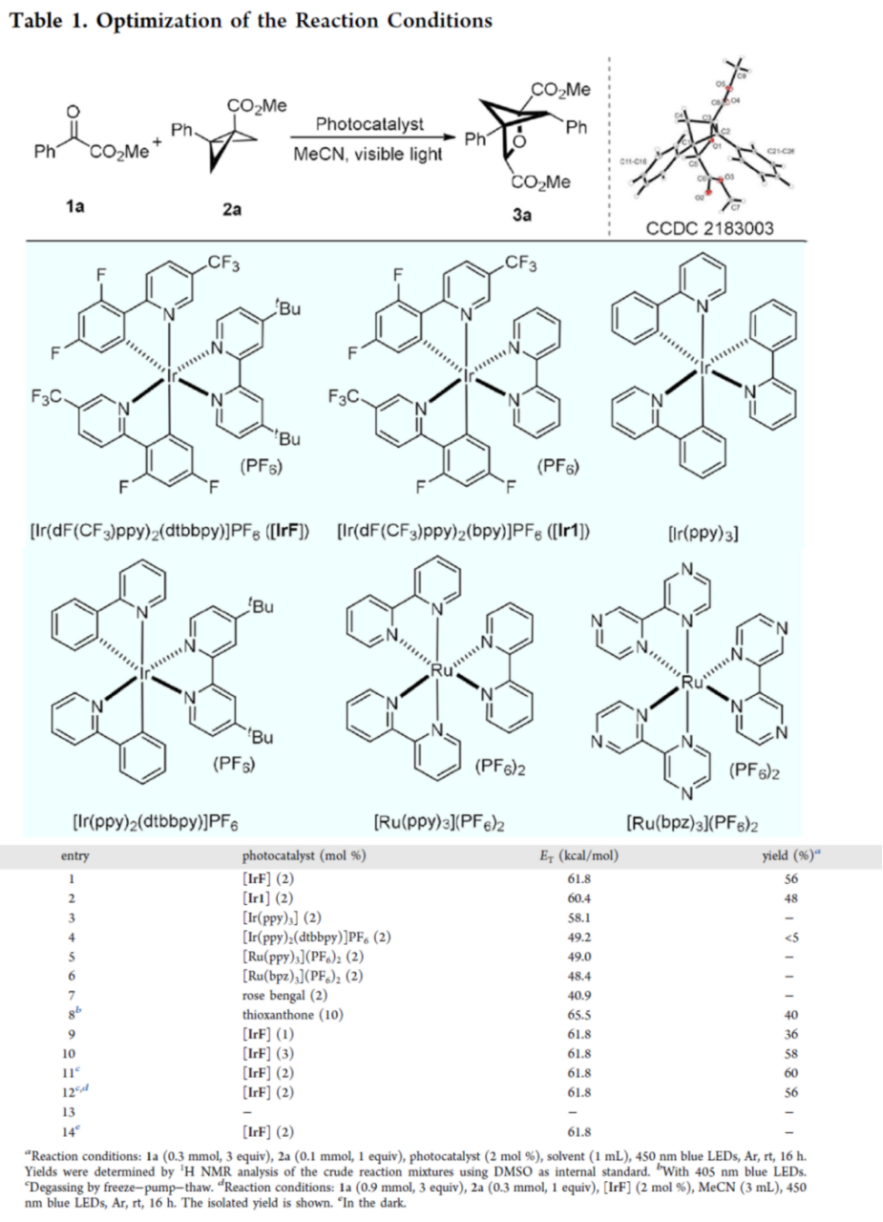
首先,作者采用苯甲酰甲酸甲酯1a与BCB 2a作为模型底物,进行相关反应条件的优化筛选(Table 1)。进而确定最佳的反应条件为:采用[Ir(dF(CF3)ppy)2(dtbbpy)]PF6 ([IrF])作为光催化剂,乙腈作为反应溶剂,蓝光LED (λmax = 450 nm)辐射,反应温度为室温,最终获得56%收率的多取代2-oxa-BCH 产物3a。
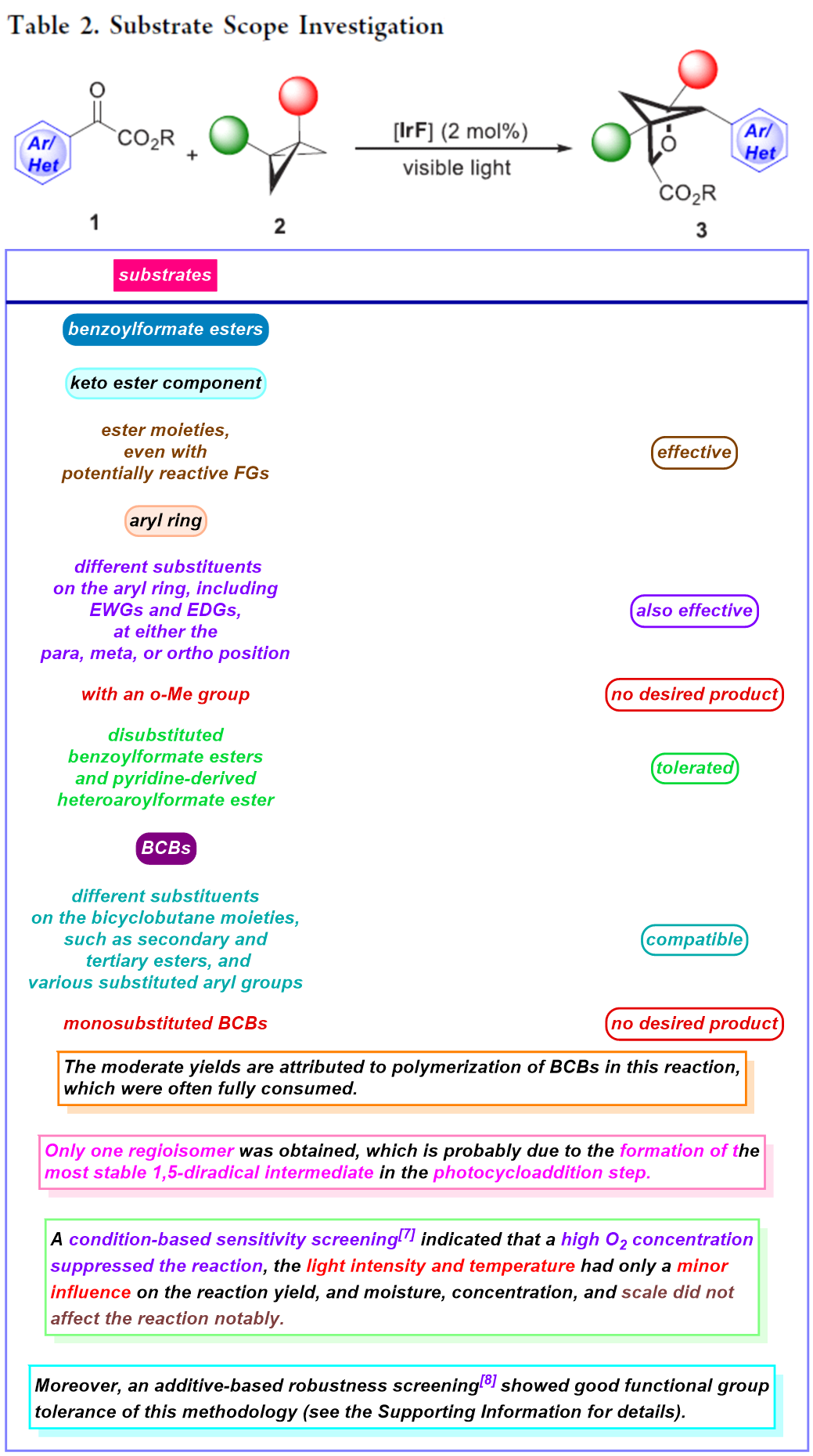
在上述的最佳反应条件下,作者分别对一系列苯甲酰甲酸酯以及BCB底物 (Table 2)的应用范围进行深入研究。
之后,该小组通过如下的一系列研究进一步表明,这一全新的形式[2π+2σ]光环加成反应策略具有潜在的合成应用价值 (Scheme 2)。
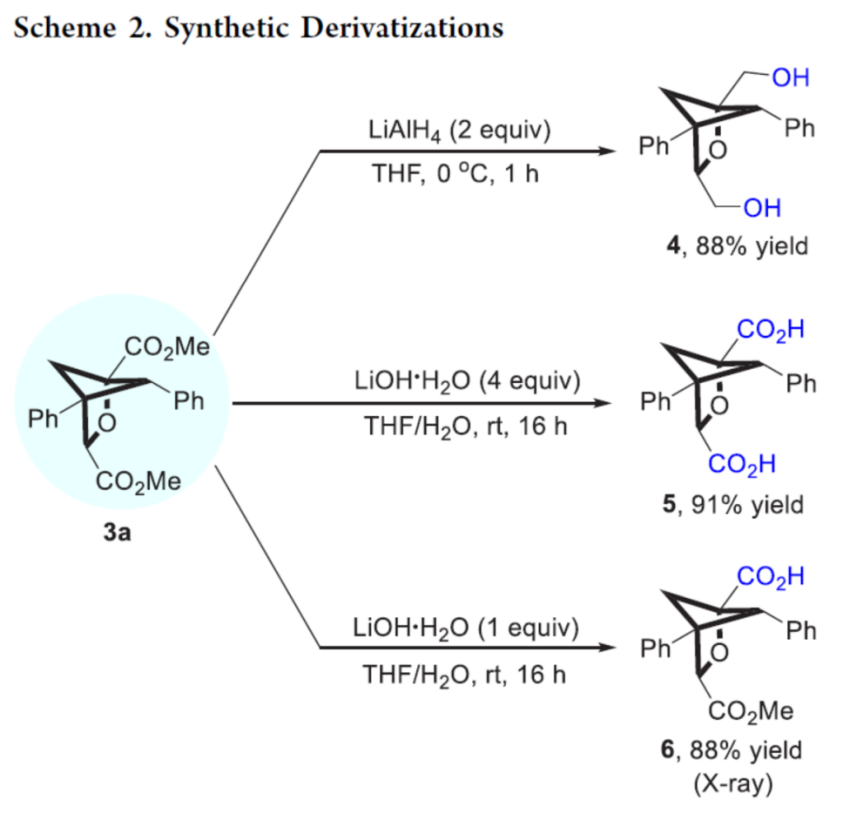
接下来,作者通过Stern-Volmer淬灭实验表明,两种底物能够以相近的反应速率淬灭相应的激发态光催化剂 (SI, Figure S9)。之后,该小组通过CV (cyclic voltammetry)实验,进而排除上述两种底物之间的SET机理路径 (Figures S10 and S11)。同时,通过UV/vis光谱研究表明,1a与2a之间并未形成相应的电子供体−受体配合物 (Figure S12)。综上表明,底物与激发态的光催化剂之间存在显著的相互作用,并且反应过程中涉及相关的EnT过程,两种底物均能够通过光敏化作用,形成相应的三线态。接下来,该小组通过一系列相关的实验 (Schemes 3a-3b)研究表明,2a可能无法通过自由基路径引发上述的形式光环加成过程。同时,在[2π+2σ]环加成过程的引发步骤中,最有可能涉及激发态苯甲酰基甲酸酯的参与 (Scheme 3c)。之后,作者通过自由基捕获实验进一步表明,上述的合成转化过程中,涉及分步的自由基机理 (Scheme 3d)。
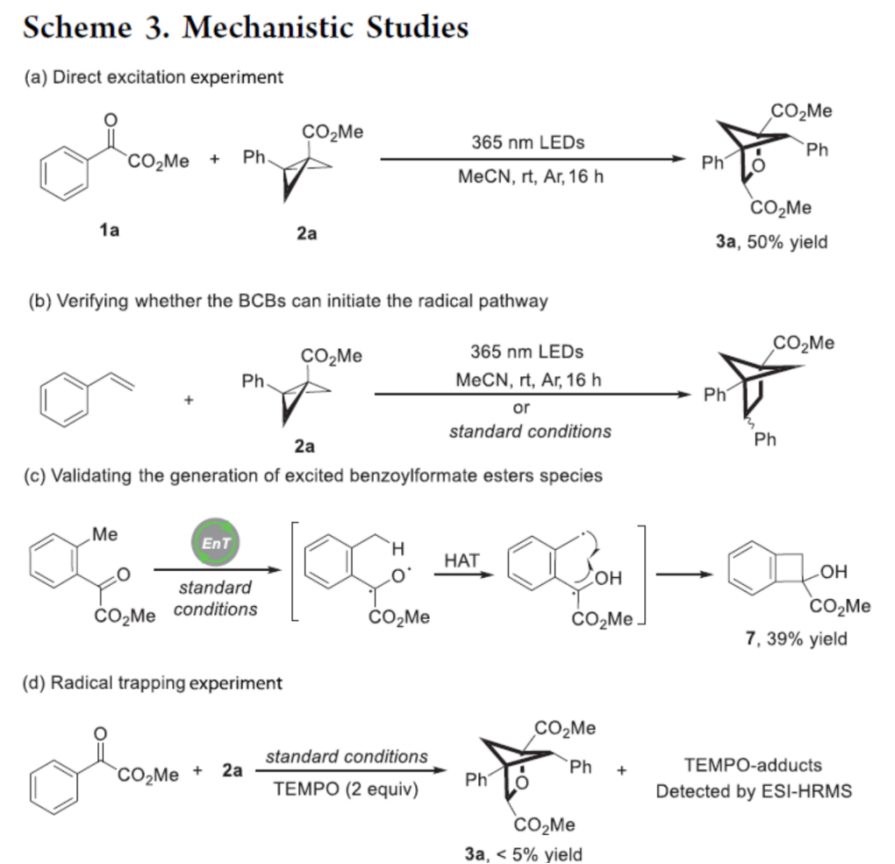
基于上述的实验研究以及前期相关的文献报道[4]-[6],作者提出如下合理的反应机理 (Scheme 4)。
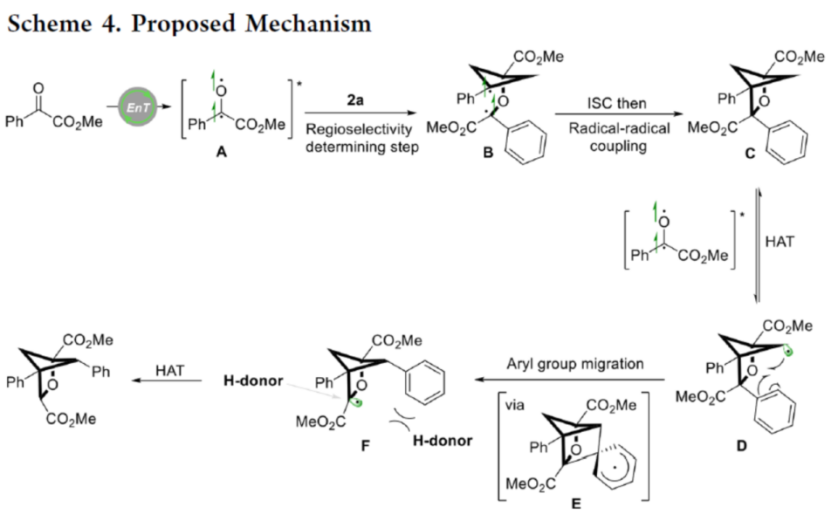
总结:德国Westfälische Wilhelms-Universität Münster的F. Glorius团队成功设计出一种全新的通过可见光诱导EnT过程促进的苯甲酰甲酸酯衍生物与BCB之间的的形式[2π + 2σ]光环加成/C−H 攫取/芳基迁移反应方法学,进而成功完成一系列多取代2-oxa-BCH分子的构建。这一全新的合成转化策略具有温和的反应条件、广泛的底物应用范围以及优良的官能团兼容性等优势。
参考文献:
- [1] Y. Yang, J.Tsien, J. M. E. Hughes, B. K. Peters, R. R. Merchant, T. Qin, Nat. Chem. 2021, 13, 950. doi:10.1038/s41557-021-00786-z.
- [2] R. E. McNamee, A. L.Thompson, E. A. Anderson, J. Am. Chem. Soc. 2021, 143, 21246. doi:10.1021/jacs.1c11244.
- [3] S. Poplata, A. Troster, Y. Q. Zou, T. Bach, Chem. Rev. 2016, 116, 9748. doi:10.1021/acs.chemrev.5b00723.
- [4] J. Ma, S. Chen, P. Bellotti, T. Wagener, C. Daniliuc, K. N. Houk, F. Glorius, Nat. Catal. 2022, 5, 405. doi:10.1038/s41929-022-00784-5.
- [5] R. Kleinmans, T. Pinkert, S. Dutta, T. O. Paulisch, H. Keum, C. G. Daniliuc, F. Glorius, Nature 2022, 605, 477. doi:10.1038/s41586-022-04636-x.
- [6] R. Guo, Y. C. Chang, L. Herter, C. Salome, S. E. Braley, T. C. Fessard, M. K. Brown, J. Am. Chem. Soc. 2022, 144, 7988. doi:10.1021/jacs.2c02976.
- [7] L. Pitzer, F. Schafers, F. Glorius, Angew. Chem. Int. Ed. 2019, 58, 8572. doi: 10.1002/anie.201901935.
- [8] (a) K. D. Collins, F. Glorius, Nat. Chem. 2013, 5, 597. doi: 10.1038/nchem.1669.
- (b) T. Gensch, M. Teders, F. Glorius, J. Org. Chem. 2017, 82, 9154. doi: 10.1021/acs.joc.7b01139.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载




















No comments yet.