本文作者:杉杉
导读
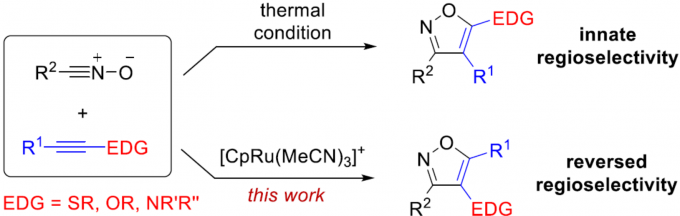
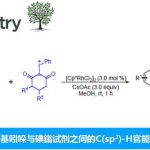
官能团的极性反转可能会影响固有的反应性,从而导致不同的成键方式。近日,香港科技大学孙建伟教授课题组在Organic Letters上发表论文,报道了一种氧化腈与富电子炔烃的环加成反应,从而合成一系列异恶唑衍生物。值得注意的是,在使用钌催化剂时,反应具有反向区域选择性。此外,与一系列缺电子炔烃反应,也观察到同样的反向区域选择性。
Ru-Catalyzed [3+2] Cycloaddition of Nitrile Oxides and Electron-Rich Alkynes with Reversed Regioselectivity
Qiang Feng, Hai Huang, and Jianwei Sun*
Org. Lett. 2021, 23, 2431-2436. DOI: 10.1021/acs.orglett.1c00273
正文
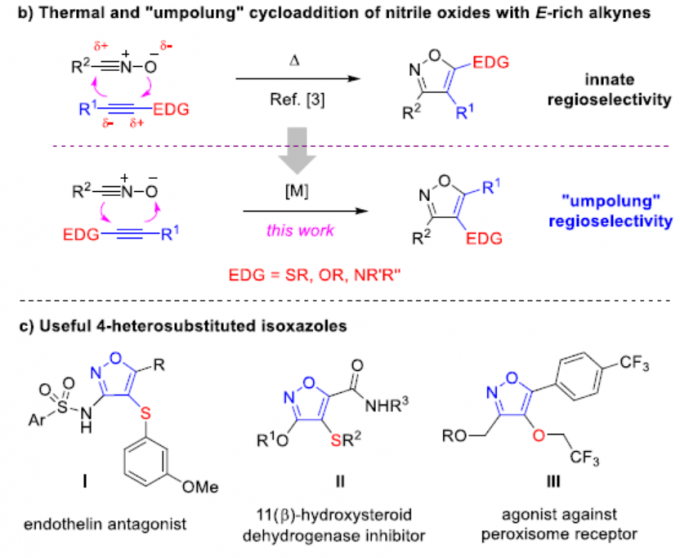
极性反转作为一种强大的策略,可改变固有的反应性,从而导致新的成键方式。其中,具有羰基化合物已被广泛地研究,如羰基可通过氰化物或N-杂环卡宾催化转化为二噻烷或其他酰基阴离子等价物从而成为亲核基团(Scheme 1a)。最近,Deng等[1]报道了有机催化亚胺官能团的不对称极性反转的例子。尽管对于极性反转的研究已取得一定的进展,但可用于极性反转的官能团却非常有限。同时,大多数催化体系均使用有机催化剂,对于金属催化极性反转的反应仍有待开发。对于氧化腈,可参与多种偶极环加成反应,从而构建各种杂环化合物,但对于化学选择性和区域选择性则具有难度。Fokin等[2,3]报道了一种铜和钌催化体系,实现了末端炔烃和卤代炔烃的环加成反应(具有区域选择性)。相反,对于氧化腈与富电子炔烃的环加成反应(高区域选择性和温和催化条件)尚未被研究。此外,氧化腈通常以氧作为亲核点,碳作为亲电点,从而可与极性炔烃进行[3+2]环加成反应(Scheme 1b)。因此,在与富含电子炔烃(如硫代炔烃等)发生的少数热反应中,形成了5-取代异恶唑类化合物作为主要的区域异构体。值得注意的是,通过使用金属催化剂,可实现极性反转,从而合成相反的区域异构体4-取代异恶唑化合物(e.g., I−III, Scheme 1c)。
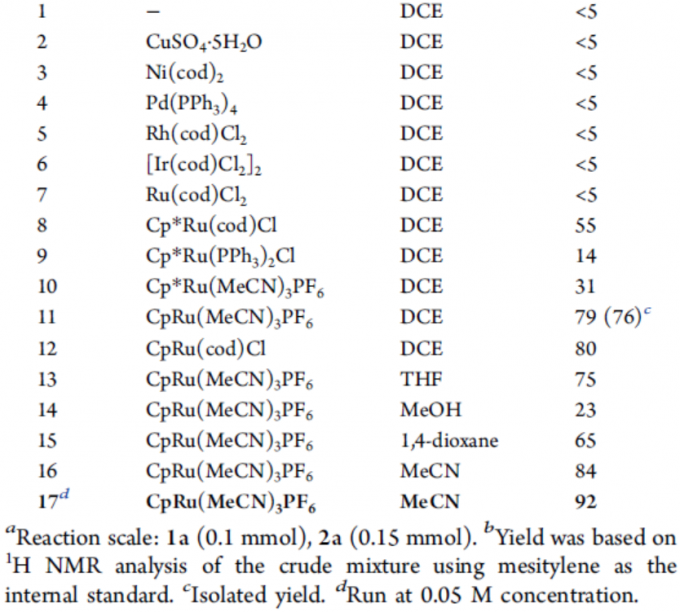
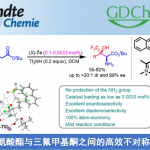
首先,作者以硫代炔烃1a和N-羟基苯甲酰氯2a作为模型底物,进行了相关环加成反应条件的筛选(Table 1)。反应的最佳条件为:以10 mol%的CpRu(MeCN)3PF6为催化剂,三乙胺为碱,可在乙腈溶剂中室温反应,从而获得92%收率的目标产物3a。
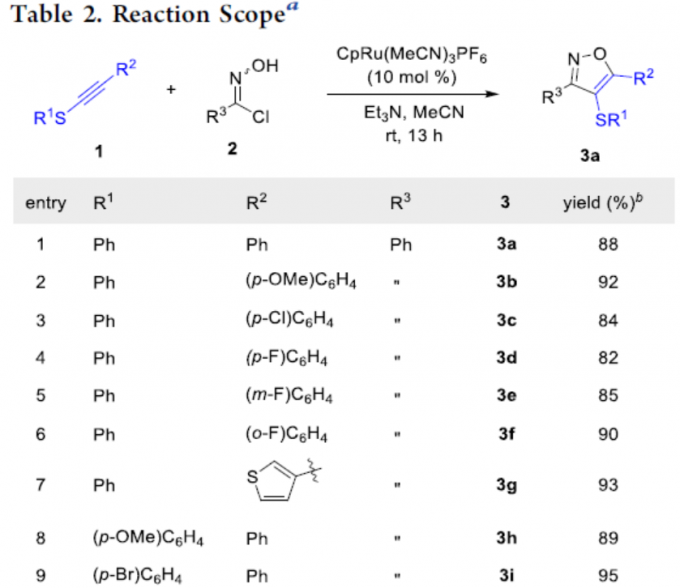
在获得上述最佳反应条件后,作者开始对硫代炔烃底物1和羟肟底物2进行了扩展(Table 2)。当硫代炔烃的R1和R2具有不同的取代基时,如取代苯基、叔丁基、杂环等,均可顺利反应,获得良好收率的相应产物3a–3q。其次,具有不同电子性质的羟肟底物,如烯基等,均与体系兼容,获得产物3r–3v。
紧接着,作者将硫代炔烃改为炔醇醚底物4,对反应的范围进行了扩展(Table 3)。在上述标准条件直接用于炔醇醚4a和羟肟基氯2a反应,可获得所需的异恶唑5a,但收率为42%(底物2a的二聚副反应导致)。因此,作者对反应条件进行了进一步优化,当使用1,4-二氧六环作为溶剂时,可将收率提高至75%。同时,具有不同取代的炔醇醚,均可顺利反应,获得相应的产物5a–5f。
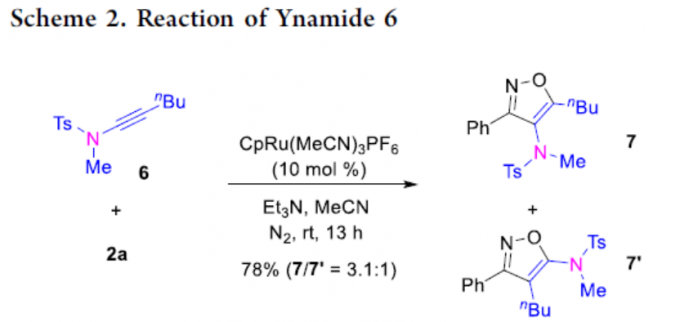
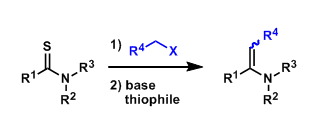
除硫代炔烃和炔醇醚以外,炔酰胺6也可参与环加成反应,但区域选择性中等,如获得产物7:7’的比例为3.1:1(Scheme 2)。较低的区域选择性可能是由于三键的极化性较低和/或亚磺酰胺单元的配位能力较弱导致。
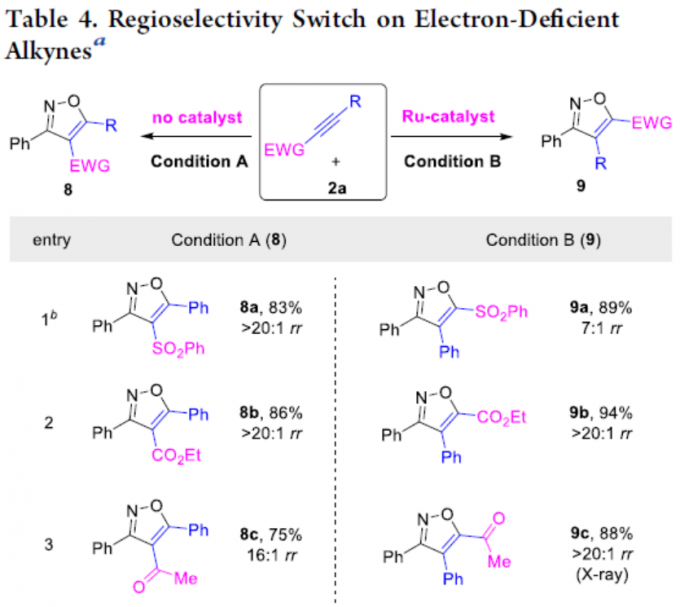
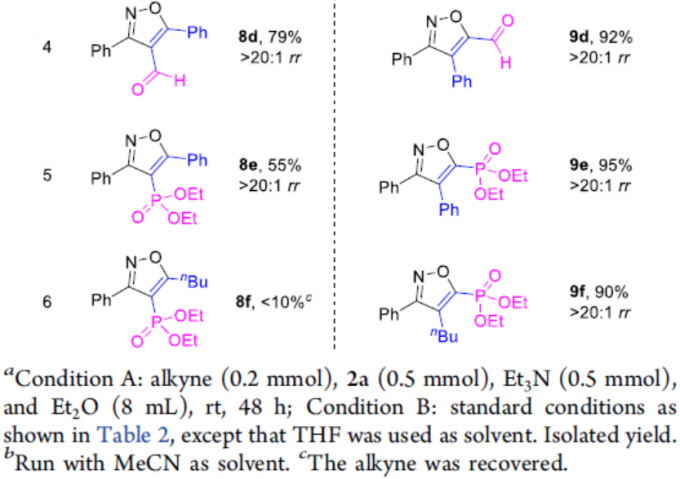
此外,作者还对缺电子的炔烃底物(如炔基砜、酯、酮、醛、膦酸酯等)进行了扩展(Table 4)。作者通过相关的对照实现发现,在无金属催化剂时(Condition A),获得4-位带有吸电子基团的异构体8a–8f。相反,在Ru催化体系下(Condition B),以高区域选择性获得5-位具有吸电子基团的异恶唑9a–9f。
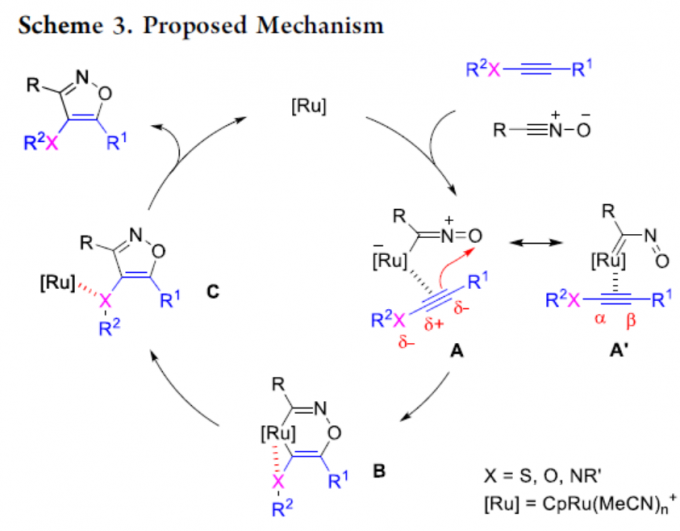
随后,作者提出了一种可能的反应机理(Scheme 3)。首先,钌催化剂与炔烃和氧化腈进行配位形成配合物A(为使电荷分离最小化,可形成共振结构A’)。紧接着,配合物A经氧化环化形成钌杂环化合物B,其中炔烃中的亲核β碳接近氧原子。同时,该步骤也可以看作是共振结构A’的Diels-Alder型[4+2]环加成反应。最后,经还原消除即可获得目标产物以及再生催化剂。
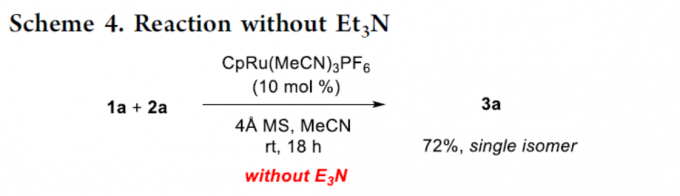
为了进一步证明反应的实用性,作者使用4Å分子筛来替代碱Et3N,在标准条件下1a和2a可顺利反应,以72%的收率形成了相同的产物3a,从而表明该反应也可在中性条件下进行(Scheme 4)。
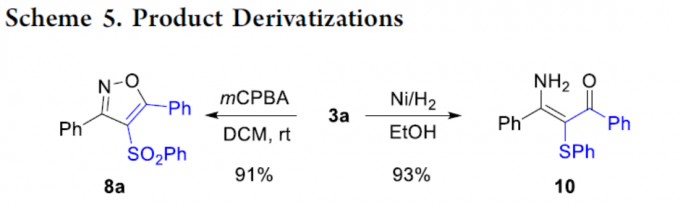
同时,作者还对产物进行了后期衍生化实验(Scheme 5)。首先,3a可被mCPBA氧化形成砜8a。其次,3a可在氢化条件下进行开环,从而获得具有价值的高度官能化烯酮10。
总结
香港科技大学孙建伟教授课题组报道了一种氧化腈与富含电子炔烃(如硫代炔烃、炔醇醚和炔酰胺)的[3+2]环加成反应。值得注意的是,当无催化剂时可获得4-位取代的异恶唑化合物,当使用钌催化剂时可获得5-位取代的异恶唑化合物(反相区域选择性)。同时,该反应具有温和的反应条件、广泛的底物范围、高收率和区域选择性等特点。



















No comments yet.