本文作者:孙苏赟
卤原子和磺酸酯在一定的条件下都是不错的离去基团,除了取代反应,他们也可以作为消除反应的底物。
- 脂肪卤代烃和磺酸酯
(1) 碱作用下的消除反应 (Zaitsev消除)
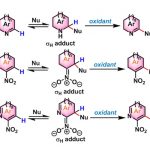
对于消除反应来说,无论反应是通过E1,E2机理,还是E1cb机理,都会比预期的更难发生,并且会产生多种消除异构体,包括区域异构体和Z/E-异构体。通常来说反应的产物是取代较多的较稳定的双键(Zaitsev规则),此外消除也会和亲核取代有竞争反应。
消除反应一般有一下几个影响因素:
- 反应底物:
a.1o和2o卤代烃和磺酸酯:E2消除,立体特异性的反式消除过程;
b. 3o,苯甲醇类:E1消除
c. α-卤代羰基化合物:E1cb消除 - 离去基团:羟基的离去性质较差,通常对于E2和E1cb反应会需要活化转化成其他的基团,酸性条件下可以进行E1消除。
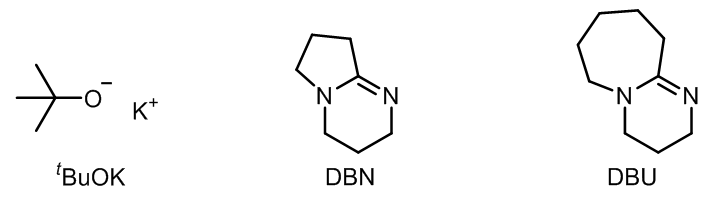
- 碱:
大体积的碱有利于消除,减少取代;
常用的有:
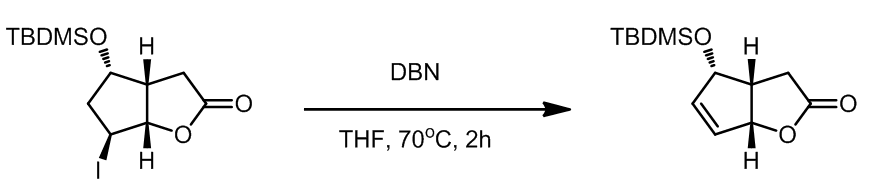
几个例子:
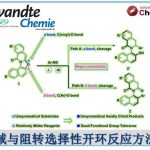
反应中,环氧化物并没有发生开环反应。
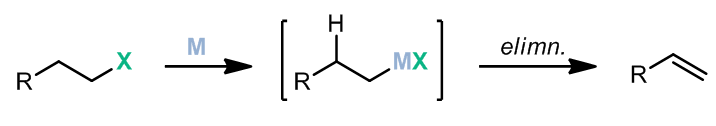
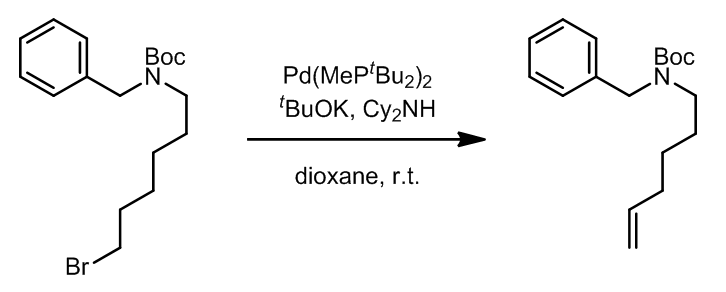
这个反应中,首先是过渡金属和卤代烃发生氧化加成,之后可以非常顺利的进行β-H消除。但其实这样的β-H消除在交叉偶联反应中是不希望发生的副反应,但是却可以温和地用作消除卤素得到双键。
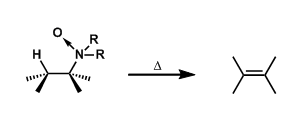
- 几种脱水反应
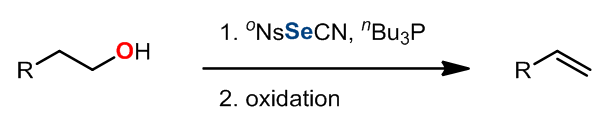
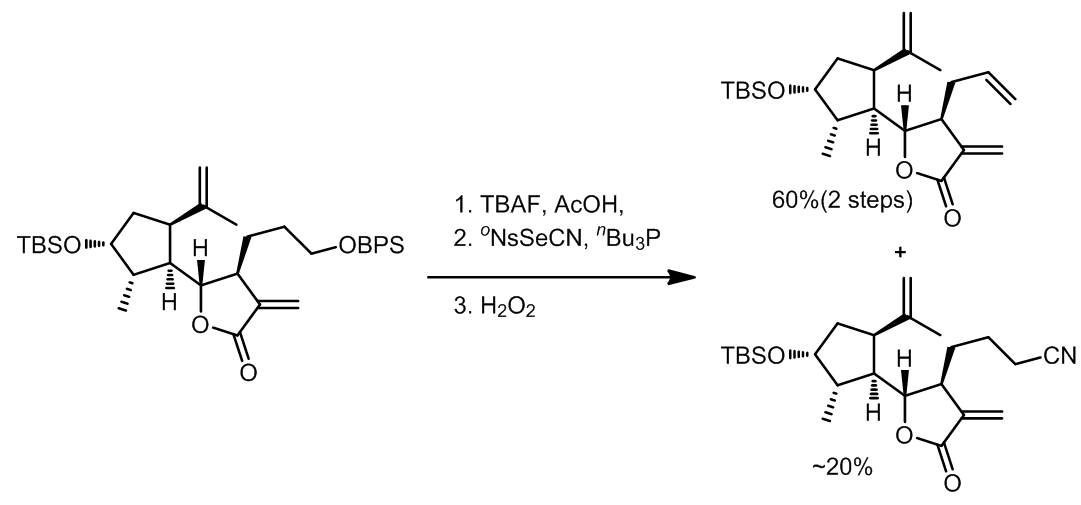
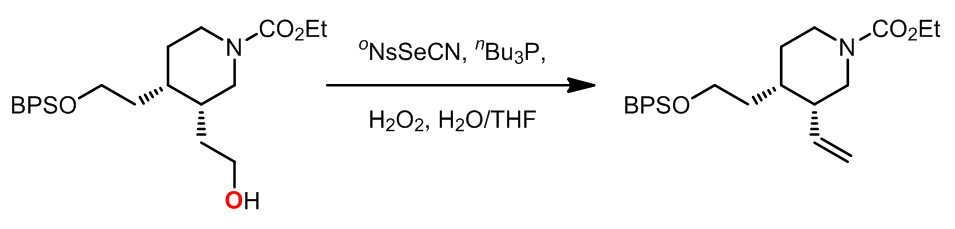
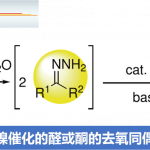
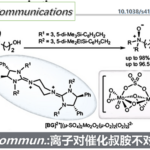
Grieco消除反应中使用到了硒试剂作为氧化剂,反应中发生的是热力学消除,反应对于1o醇效果非常好。反应中试剂活化的过程和Mitsunobu反应类似,此外第二步的氧化过程中氧化剂的选择范围很广,常见的有H2O2,m-CPBA,等。
例如:
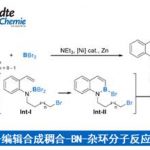
由于反应过程中会产生氰负离子,因此有一定的几率会产生氰代的副产物。
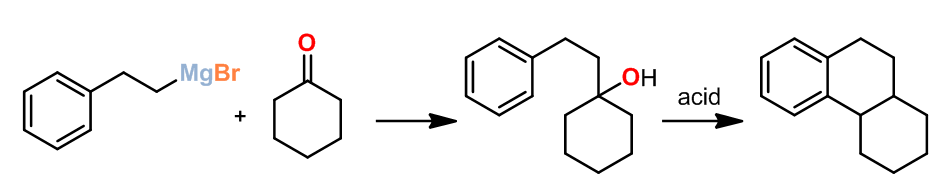
这个反应是由Bogert课题组和Cook课题组几乎同时在1993年报道的,反应过程是Grignard试剂和酮反应生成得到了一个并三环化合物。这是在质子酸条件下羟基脱水经历碳正离子的一个很好的例子,当反应中间体和一个温和的脱水试剂接触时,反应的后一阶段脱水得到双键,并且成环,但是成环过程中具体的位置是和反应底物性质有关。
REFERENCES
- J. Am. Chem. Soc., 1973, 95, 20, 6832-6833, doi: 10.1021/ja00801a053
- J. Am. Chem. Soc., 2005, 127, 31, 11159-11175, doi: 10.1021/ja0529337
- J. Am. Chem. Soc., 2012, 134, 34, 14232-14237, doi: 10.1021/ja306323x
- J. Am. Chem. Soc., 2010, 13, 25, 1488-1489, 10.1021/ja9104478
- Tetrahedron Lett. 2004, 45, 3783. doi :1016/j.tetlet.2004.03.085
- J. Am. Chem. Soc. 1981, 103, 3213, doi: 10.1021/ja00401a050
- J. Am. Chem. Soc. 1981, 103, 3215, doi: 10.1021/ja00401a051
- Science, 1933, 77, 289, doi: 10.1126/science.77.1994.289
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!





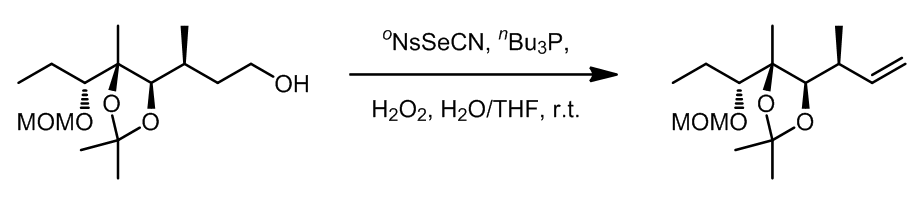


















No comments yet.