本文作者:石油醚
导读
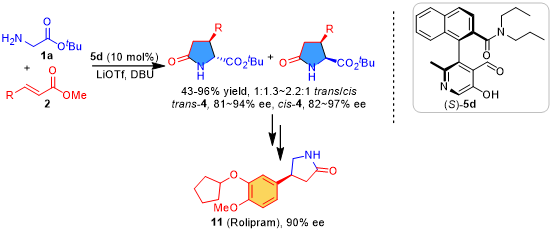
有机合成中,相对较弱的亲电试剂(如α, β-不饱和酯)直接对NH2-保护的甘氨酸酯的不对称a-官能团化仍然是一个重大的挑战。上海师范大学赵宝国教授课题组通过羰基催化的策略成功实现了α, β-不饱和酯)直接对未保护的甘氨酸酯的不对称a-官能团化。以手性吡哆醛5d为羰基催化剂,成功地实现了甘氨酸酯1a与α, β-不饱和酯2在α-C上的直接不对称共轭加成反应,经原位内酰胺化后,以14~96%的产率合成了多种手性焦谷氨酸酯,ee’s为81~97%。
Enantioselective Synthesis of Pyroglutamic Acid Esters from Glycinate via Carbonyl Catalysis.
Jiguo Ma, Qinghai Zhou, Guanshui Song, Yongchang Song, Guoqing Zhao, Kuiling Ding*, Baoguo Zhao*.
Angew. Chem. Int. Ed. (Just accepted) doi:10.1002/anie.202017306
正文
手性焦谷氨酸及其衍生物是一类具有高生物活性的重要化合物,广泛存在于许多天然产物和药用分子中1,2。此外,焦谷氨酸还被用作通用的合成子来制备各种含氮化合物3。如何高效构建焦谷氨酸及其衍生物,已经引起了化学家的广泛关注。在甘氨酸酯的α-C与α, β-不饱和酯进行共轭加成,然后进行内酰胺化,是获得焦谷氨酸衍生物的一种非常简单的策略(图1)。例如,Viallefont,Kanemasa,Kobayashi和其他小组发现,甘氨酸酯亚胺可以与α,β-不饱和酯进行共轭加成,然后对羰基保护基进行脱保护并随后就地内酰胺化,从而得到各种焦谷氨酸酯(图1a)4,5。Soloshonok和Hruby利用甘氨酸席夫碱的Ni(II)配合物作为α-C亲核试剂与α,β-不饱和酰胺反应以三步制备具有优异非对映选择性的取代焦谷氨酸(图1b)6。由于具有亲核位点氨基的存在,未保护的甘氨酸酯与α,β-不饱和酯的直接反应以合成焦谷氨酸衍生物是非常有吸引力的,但是它仍然是有机合成中的一大挑战。由于羰基催化使用合适的醛或酮作为催化剂来激活伯胺的α-H使其直接进行α-官能团化,使其理论上为甘氨酸酯1a的α-C与α,β-不饱和酯2的不对称共轭加成提供了可能7-9。综上,上海师范大学赵宝国教授课题组以手性吡哆醛5d为羰基催化剂,成功地实现了甘氨酸酯1a与α, β-不饱和酯2在α–C上的直接不对称共轭加成反应,经原位内酰胺化后,以14~96%的产率合成了多种手性焦谷氨酸酯,ee’s为81~97%(图 1c)。
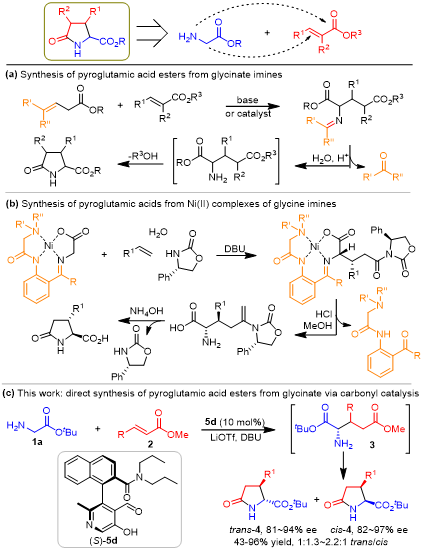
图 1 焦谷氨酸及其衍生物合成策略
首先,作者以甘氨酸叔丁酯1a与α,β-不饱和酯2a为模板底物,进行了相关的反应条件筛选。在10 mol%手性吡哆醛8,105b作为羰基催化剂存在下,反应确实按预期进行,以47%的收率生成了所需的手性焦谷氨酸酯4a(dr =1.2:1)(Entry 1)。由于吡哆醛催化剂5对与反应至关重要,因此作者对与各种类型的吡哆醛催化剂(5a-k)(图2)进行了筛选(Entry 2-13 )。令人惊讶的是,N-甲基手性吡哆醛5a尽管具有非常强的吸电子能力,并且在甘氨酸酯的仿生曼尼希反应中表现出良好的催化活性和优异的选择性(Entry 2 ),但对此反应完全无效,可能是因为5a在催化过程中所促进的太稳定的α-氨基碳负离子中间体对2a的1,4-共轭加成反应的亲核性不足。而用仲酰胺5c代替催化剂5b的伯酰胺侧链导致反应产率的显着提高(Entry 3)。进一步的催化剂筛选表明,就活性和对映选择性而言,手性吡哆醛5d是所考察的催化剂5a-k中的最佳选择。最后通过溶剂(entry 8 vs 5 and 14-15),有机碱(entry 8 vs 19-21),添加剂(entry 8 vs 16)以及温度(entry 8 vs 17-18)筛选,确定了反应的最优条件:使用1a (1.5 eq.),2a (1 eq.),5d (10 mol%),LiOtBu (0.4 eq), DBU(1.0 eq.), CH3CN(0.3 mL), 40 ℃的条件下,90的收率,1.1:1的dr,86/90%的ee值(Entry 8)。
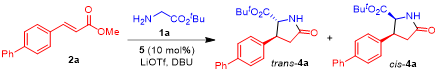
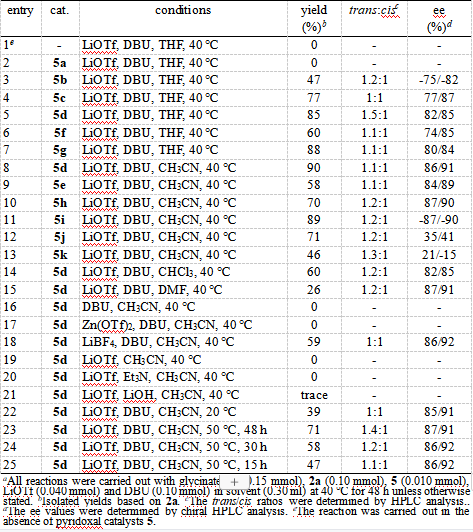
表1 反应条件筛选

图 2 催化剂筛选
在最佳反应条件下,作者对吡哆醛催化甘氨酸酯对映选择性合成焦谷氨酸酯进行了底物拓展(图 3)。苯基(对于4b)和各种取代苯基(对于4a,4c-m) α,β-不饱和酯均顺利地进行1,4-共轭加成和随后的内酰胺化,得到手性焦谷氨酸酯4a-m(优异产率,非对映选择性低,但对反式和顺式非对映异构体的对映选择性高)。而由于空间位阻的原因,导致4k和4I的产率较低。令人惊讶的是,取代苯基上的电子效应对反应几乎没有影响。萘基(对于4n)和杂芳基(对于4o-r)α,β-不饱和酯都是转化的有效底物,提供了相应的手性焦谷氨酸酯4n-r,产率为43-96%,选择性相似。对炔基和烷基α, β-不饱和酯进行转化,得到手性焦谷氨酸酯4s和4t,产率分别为45%和52%)。
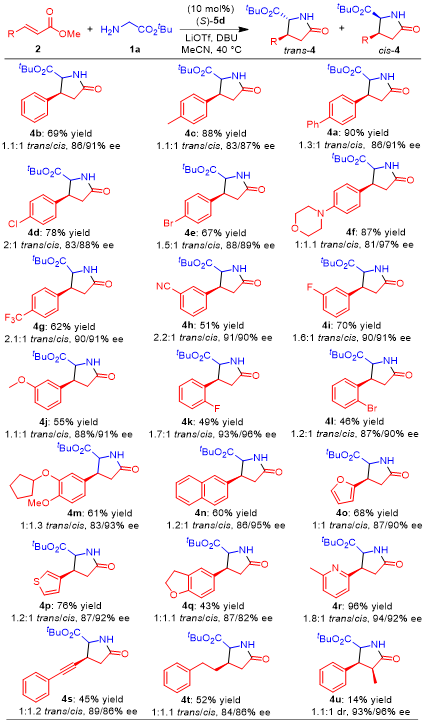
图 3 反应条件筛选
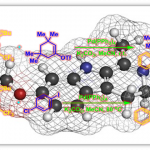
虽然精确的机理有待进一步研究,但是Zhao小组提出了一个合理的反应途径(图4a)。手性吡哆醛5d与甘氨酸酯1a缩合形成希夫碱612,其在酯的α位置被碱DBU脱质子12生成离域碳负离子713。中间体7与α,β-不饱和酯2进行不对称1,4-共轭加成反应,水解生成γ-氨基酯3,并再生吡哆醛催化剂5d,通过分子内环化反应原位转化为焦谷氨酸酯4。虽然这是一个较为合理的反应途径,但是LiOTf在反应中的作用并没有显示出来。因此为了进一步理解LiOTf的作用和手性的起源,Zhao小组对关键步骤,即中间体 7与α,β-不饱和酯2的不对称加成进行了计算研究。优化的过渡态8(图4b)所示,LiOTf与化合物2和中间体7配位,这不仅提高了α,β-不饱和酯的亲电性,而且以特定的空间排列将两种反应物结合在一起,加速了共轭加成。这一点得到了一个事实的支持,即没有路易斯酸添加剂,就无法获得所需的产品4。另一点则是:1)酰胺的N,N-丙基位于5d的吡啶环上方,用作刚性且大体积的基团,可封闭吡啶环的上侧;2)α,β-不饱和酯2从吡啶环的下方接近酰胺酸根阴离子,远离酰胺侧链,导致形成具有(2R,3S)构型的手性产物4; 3)与5d相比,带有酯侧链的吡哆醛5j表现出良好的催化活性,但对映选择性低得多,尽管酯基团与LiOTf的配位能力与5d的酰胺相似,计算表明酰胺与LiOTf并不配位,但为催化过程中的对映选择性控制提供空间屏蔽。基于实验数据和计算化学的研究,对于反应的机理和手性的起源有了很好的解释和理解。
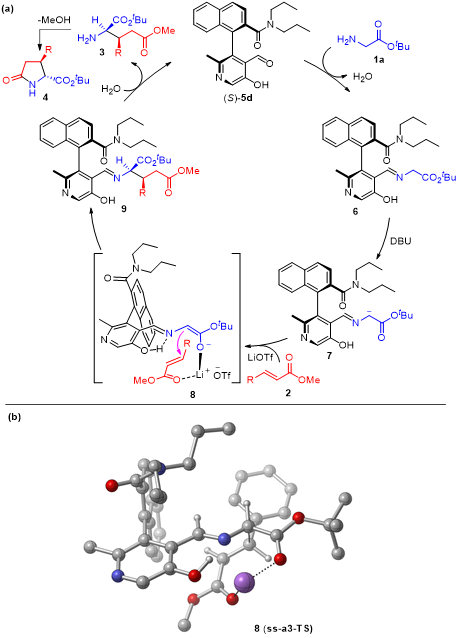
图 4 机理研究
通过反应机理的研究,对于理解反应的发生以及手性的起源有了更深的理解。但是对于反应中非对映选择性低的问题,还是不能很好地解释,基于此,作者进行了大胆的猜想,可能是由于α-H酸性为4,在碱性反应条件下反式和顺式异构体之间发生差向异构化,消除了反应中可能的高水平反式/顺式选择性。正如猜想的那样,对照实验表明,在标准反应条件下,两种异构体Trans–4a和Cis-4a确实可以相互转化(图 5 a,Entry 1-4)。在延长反应时间(144小时)后,从Trans–4a或Cis-4a开始的实验中(图5a,Entry 5-10),当仅存在碱基DBU并且获得类似的反式/顺式比率(3.0:1 vs 2.4:1)时,也发生差向异构化。反应过程中的差向异构化可能比吡哆醛催化的共轭加成更快,这一点得到了以下事实的支持:不同时间进行的反应产生不同的产率,但具有相似的反式/顺式比率和ee值(表1,Entry 23-25)。对于具有α-取代基的丙氨酸叔丁酯(1b),虽然具有明显更高的反式/顺式选择性(4.1:1)11(图5b),但以较低的产率(10 %)获得相应的2-甲基焦谷氨酸酯4v,支持不对称1,4-加成步骤的过渡状态(图 4)。
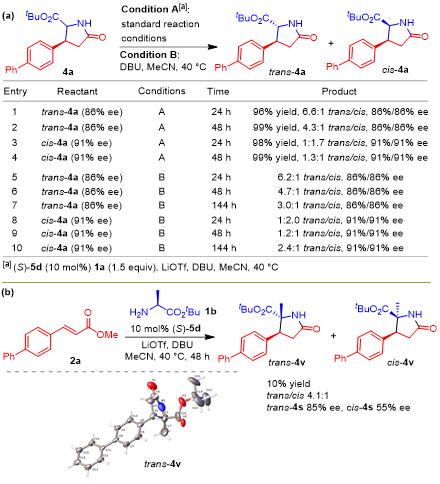
图 5非对映选择性的研究
对于反应有了透彻的研究之后,作者通过衍生化合成了焦谷氨酸11(图 6a)和具有治疗阿尔兹海默病 (Alzheimer’s disease )的药物(S)-Rolipram 1515(图 6b)。
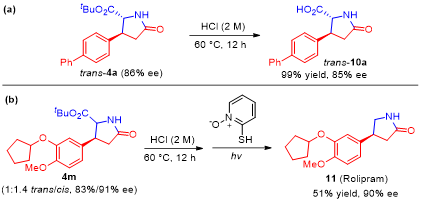
图 6衍生化
总之,赵宝国教授小组通过羰基催化策略成功地实现了α,β-不饱和酯对NH2-未保护的甘氨酸酯的直接不对称a-官能团化。 在手性吡哆醛催化剂5d的存在下,将α-位置的甘氨酸酯1a不对称地进行1,4-共轭加成到α,β-不饱和酯2上,然后原位内酰胺化,以14-96%的收率形成手性焦谷氨酸酯4(具有81-97%的对映选择性)。该法提供了一种有趣且高效的方法来制备具有化学和生物学意义的焦谷氨酸化合物以及吡哆醛结构在不对称催化中的神奇催化能力。
其他
羰基催化:是用羰基化合物(醛或酮)来催化伯胺的α-官能团化,实现由简单的伯胺一步合成各种重要的、结构更加复杂的胺类化合物。该过程不需要对胺的NH2基团进行相应的上保护和去保护操作,合成步骤短、高效并且原子经济。(具体介绍见赵宝国教授主页:http://ccms.shnu.edu.cn/71/15/c24493a684309/page.htm)
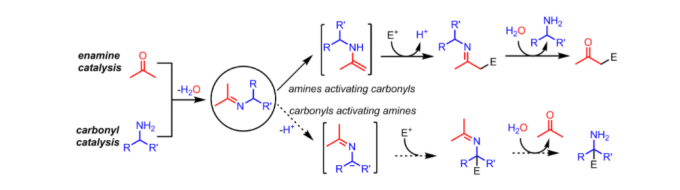
图7 羰基催化
参考文献
[1] a) J. Deng, B. Zhu, Z. Lu, H. Yu, A. Li, J. Am. Chem. Soc. 2012, 134, 920-923; b) M. Kikuchi, H. Konno, Org. Lett. 2014, 16, 4324-4327. c) S. Chu, S. Liu, W. Duan, Y. Cheng, X. Jiang, C. Zhu, K. Tang, R. Wang, L. Xu, X. Wang, X. Yu, K. Wu, Y. Wang, M. Wang, H. Huang, J. Zhang, Pharmacol. Ther. 2016, 162, 179-187; d) W. Fenical, P. R. Jensen, M. A. Palladino, K. S. Lam, G. K. Lloyd, B. C. Potts, Bioorg. Med. Chem. 2009, 17, 2175-2180. e) I. Speciale, F. Di Lorenzo, V. Gargiulo, G. Erbs, M.-A. Newman, A. Molinaro, C. De Castro, Angew. Chem. Int. Ed. 2020, 59, 6368-6374.
[2] a) H. Mandal, P. K. Ghosh, N. M. Biswas, J. Endocrinol. 1990, 126, 431-435; b) D. Gunn, C. Akuche, J. Baryza, M.-L. Blue, C. Brennan, A.-M. Campbell, S. Choi, J. Cook, P. Conrad, B. Dixon, J. Dumas, P. Ehrlich, T. Gane, T. Joe, J. Johnson, J. Jordan, R. Kramss, P. Liu, J. Levy, D. Lowe, I. McAlexander, R. Natero, A. M. Redman, W. Scott, T. Seng, R. Sibley, M. Wang, Y. Wang, J. Wood, Z. Zhang, Bioorg. Med. Chem. 2005, 15, 3053-3057; c) S. Hanessian, H. Yun, Y. Hou, G. Yang, M. Bayrakdarian, E. Therrien, N. Moitessier, S. Roggo, S. Veenstra, M. Tintelnot-Blomley, J.-M. Rondeau, C. Ostermeier, A. Strauss, P. Ramage, P. Paganetti, U. Neumann, C. Betschart, J. Med. Chem. 2005, 48, 5175-5190; d) S. Hanessian, H. Yun, Y. Hou, M. Tintelnot-Blomley, J. Org. Chem. 2005, 70, 6746-6756; e) J.-F. Hu, S.-F. Chu, N. Ning, Y.-H. Yuan, W. Xue, N.-H. Chen, J.-T. Zhang, Neurosci. Lett. 2010, 483, 78-82; f) S. Hong, M. Jung, Y. Park, M. W. Ha, C. Park, M. Lee, H.-g. Park, Chem. Eur. J. 2013, 19, 9599-9605; g) T. Mukaiyama, K. Ogata, I. Sato, Y. Hayashi, Chem. Eur. J. 2014, 20, 13583-13588; h) S. W. Wright, B. Li, Z. Peng, L. Wei, E. McInturff, D. Place, D. B. Damon, R. A. Singer, Org. Process Res. Dev. 2018, 22, 1835-1845.
[3] a) C. Nájera, M. Yus, Tetrahedron: Asymmetry 1999, 10, 2245-2303; b) S. K. Panday, J. Prasad, D. K. Dikshit, Tetrahedron: Asymmetry 2009, 20, 1581-1632.
[4] a) A. El Achqar, M. Boumzebra, M.-L. Roumestant, P. Viallefont, Tetrahedron 1988, 44, 5319-5332; b) S. Kanemasa, A. Tatsukawa, E. Wada, O. Tsuge, Chem. Lett. 1989, 18, 1301-1304; c) C. Alvarez-Ibarra, A. G. Csakye, M. Maroto, M. L. Quiroga, J. Org. Chem. 1995, 60, 6700-6705; d) P. Elsner, L. Bernardi, G. D. Salla, J. Overgaard, K. A. Jørgensen, J. Am. Chem. Soc. 2008, 130, 4897-4905; e) T. Tsubogo, S. Saito, K. Seki, Y. Yamashita, S. Kobayashi, J. Am. Chem. Soc. 2008, 130, 13321-13332; f) H.-L. Teng, F.-L. Luo, H.-Y. Tao, C.-J. Wang, Org. Lett. 2011, 13, 5600-5603; g) J. Hernández-Toribio, R. G. Arrayás, J. C. Carretero, Chem. Eur. J. 2011, 17, 6334-6337; h) Y.-F. Liang, C.-C. Chung, D.-J. Liao, W.-J. Lee, Y.-W. Tu, B.-J. Uang, J. Org. Chem. 2018, 83, 10564-10572; i) T. M. Khopade, P. K. Warghude, A. D. Sonawane, R. G. Bhat, Org. Biomol. Chem. 2019, 17, 561-566.
[5] a) S. Saito, T. Tsubogo, S. Kobayashi, J. Am. Chem. Soc. 2007, 129, 5364-5365; b) M. Strohmeier, K. Leach, M. A. Zajac, Angew. Chem. Int. Ed. 2011, 50, 12335-12338; c) T. Ma, X. Fu, C. W. Kee, L. Zong, Y. Pan, K.-W. Huang, C.-H. Tan, J. Am. Chem. Soc. 2011, 133, 2828-2831; d) Z.-Y. Xue, Q.-H. Li, H.-Y. Tao, C.-J. Wang, J. Am. Chem. Soc. 2011, 133, 11757-11765; e) H. Y. Kim, J.-Y. Li, S. Kim, K. Oh, J. Am. Chem. Soc. 2011, 133, 20750-20753; f) Y.-H. Shi, Z. Wang, B. Hu, M. Wang, J. S. Fossey, W.-P. Deng, Org. Lett. 2011, 13, 6010-6013; g) J. S. Bandar, T. H. Lambert, J. Am. Chem. Soc. 2012, 134, 5552-5555; h) J. Nie, M.-Q. Hua, H.-Y. Xiong, Y. Zheng, J.-A. Ma, J. Org. Chem. 2012, 77, 4209-4216; i) K. Imae, T. Konno, K. Ogata, S.-i. Fukuzawa, Org. Lett. 2012, 14, 4410-4413.
[6] a) V. A. Soloshonok, C. Cai, V. J. Hruby, Angew. Chem. Int. Ed. 2000, 39, 2172-2175; b) V. A. Soloshonok, C. Cai, V. J. Hruby, Org. Lett. 2000, 2, 747-750; c) V. A. Soloshonok, C. Cai, V. J. Hruby, Tetrahedron Lett. 2000, 41, 135-139; d) V. A. Soloshonok, C. Cai, V. J. Hruby, L. V. Meervelt, T. Yamazaki, J. Org. Chem. 2000, 65, 6688-6696; e) C. Cai, V. A. Soloshonok, V. J. Hruby, J. Org. Chem. 2001, 66, 1339-1350; f) V. A. Soloshonok, H. Ueki, R. Tiwari, C. Cai, V. J. Hruby, J. Org. Chem. 2004, 69, 4984-4990; g) V. A. Soloshonok, C. Cai, T. Yamada, H. Ueki, Y. Ohfune, V. J. Hruby, J. Am. Chem. Soc. 2005, 127, 15296-15303; h) T. Yamada, K. Sakaguchi, T. Shinada, Y. Ohfune, V. A. Soloshonok, Tetrahedron: Asymmetry 2008, 19, 2789-2795; i) M. Bergagnini, K. Fukushi, J. Han, N. Shibata, C. Roussel, T. K. Ellis, J. L. Aceña, V. A. Soloshonok, Org. Biomol. Chem. 2014, 12, 1278-1291.
[7] a) S. Li, X.-Y. Chen, D. Enders, Chem 2018, 4, 2026-2028; b) Q. Wang, Q. Gu, S.-L. You, Angew. Chem. Int. Ed. 2019, 58, 6818-6825; c) L.-Z. Gong, Sci. China Chem. 2019, 62, 3-4.
[8] a) J. Chen, X. Gong, J. Li, Y. Li, J. Ma, C. Hou, G. Zhao, W. Yuan, B. Zhao, Science 2018, 360, 1438-1442; b) J. Chen, Y. E. Liu, X. Gong, L. Shi, B. Zhao, Chin. J. Chem. 2019, 37, 103-112.
[9] a) B. Xu, L.-L. Shi, Y.-Z. Zhang, Z.-J. Wu, L.-N. Fu, C.-Q. Luo, L.-X. Zhang, Y.-G. Peng, Q.-X. Guo, Chem. Sci. 2014, 5, 1988-1991; b) W. Wen, L. Chen, M.-J. Luo, Y. Zhang, Y.-C. Chen, Q. Ouyang, Q.-X. Guo, J. Am. Chem. Soc. 2018, 140, 9774-9780; c) L. Chen, M.-J. Luo, F. Zhu, W. Wen, Q.-X. Guo, J. Am. Chem. Soc. 2019, 141, 5159-5163.
[10] a) L. Shi, C. Tao, Q. Yang, Y. E. Liu, J. Chen, J. Chen, J. Tian, F. Liu, B. Li, Y. Du, B. Zhao, Org. Lett. 2015, 17, 5784-5787; b) Y. E. Liu, Z. Lu, B. Li, J. Tian, F. Liu, J. Zhao, C. Hou, Y. Li, L. Niu, B. Zhao, J. Am. Chem. Soc. 2016, 138, 10730-10733; c) X. Lan, C. Tao, X. Liu, A. Zhang, B. Zhao, Org. Lett. 2016, 18, 3658-3661.
[11] a) K. Toth, J. P. Richard, J. Am. Chem. Soc. 2007, 129, 3013-3021; b) J. Crugeiras, A. Rios, E. Riveiros, T. L. Amyes, J. P. Richard, J. Am. Chem. Soc. 2008, 130, 2041-2050; c) J. Crugeiras, A. Rios, E. Riveiros, J. P. Richard, J. Am. Chem. Soc. 2011, 133, 3173-3183.
[12] a) S. Tang, X. Zhang, J. Sun, D. Niu, J. J. Chruma, Chem. Rev. 2018, 118, 10393-10457; b) W.-W. Chen, B. Zhao, Synlett 2020, 31, 1543-1550.
[13] a) A. Diaz, J. G. Siro, J. L. García-Navío, J. J. Vaquero, J. Alvarez-Builla, Synthesis 1997, 1997, 559-562; b) M.-Y. Chang, P.-P. Sun, S.-T. Chen, N.-C. Chang, Tetrahedron Lett. 2003, 44, 5271-5273.
[14] a) N. Sommer, P.-A. Löschmann, G. H. Northoff, M. Weller, A. Steinbrecher, J. P. Steinbach, R. Lichtenfels, R. Meyermann, A. Riethmüller, A. Fontana, J. Dichgans, R. Martin, Nat. Med. 1995, 1, 244-248. b) S. J. Kanes, J. Tokarczyk, S. J. Siegel, W. Bilker, T. Abel, M. P. Kelly, Neuroscience 2007, 144, 239-246.
[15] a) M. D. Toney, Arch. Biochem. Biophys. 2005, 433, 279-287; b) R. Breslow, Acc. Chem. Res. 1995, 28, 146-153; c) Y. Murakami, J.-i. Kikuchi, Y. Hisaeda, O. Hayashida, Chem. Rev. 1996, 96, 721-758; d) Y. Xie, H. Pan, M. Liu, X. Xiao, Y. Shi, Chem. Soc. Rev. 2015, 44, 1740-1748.


























No comments yet.