本文来自日文版Chem-Station,投稿翻译作者张寻
本次,我将以高中有机化学中出现的酯化反应为中心,为大家讲解反应的机理。通过文章对反应过程细致的分析,你将能理解为什么酯化反应需要酸催化剂,同时也能理解为什么酯化反应是一个可逆反应。文章最后会举几个缩合反应的例子,例如阿司匹林和常见酯类物质的合成。
同时,本次我会从大学本科生的知识层次来讲述这个在高中化学出现的反应。虽然文章主要针对大学生阅读者,但我写这篇文章,也怀着想要高中生拓展一下知识的想法。如果文章有难以理解的地方,请在评论区不吝评论。
酯化反应的两个疑问
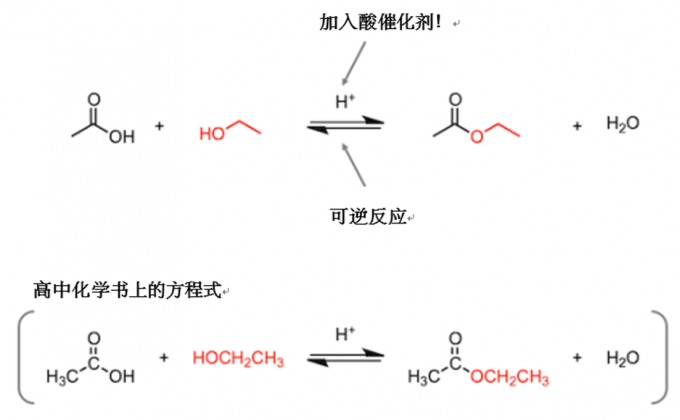
好,我们进入正题。首先我们从酸催化条件下乙醇和乙酸生成乙酸乙酯的反应入手。
注:高中生阅读者可能会有疑问:“方程式里面那些曲曲折折的构造式是什么?”。为了照顾你们的心情,我在下面用高中化学常用的构造式重新写了一个方程式。那些曲曲折折的构造式,叫做键线式。用键线式表示分子的时候,线的每个拐角和端点都代表一个碳原子,同时省略了氢原子。接下来的内容中,我会继续使用键线式来书写,因为这样会使表达更加清晰,看起来也比较容易,不会造成不必要的麻烦。
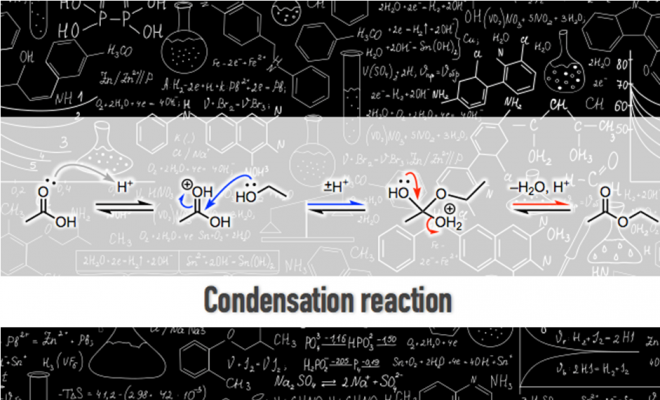
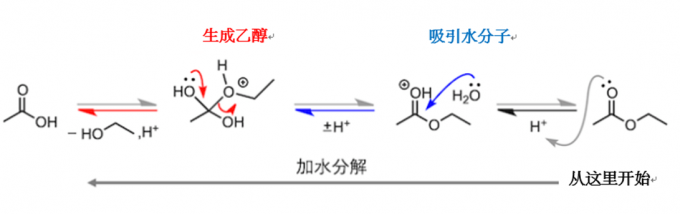
我们来看一下反应的方程式,反应物乙醇中的CH3CH2O基(标红的位置)占据了羧酸中羟基的位置,生成了副产物水。接下来我们看一下方程式中除反应物和生成物之外的部分。在反应物和生成物之间,有一个表示可逆反应的箭头。在箭头的上面,写着H+ ,表示反应中使用了酸催化剂。在科普讲座的时候,一般很少会讲 “酸催化剂是在哪里起作用的”和“为什么是可逆反应”这两个问题,因为对于学习者来说,问题的答案不太容易记住。但是,在进行相关实验研究时,这两个问题就不能忽略了,花点功夫去搞明白还是很有必要的。
为了理解这两个疑问,深入地理解分子的变化,我们对反应机理的每个阶段逐个来进行分析。(所谓的反应机理,简单来说就是用电子的运动来表达某个反应的发生过程)
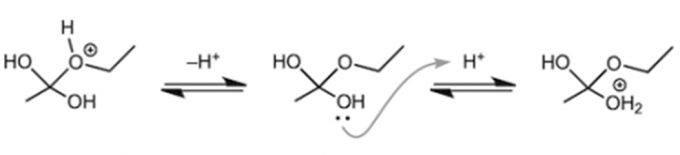
第一阶段质子化的乙酸吸引乙醇
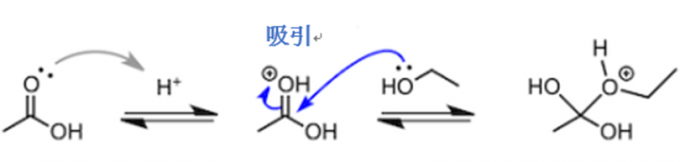
首先,酸催化剂中的氢离子(质子)与羰基中氧原子的非共用电子对结合。接着,带正电荷的羰基吸引乙醇中氧原子的非共用电子对。这时,碳氧双键中的π电子向羰基中的氧原子移动,乙醇中的氧原子与羰基中的碳元素碰撞结合。
小插曲:酸催化剂在哪里起作用呢?”(1)
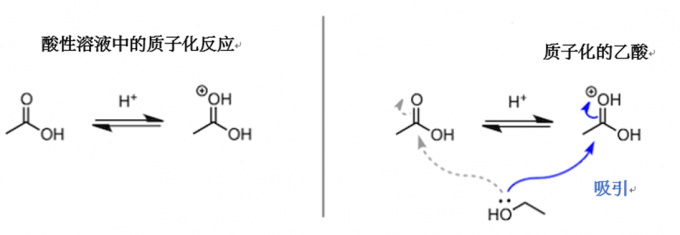
先不继续说了。虽然说接着讲下去也行,但我们还是稍微停一下,先看看我们之前提出的第一个问题“酸催化剂在哪里起作用呢”的答案。通过上面的说明,我们大概可以明白“在乙醇攻击乙酸之前,乙酸的羰基需要被质子化”。但有一件事不要理解错了,羰基之后才会被酯化,它们奋力地向前迈步,并非是想要和质子结合。也就是说,获得质子的反应是一个可逆反应,会迅速在酸性溶液中达到平衡状态。所以与其说“第一阶段羰基的质子化”,不如使用“反应溶液里虽然有没有质子化的乙酸分子,乙醇仍然会被那些质子化带正电荷的羰基吸引”这样的说法更加妥当。
那么会有人吐槽,“为什么乙醇不去直接攻击带正电荷的羰基氧原子呢”,这是因为原子的电负性。也就是说,对于氧原子和碳原子,氧原子的电负性要大很多,π电子因此就会向氧原子的位置移动,所以乙醇就会选择去攻击碳原子。
让我们回到酯化反应的机理。
第二阶段质子移动
受到乙醇攻击的乙酸中,来自乙醇的氧原子伸出三只手,且带着正电荷,然后释放出一个质子,形成中性的分子。接着,质子又与羟基中的孤电子对(非共用电子对)结合,带上了正电荷。
这样看来,为什么要一个没有用的质子呢?这里就要注意了,现在即将要发生反应的众多分子,还没有意识到自己即将被酯化,与质子结合仅仅是普通的酸碱反应而已。反应在溶液中不断地来回进行。不过要质子移动的目的,需要等到下个阶段的反应发生。
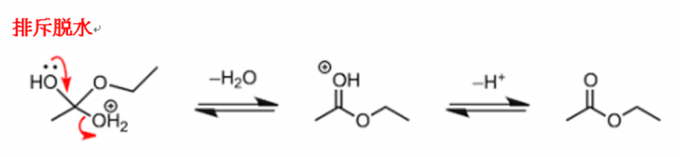
第三阶段脱水
随着反应持续的持续进行,氧元素的孤对电子不断排斥碳元素上的水,使得水从碳元素上脱落。最后,氧原子失去了质子,乙酸乙酯就这样生成了。
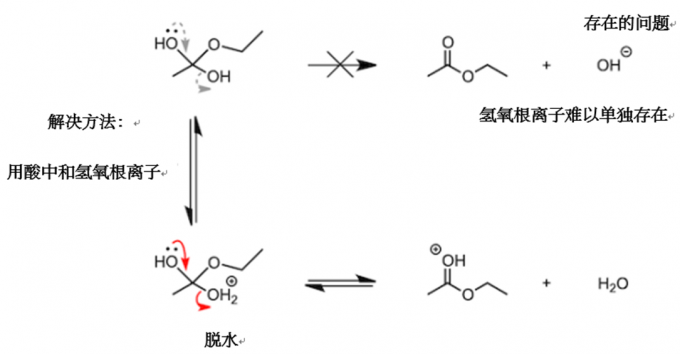
小插曲:酸催化剂在哪里起作用呢?(2)
在这里,我将对这个问题做进一步解答。前面我们讲到,在质子移动阶段,生成了一个中性的中间体。这样的话,为什么中间体不直接脱下来一个氢氧根离子呢?这就需要我们开动脑筋。要说为什么,那是因为氢氧根是一个反应活性很高的碱性离子,不能独立存在。因此,氢氧根会被中和为性质稳定的水分子,这便是酸催化剂的第二个作用。(使用图像可以更容易理解上述说明,但要注意严谨性。在这里我们借用大学级别的术语,“离去基团的pKaH(离去基团所在的酸的酸度系数)越低,离去基团就越容易脱离”)
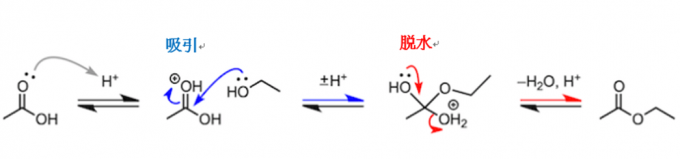
反应机理总结:吸引、脱去
我们在这里总结一下这一连续的反应过程。酯化反应步骤很多,十分复杂。在质子移动阶段,使用“±H+”这样比较简单的描述,从而可以更清晰地理解反应的本质。所谓反应的本质,就是:(1)质子化的羰基吸引乙醇分子(2)因氧原子的非共用电子对的排斥,发生了脱水反应
小插曲:为什么是可逆反应?
我们已经讲完了反应机理。但是还没有解决可逆反应的问题。生成的酯,可以按照同样的路径,重新变回羧酸。前文不断强调,反应中的分子并没有“我一定要变成酯”的强烈愿望。同样,生成的酯也没有“我就是最终产物了,反应圆满达成了”这样的强烈主张。也就是说,酯也会有发生反应的可能。具体的反应平衡,根据酸催化剂的不同而不同。如果在反应中有水存在,被质子化的酯会吸引水分子。然后,随着质子的移动,乙醇就会产生了。
本文并没有详细描述具体的实验方法,为了能够让酯化反应更有效率地进行,一般会用Dean–Stark装置来除去反应中生成的水,或者用加入过量乙醇等方法
俯瞰缩合反应
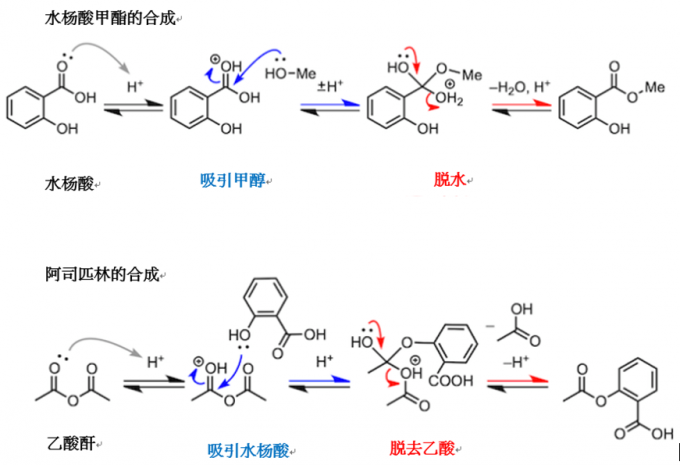
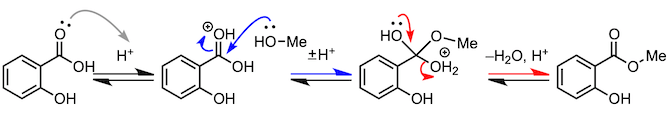
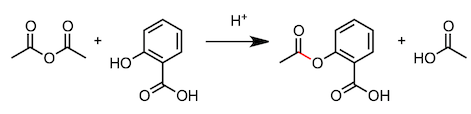
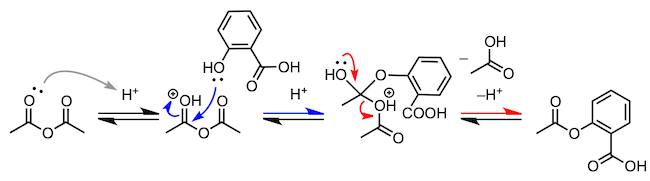
最后,我们来看一下包括酯化反应的缩合反应。首先,为了照顾高中生阅读者,我们举几个简单的例子,比如消炎镇痛剂中所含有的水杨酸甲酯的合成。反应使用水杨酸作为羧酸,醇类则使用甲醇。这个反应也是酯化反应,就不多说了吧。但是,阿司匹林的合成又是怎么回事呢。这个反应使用乙酸酐的羰基,吸引水杨酸中的羟基,然后脱去一分子乙酸。到此为止的例子虽然都是从羧酸中脱去水分子的反应,但缩合反应不只存在于羧酸。通过“吸引、脱出”的机理,很多反应都可以进行。
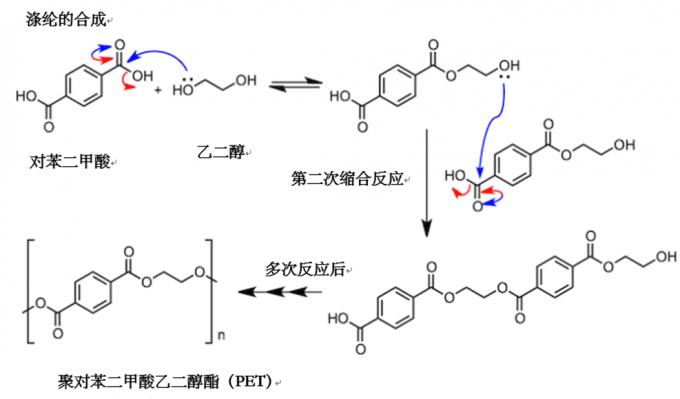
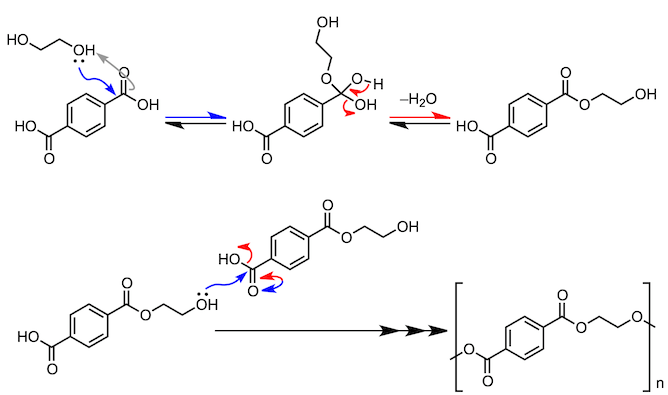
接下来,让我们关注一下身边的酯化反应。合成纤维中涤纶的合成,就与今天所讲的酯化反应有关。如下图所示,反应使用包含两个羧基的对苯二甲酸和包含两个羟基的乙二醇。通过缩合反应,分子形成一个长链,从而生成聚对苯二甲酸乙二醇酯(PET)。我查了一下化学书,这个缩合反应没有使用酸催化剂,并且反应需要在200℃的条件下进行。
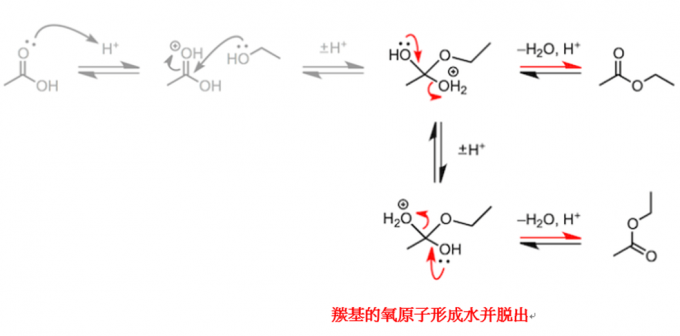
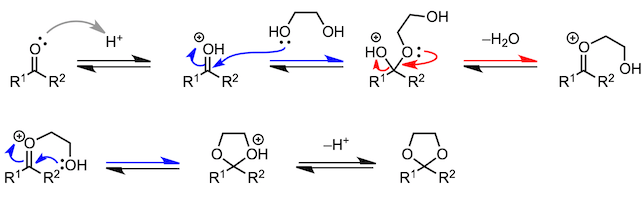
这样的反应不胜枚举。接下来我们介绍几个本科水平的化学反应。为此我们要做一个热身,让我们再次思考一下酯化反应的反应机理,在脱水之前形成的中间体,含有两个羟基。现在,羧酸最初持有的羟基发生了质子化反应,请写一下反应的方程式。但是从本质上来说,两个羟基不论是哪个随水分子脱离,结果都是一样的。也就是说,像下面的反应方程式一样,由羰基上的氧元素形成的羟基随水分子脱离也是可以的。
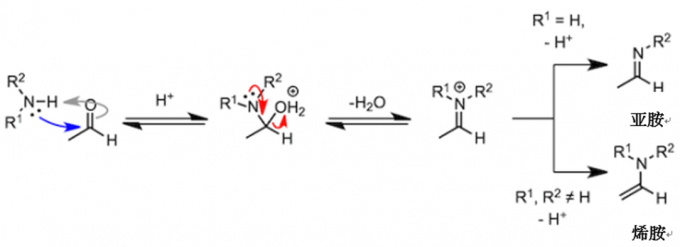
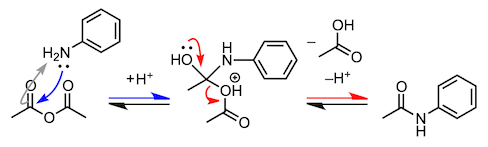
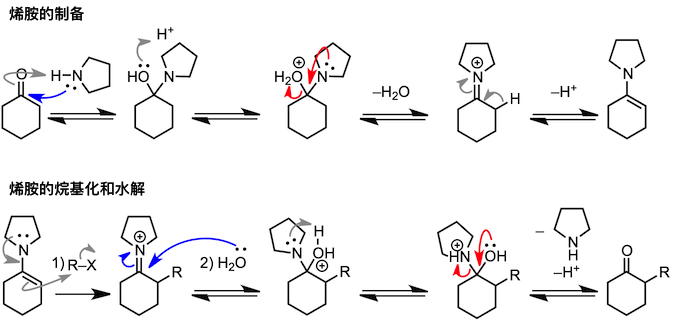
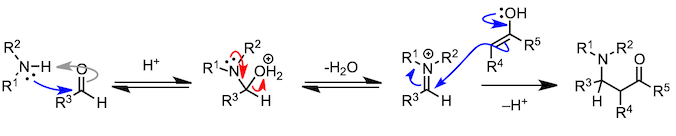
其实拥有羟基的不只是羧酸,其他的羰基化合物也有可能发生氧原子变成水分子脱去的缩合反应。在介绍醛和酮缩合生成胺的反应的时候,我也会举合成亚胺和烯胺的例子。但与我们前面所讲的反应不同,胺比乙醇的亲核性要高,而且在反应第一阶段不需要酸催化剂。不过,在脱水阶段,为了使羟基发生质子化,从而增加脱水能力,反应需要在弱酸条件下进行。
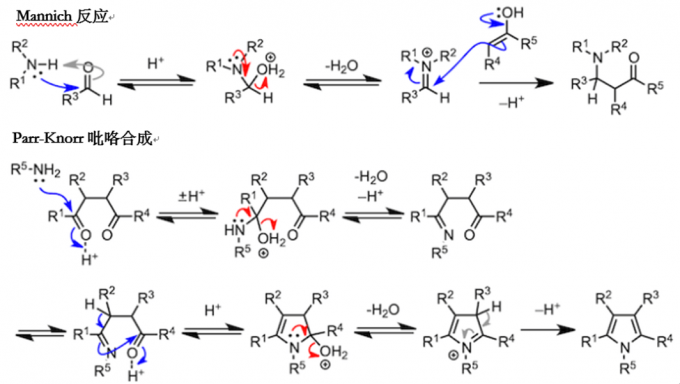
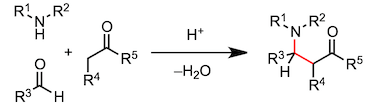
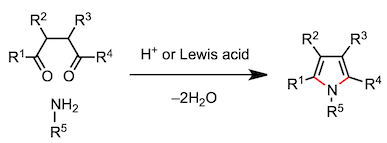
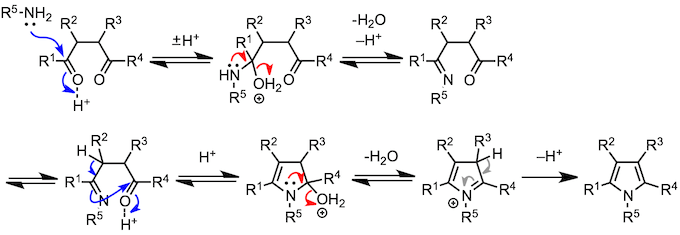
下面的反应是由3个反应物的缩合反应和杂环合成反应组成的。让我来一个个介绍。脱水时生成的亚胺离子吸引第三个反应物,发生多成分缩合反应(Mannich 反应)。另一方面,胺与1,4-二羰基化合物反应,在第一个缩合反应进行时,分子内也在进行着另一个缩合反应,最终生成吡咯(Paar-Knorr 吡咯合成)
以上述反应为例子,这次我们讲解了以酯化反应为代表的缩合反应,并且介绍了以此为机理的各种反应。因为文章讲的内容比较基础,于是就因此被放在了在化学空间网站里的有机反合成应百科专栏。本次我们以高中化学里的有机化学反应为中心所介绍的反应机理,到此结束。
附录:常见缩合反应
2、水杨酸甲酯的合成
3、水杨酸的乙酰化(合成阿司匹林)
4、苯胺的乙酰化(乙酰苯胺的合成)
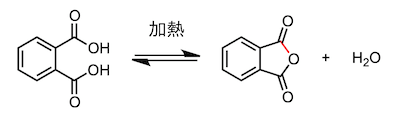
5、邻苯二甲酸的脱水
6、涤纶的合成(PET的合成)
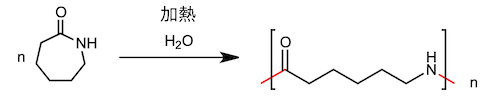
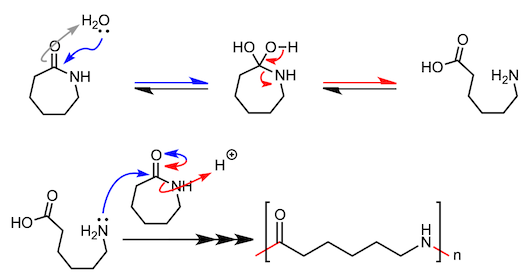
7、尼龙的合成
8、羰基的保护(乙缩醛化)
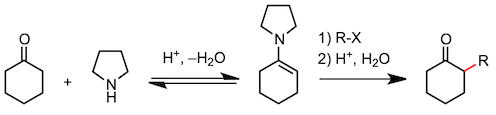
9、Stark烯胺合成
10、Mannich 反应
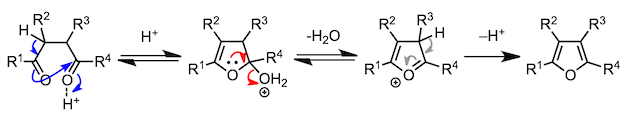
12、Paar-Knorr呋喃合成
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


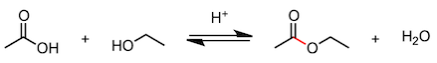

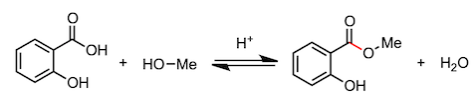






















No comments yet.