本文作者:有机小白
导读
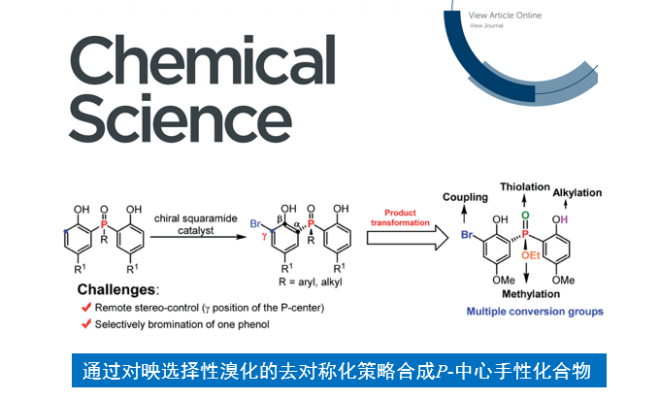
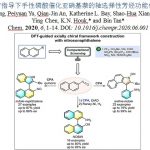
近日,南开大学化学学院与元素有机国家重点实验室李鑫教授团队在Chemical Science上发表论文,报道了在手性方酰胺催化下,使用一种新型高效的邻位选择性溴化的去对称化策略,以良好至优异的收率(up to 92%)和对映选择性(up to 98.5:1.5 e.r.)合成了一系列手性二苯酚磷氧化物和二苯酚磷酸酯的工作。该反应可进行放大,产物转化与应用实验证明了P-中心手性化合物的实用性。
Access to P-stereogenic compounds via desymmetrizing enantioselective bromination
Qiu-Hong Huang, Qian-Yi Zhou, Chen Yang, Li Chen, Jin-Pei Cheng and Xin Li*
Chem. Sci. 2021, ASAP. DOI: 10.1039/d0sc07008d
正文
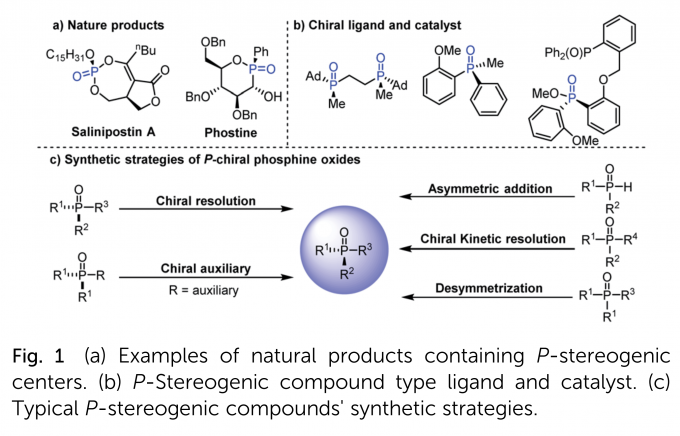
P-中心手性化合物是一类优异的结构,广泛存在于天然产物、药物以及生物活性分子中(Fig. 1a)。另外,由于手性磷原子靠近催化中心,可以造成显著的手性诱导,因而它们还可以发展为手性催化剂和配体(Fig. 1b)。因此,发展高效的方法合成具有新型骨架和官能团的P-中心手性化合物具有重要意义。合成P-中心手性化合物的传统方法主要是化学拆分和利用手性辅基诱导,需要消耗化学计量的手性试剂。相比之下,不对称催化策略,包括二炔基、二烯基、二芳基和二苯酚磷氧化物的去对称化,三级磷氧化物的(动态)动力学拆分以及二级磷氧化物的不对称反应,均可以有效地解决上述问题,是一类最直接、高效地构筑P-中心手性化合物的方法(Fig. 1c)。其中,关于有机催化的去对称化策略的报道还很少,且反应位点局限于二苯酚磷氧化物的羟基,产物后续转化困难。所以,发展高效的有机催化去对称化策略合成含有多个合成转化位点的P-中心手性化合物是迫切需要的。
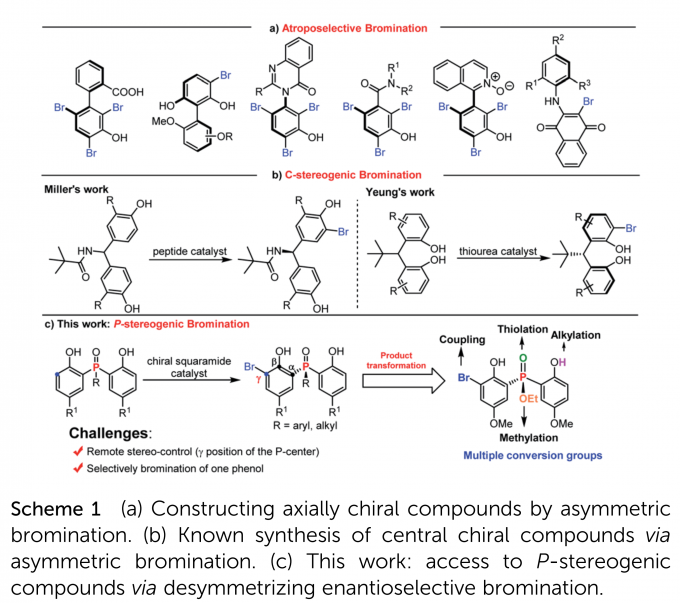
另外,不对称溴化是一类重要的合成手性化合物的方法,而芳环上的亲电溴化在合成各类轴手性化合物方面已经大展身手(Scheme 1a)。相比之下,通过苯酚溴化的去对称化策略构筑中心手性化合物仍是具有挑战性的,仅有Miller课题组和Yeung课题组进行了相关报道(Scheme 1b)。但是,迄今为止还没有使用不对称溴化的去对称化策略合成P-中心手性化合物的报道。
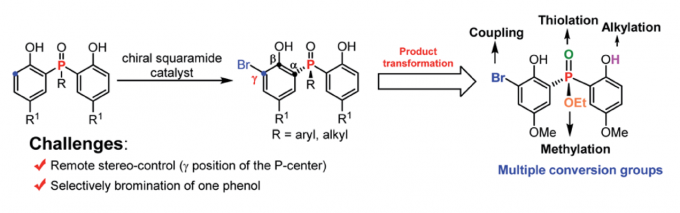
基于以上考虑,作者认为二苯酚磷氧化物和二苯酚磷酸酯是非常适用于不对称溴化去对称化构筑P-中心手性的底物,主要是因为:(1)富电子苯酚邻位易于发生亲电溴化反应;(2)溴化产物含有多个合成转化位点,如溴、羟基、烷氧基、磷原子等。要实现该目标,也需要克服两个主要的挑战:(1)找到一种合适的催化剂实现远程的手性控制;(2)需要抑制双溴化副产物的形成。
在此,南开大学化学学院与元素有机国家重点实验室李鑫教授团队报道了手性方酰胺催化下,利用邻位溴化反应,以高收率和对映选择性构筑了一系列手性二苯酚磷氧化物和二苯酚磷酸酯,且产物含有多个转化位点(Scheme 1c)。
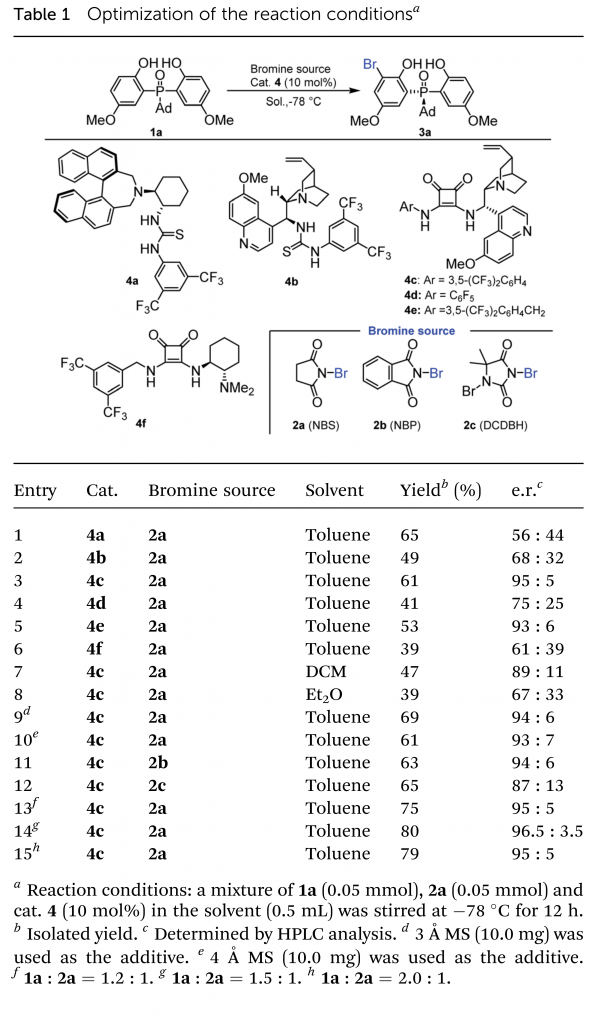
首先,作者选择二(2-羟基苯酚)磷氧化物1a和溴化试剂NBS 2a作为模板底物,进行了反应条件的优化(Table 1)。最优条件确定为:1a:2a = 1.5:1,手性方酰胺4c(10 mol%)作为催化剂,甲苯为溶剂,在-78 °C反应12 h,以80%的收率和96.5:3.5 e.r.得到目标产物3a(entry 14)。
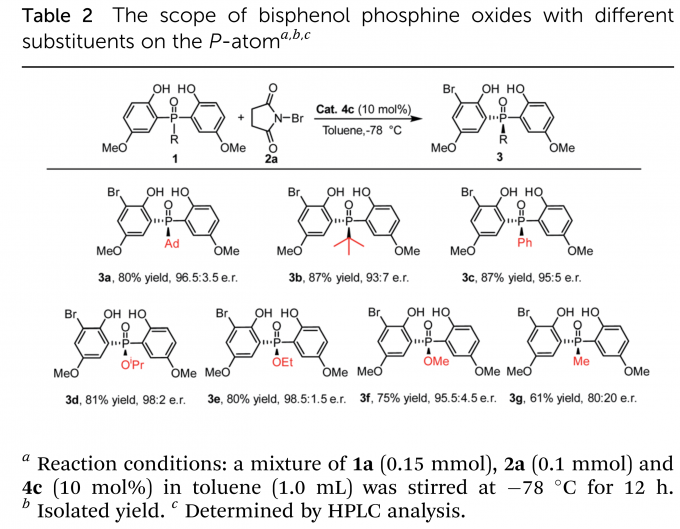
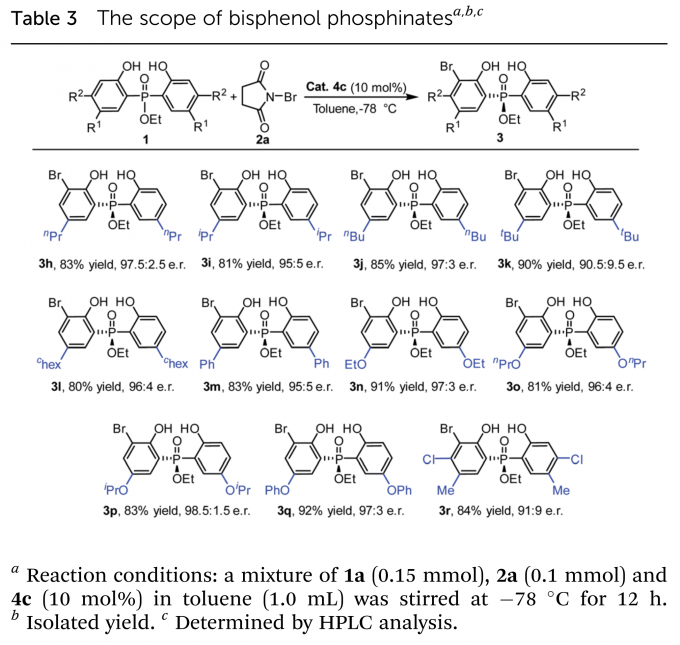
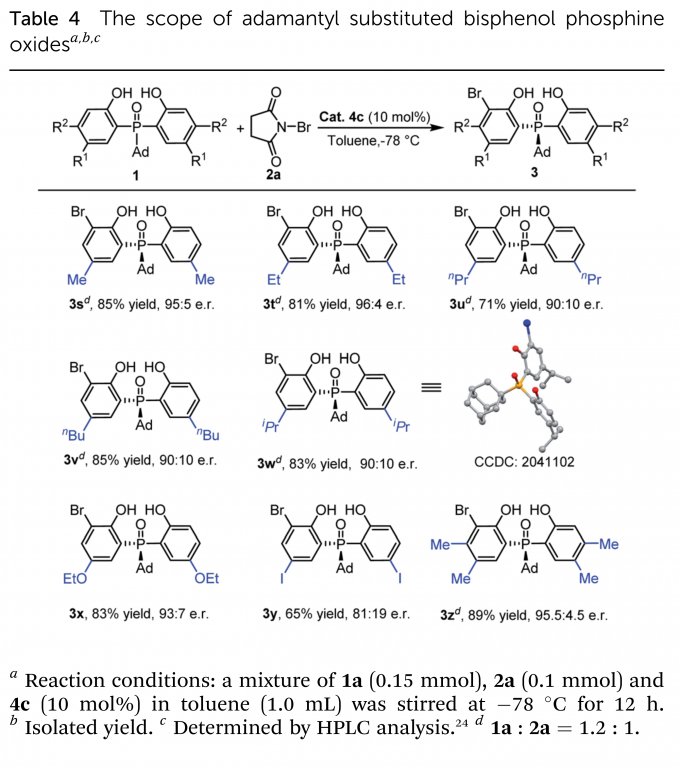
在最优条件下,作者进行了底物拓展。首先考察了中心P原子上的取代基(Table 2),大小不同的芳基、烷基取代的磷氧化物和磷酸酯均得到了良好的收率(up to 87%)与高对映选择性(up to 98.5:1.5 e.r.)。仅有当取代基为甲基时,反应收率与对映选择性处于中等水平。之后,作者又考察了乙氧基取代磷酸酯(Table 3)、金刚烷基取代磷氧化物(Table 4)的苯环上取代基的影响。烷基、烷氧基、芳基均具有良好的兼容性。当磷氧化物的苯环上5-位取代基体积增大时,相应产物(3v–3y)的对映选择性稍有下降。
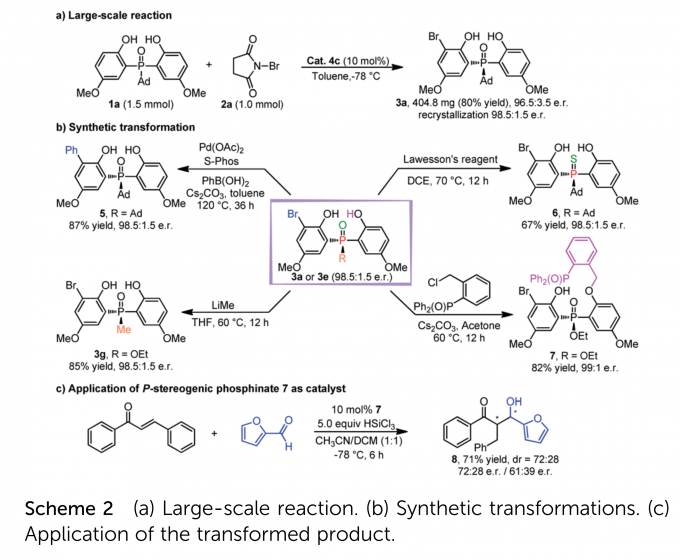
作者进行了放大实验(Scheme 2a),收率与对映选择性得到保持,证明了该策略的实用性。之后又进行了产物3a/3e的转化实验(Scheme 2b),且3e转化的产物7可作为手性双齿Lewis碱应用于反式查尔酮与糠醛的不对称反应,以中等的立体选择性得到了目标产物(Scheme 2c)。
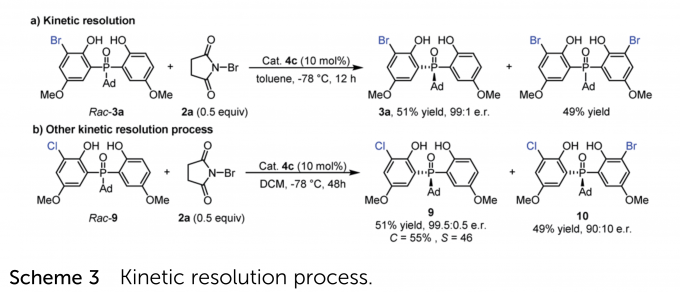
如Scheme 3a所示,作者利用rac–3a进行第二次溴化(rac–3a:2a = 2:1),以51%收率和99:1 e.r回收了单溴化产物3a,同时形成了49%的双溴化产物。该结果说明第二次溴化是一个动力学拆分过程,且对于对映选择性有正向的影响。作者又利用rac–9进行了动力学拆分,结果也非常优异(Scheme 3b)。
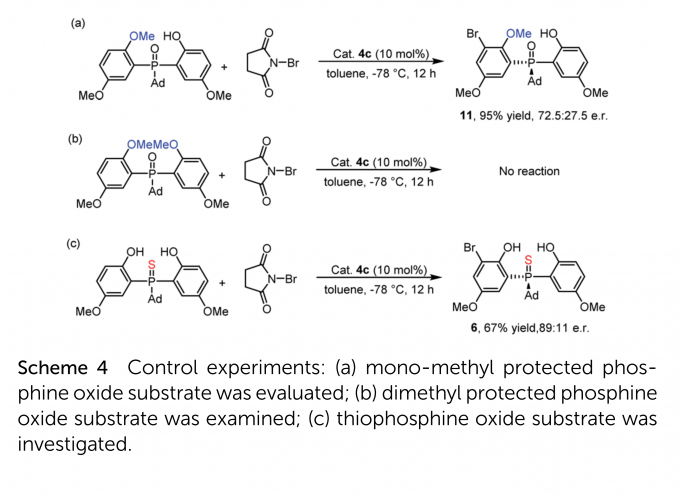
为了探究反应机理,作者进行了控制实验。首先,当二苯酚中的一个羟基被甲基保护后,对映选择性大幅降低(Scheme 4a)。而当两个羟基均被保护后,反应无法进行(Scheme 4b)。以上结果说明底物中的苯酚结构对于溴化反应至关重要。在3w的单晶结构中,可以观察到两个酚羟基与P=O之间形成氢键;而当P=O变为P=S后,氢键被削弱,收率和e.r.值均降低。这些结果说明了底物的分子内氢键有益于增强反应活性与对映选择性。基于以上讨论,作者提出了两种可能的机理(见electronic supplementary information)。
总结
南开大学化学学院与元素有机国家重点实验室李鑫教授团队报道了在手性方酰胺催化下,使用一种新型高效的邻位选择性溴化的去对称化策略,以良好至优异的收率和对映选择性合成了一系列手性二苯酚磷氧化物和二苯酚磷酸酯的工作。该反应可进行放大,产物转化与应用实验也证明了P-中心手性化合物的实用性。文章第一作者是南开大学博士研究生黄秋红,该研究工作也献礼南开大学化学学科成立100周年。














No comments yet.