本文作者:杉杉
导读
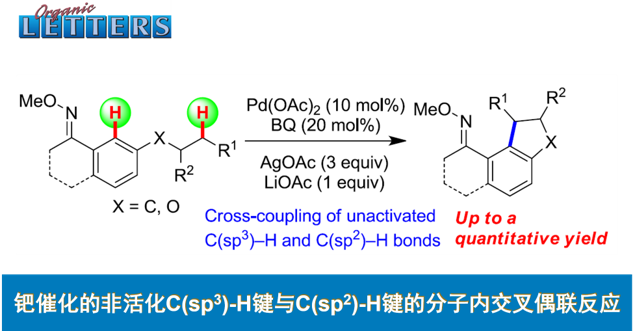
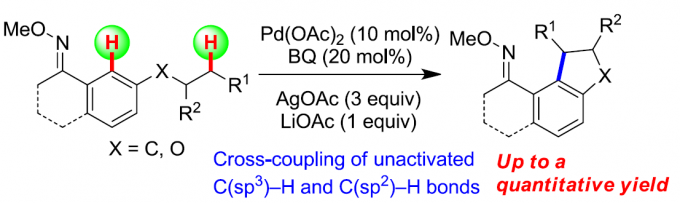
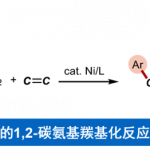
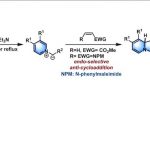
C-H/C-H键的直接偶联反应方法学为构建C-C键的一种十分高效的合成设计策略。然而,实现非活化的C(sp3)-H以及C(sp2)-H键之间的交叉偶联过程则面临巨大挑战。近日,同济大学的张扬会教授课题组在Org. Lett.中发表论文,报道一种采用钯催化剂促进的非活化C(sp3)-H与C(sp2)-H键之间的分子内交叉偶联反应方法学,进而成功完成一系列二氢苯并呋喃与茚满分子的构建。同时,反应过程中涉及O-甲基肟导向的芳基C(sp2)-H键活化以及烷基C(sp3)-H键的断裂,进而形成较为关键的C(sp2),C(sp3)-环钯中间体。
Palladium-Catalyzed Intramolecular Cross-Coupling of Unactivated C(sp3)-H and C(sp2)-H Bonds
Z. Wu, Z. Wu, X. Sun, W. Qi, Z. Zhang, Y. Zhang, Org. Lett. ASAP. doi: 10.1021/acs.orglett.1c02567.
正文
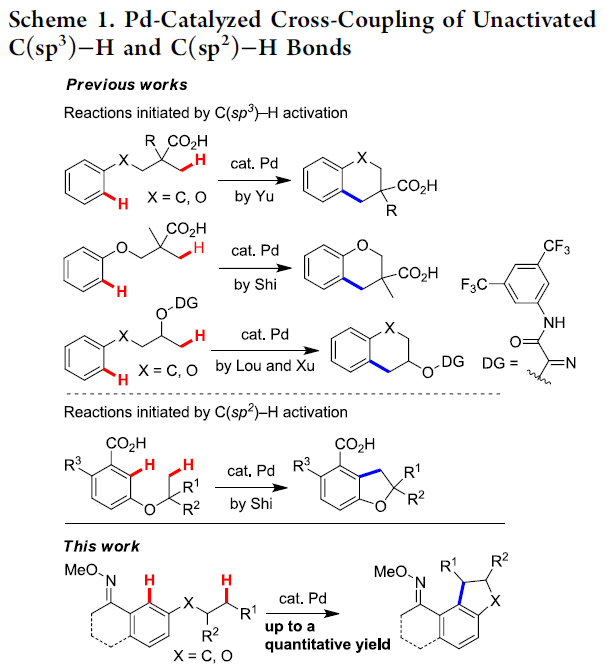
在过去的几十年中,过渡金属催化的C-H官能团化反应方法学作为有机合成化学领域的研究热点,一直以来备受广泛关注。与传统的依赖于有机分子中反应活性官能团参与的合成转化策略相比, C-H键的直接官能团化反应方法学能够通过有机分子中普遍存在的C-H键,较为高效地设计出一系列相关的反应策略,进而有效地避免相关底物的预官能团化步骤。因此,具有高度的原子与步骤经济性。目前,已经成功开发出多种通过C-H官能团化策略进行的合成转化过程,并顺利实现一系列不同类型的碳-碳与碳-杂原子键的构建。然而,在已有的C-H键官能团化反应策略中,通常仅涉及一种C-H键与一种预官能团化底物之间的偶联过程。而两种C-H键之间的直接偶联反应,即交叉脱氢偶联反应 (cross dehydrogenative coupling, CDC)方法学,则是一种更为行之有效的偶联策略。然而,在CDC反应过程中,却需要同时进行两种不同类型C-H键的活化,因此,CDC反应方法学的研究将面临更多的挑战。然而,CDC反应方法学的相关研究,目前已经取得诸多进展[1]。其中,在采用过渡金属催化的CDC反应方法学的文献报道中,通常涉及两种不同C(sp2)-H键之间的偶联过程[2]。同时,合成化学家已经成功设计出C(sp2)-H/C(sp3)-H键的交叉偶联反应方法学。然而,在偶联过程中,却需要选择活化的C(sp3)-H键[3] (主要涉及苄基C(sp3)-H键)或采用极为过量的烷基底物[4]。并且,反应过程中,C(sp3)-H键的断裂过程通常涉及自由基机理。之后,合成化学家进一步设计出各类非活化的C(sp3)-H键与活化的C(sp2)-H键 (主要涉及杂芳基C(sp2)-H键)之间的交叉偶联反应方法学[5]。然而,对于非活化的C(sp3)-H与C(sp2)-H键之间的交叉偶联反应过程,则仍有待进一步研究。近期,已经有诸多研究团队报道一系列通过C(sp3)-H键活化过程引发的非活化C(sp3)-H键与C(sp2)-H键之间的交叉偶联反应方法学[6]。值得注意的是,Shi课题组[7]已经成功开发出一种较为简洁的通过C(sp2)-H键活化引发的交叉偶联反应方法学 (Scheme 1)。此外,Wang课题组[8]报道一种C(sp3)-H/C(sp2)-H键的偶联反应方法学,其反应过程中涉及单电子转移机理。
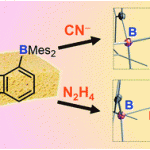
而对于C(sp2)-H与C(sp3)-H键之间交叉偶联反应方法学研究的主要挑战之一则在于C(sp3)-H键的活化。并且,与C(sp2)-H键官能团化方法学相比,涉及C(sp3)-H键官能团化的反应策略仍有待进一步发展[9]。因此,为实现C(sp2)-H键与C(sp3)-H键之间的交叉偶联过程,需要设计一种更为有效的C(sp3)-H键活化策略。其中,已有大量的研究证实,选择双齿导向基团 (bidentate directing group),能够极好地实现惰性C(sp3)-H键的活化[10]。并且,双齿导向基团通常通过中性以及阴离子配位点与催化剂的过渡金属中心进行配位。同时,在导向基团的存在下,芳基C(sp2)-H键能够较为容易地受到过渡金属试剂的活化。由此,作者进一步设想,同样能够选择中性单齿导向基团 (neutral monodentate directing group),进而实现过渡金属催化的芳基C-H 键活化。其中,通过中性原子以及碳负离子位点与过渡金属中心的配位,形成相应的环金属配合物 (metallacycle),进而有效地实现惰性C(sp3)-H键的活化。而且,通过连续的C-H键活化过程,将进一步形成C(sp2),C(sp3)-环钯配合物[11],并经历后续的还原环化步骤,形成C(sp2)-C(sp3)键,并最终实现C(sp2)-H与C(sp3)-H键之间的交叉偶联过程。
受到上述研究报道与本课题组长期以来对于C,C-环钯化学 (C,C-palladacycle chemistry)的研究[12]以及通过C,C-环钯配合物进行的双重C-H键活化策略研究的启发,这里,同济大学的张扬会教授课题组报道一种采用中性导向基团协助,并选择钯催化剂促进的非活化C(sp3)-H与C(sp2)-H键之间的分子内交叉偶联反应方法学,这一全新的交叉偶联策略通过C(sp2),C(sp3)-环钯中间体的进一步环化过程,最终成功完成一系列二氢苯并呋喃以及茚满化合物的构建。
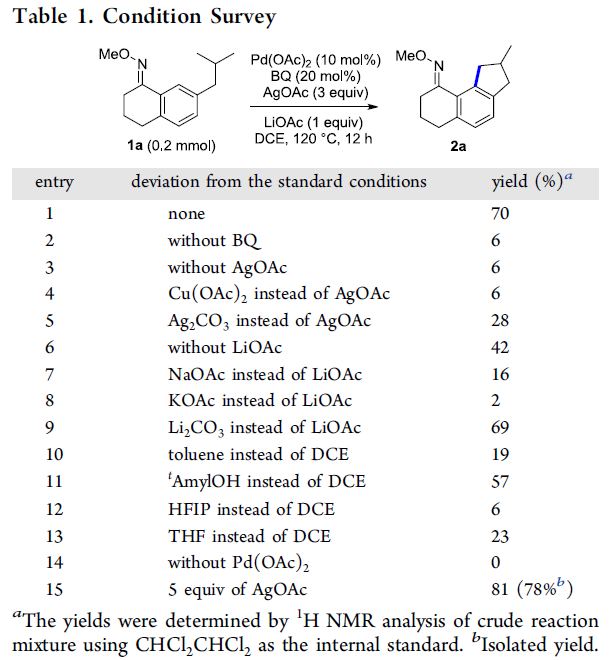
首先,作者采用1a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。确定最佳的反应条件为:采用Pd(OAc)2作为催化剂,1,4-二苯醌(BQ)作为添加剂,AgOAc作为氧化剂,LiOAc作为碱,在DCE溶剂以及反应温度为120 oC的条件下,最终获得70%收率的环化产物2a。
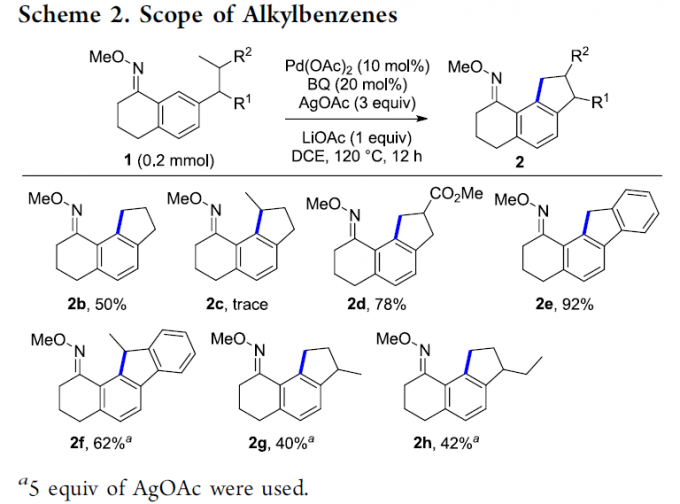
在上述的最佳反应条件下,作者对底物1的应用范围进行考察 (Scheme 2)。研究表明,底物1芳基中存在的丙基C(sp3)-H键,能够有效地参与上述的交叉偶联过程,并获得50%收率的五元环产物2b。然而,在底物1的芳基中存在正丁基取代时,则未能获得相应的目标产物2c,进而表明上述的标准反应条件与非活化的二级C(sp3)-H键无法良好地进行兼容,并且,同样无法形成相应的六元环产物。之后,该小组发现,底物1中的R2基团为酯基时,同样能够与上述的标准反应体系较好地兼容,并获得78%收率的偶联产物2d。同时,实验观察到,上述的最佳反应条件对于底物中存在的苄位甲基C(sp3)-H键,同样表现出优良的反应活性,并以92%的反应收率,获得相应的芴环产物2e。而对于底物1f,反应过程则能够选择性地在二级苄基C(sp3)-H键位置进行,并获得相应偶联产物2f。接下来,作者观察到,底物1中的R1基团为甲基与乙基时,由于二级烷基取代基的存在,致使芳基C-H键的立体位阻增加,进而表现出较低的反应活性,并分别获得中等收率的交叉偶联产物2g与2h。
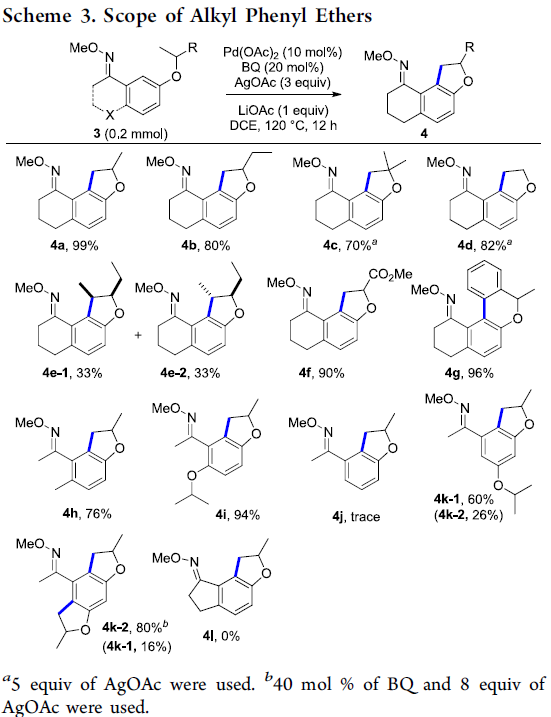
接下来,作者对底物3的应用范围进行考察 (Scheme 3)。研究表明,在底物3的芳基中具有烷氧基官能团,例如异丙氧基、异丁氧基、叔丁氧基以及乙氧基键合时,均能够良好地与上述的标准反应体系兼容,并获得相应偶联产物4a–4d。而对于底物3e,反应过程优先在二级碳原子位点进行,并以1:1的产物比,形成两种非对映异构体4e-1与4e-2。之后,作者发现,上述的标准反应条件对于底物3中存在的酯基官能团,同样能够良好地兼容,并获得90%收率的产物4f。同时,对于底物3g,上述的交叉偶联过程则选择性地在芳基C(sp2)-H 键位置进行,并以优良的反应收率,获得相应的六元环产物4g。此外,该小组进一步发现,非环O-甲基肟基团同样能够作为有效的导向基团,并获得相应的偶联产物4h与4i。 然而,对于缺乏邻位取代基的底物3j,在上述的最佳反应条件下,则未能获得预期的环化产物4j。而相比之下,对于间位具有烷氧基官能团取代的底物3k,则最终能够获得相应的二氢苯并呋喃产物4k-1以及少量的三环产物4k-2。同时,作者进一步观察到,在增加试剂的用量时,能够使三环产物4k-2成为主要产物。最后,该小组发现,对于环戊酮O-甲基肟底物,则无法有效地进行上述的交叉偶联过程 (4l)。
为进一步研究这一全新的分子内交叉偶联策略的合成实用性,作者发现,将底物3a的用量扩大至1 mmol时,在上述的标准反应条件下,同样能够获得99%收率的产物4a。同时,4a能够在盐酸溶液中,进一步转化为相应的羰基化合物5a,收率为89%。
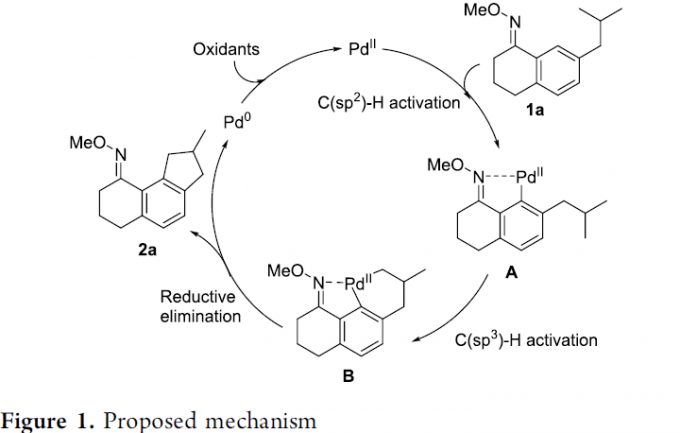
接下来,作者提出一种合理的反应机理路径 (Figure 1)。首先,通过PdII配合物与1a之间进行的肟基团导向的C(sp2)-H键活化过程,形成配合物A。之后,通过配合物A中C(sp3)-H键的断裂过程,形成C(sp2), C(sp3)-环钯中间体B。接下来,通过中间体B的还原消除环化过程,获得最终的目标产物2a,并释放出Pd0配合物。之后,Pd0配合物通过反应体系中相关氧化剂的进一步氧化,使PdII中间体再生,并继续参与后续的催化循环过程。
总结
同济大学张扬会教授课题组报道一种采用O-甲基肟作为导向基团,并在钯催化剂存在的条件下,顺利完成非活化C(sp3)-H与C(sp2)-H键之间的分子内交叉偶联反应策略的设计,进而成功实现一系列二氢苯并呋喃与茚满分子的构建。其中,反应机理主要涉及O-甲基肟导向的芳基C(sp2)-H键活化以及芳基-PdII中间体中烷基C(sp3)-H键的断裂,进而形成关键的C(sp2),C(sp3)-环钯中间体的反应路径。
参考文献
[1] (a) C. S. Yeung, V. M. Dong, Chem. Rev. 2011, 111, 1215. doi: 10.1021/cr100280d.(b) C. Liu, J. Yuan, M. Gao, S. Tang, W. Li, R. Shi, A. Lei, Chem. Rev. 2015, 115, 12138. doi: 10.1021/cr500431s.
[2] Y. Yang, J. Lan, J. You, Chem. Rev. 2017, 117, 8787. doi: 10.1021/acs.chemrev.6b00567. [3] (a) Y. Rong, R. Li, W. Lu, Organometallics 2007, 26, 4376. doi: 10.1021/om700418h.(b) K. L. Hull, M. S. Sanford, J. Am. Chem. Soc. 2007, 129, 11904. doi: 0.1021/ja074395z.
[4] (a) G. Deng, L. Zhao, C. Li, Angew. Chem. Int. Ed. 2008, 47, 6278. doi: 10.1002/anie.200801544.(b) G. Deng, C. Li, Org. Lett. 2009, 11, 1171. doi: 10.1021/ol900070x.
[5] (a) B. Liegault, K. Fagnou, Organometallics 2008, 27, 4841. doi: 10.1021/om800780f.(b) C. Pierre, O. Baudoin, Tetrahedron 2013, 69, 4473. doi: 10.1016/j.tet.2012.11.060.
[6](a) Z. Zhuang, A. N. Herron, S. Liu, J. Yu, J. Am. Chem. Soc. 2021, 143, 687. doi: 10.1021/jacs.0c12484.(b) Y. Liao, Y. Zhou, Z. Zhang, J. Fan, F. Liu, Z. Shi, Org. Lett. 2021, 23, 1251. doi: 10.1021/acs.orglett.0c04239.
[7] J. Shi, D. Wang, X. Zhang, X. Li, Y. Chen, Y. Li, Z. Shi, Nat. Commun. 2017, 8, 238. doi: 10.1038/s41467-017-00078-6. [8] R. Wang, Y. Li, R. Jin, X. Wang, Chem. Sci. 2017, 8, 3838. doi: 10.1039/C7SC00250E. [9] (a) B. Li, Z. Shi, Chem. Soc. Rev. 2012, 41, 5588. doi: 10.1039/C2CS35096C.(b) G. He, B. Wang, W. A. Nack, G. Chen, Acc. Chem. Res. 2016, 49, 635. doi: 10.1021/acs.accounts.6b00022.
(c) O. Baudoin, Acc. Chem. Res. 2017, 50, 1114. doi: 10.1021/acs.accounts.7b00099.
(d) J. He, M. Wasa, K. S. L. Chan, Q. Shao, J. Yu, Chem. Rev. 2017, 117, 8754. doi: 10.1021/acs.chemrev.6b00622.
(e) Z. Chen, M. Rong, J. Nie, X. Zhu, B. Shi, J. Ma, Chem. Soc. Rev. 2019, 48, 4921. doi: 10.1039/C9CS00086K.
[10] (a) O. Daugulis, J. Roane, L. D. Tran, Acc. Chem. Res. 2015, 48, 1053. doi: 10.1021/ar5004626.(b) S. Rej, Y. Ano, N. Chatani, Chem. Rev. 2020, 120, 1788. doi: 10.1021/acs.chemrev.9b00495.
(c) G. Rouquet, N. Chatani, Angew. Chem. Int. Ed. 2013, 52, 11726. doi: 10.1002/anie.201301451.
[11] (a) M. Chaumontet, R. Piccardi, N. Audic, J. Hitce, J. Peglion, E. Clot, O. Baudoin, J. Am. Chem. Soc. 2008, 130, 15157. doi: 10.1021/ja805598s.(b) S. Cai, Y. Li, C. Yang, J. Sheng, X. Wang, ACS Catal. 2019, 9, 10299.
doi: 10.1021/acscatal.9b03426.
(c) Z. Wu, F. Wei, B. Wan, Y. Zhang, J. Am. Chem. Soc. 2021, 143, 4524. doi: 10.1021/jacs.0c13057.
[12] (a) A. Lu, X. Ji, B. Zhou, Z. Wu, Y. Zhang, Angew. Chem. Int. Ed. 2018, 57, 3233. doi: 10.1002/anie.201800330.(b) B. Zhou, Z. Wu, D. Ma, X. Ji, Y. Zhang, Org. Lett. 2018, 20, 6440. doi: 10.1021/acs.orglett.8b02750.
(c) X. Sun, Z. Wu, W. Qi, X. Ji, C. Cheng, Y. Zhang, Org. Lett. 2019, 21, 6508. doi: 10.1021/acs.orglett.9b02386.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.