本文作者:杉杉
导读
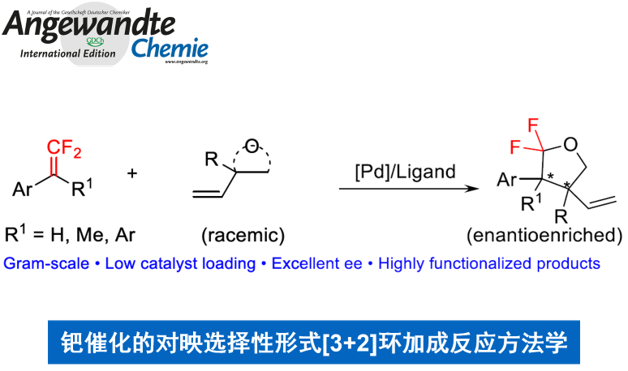
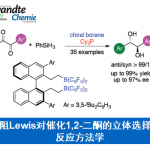
近日,上海有机化学研究所的赵刚等研究团队在Angew. Chem. Int. Ed.中发表论文,报道一种通过钯催化剂促进的对映选择性形式[3+2]环加成反应方法学,进而成功实现一系列2,2-二氟四氢呋喃衍生物的构建。其中,通过偕二氟烯基化合物 (gem-difluoroalkenes)与外消旋乙烯基环氧化物 (vinyl epoxides)或碳酸乙烯亚乙酯 (vinylethylene carbonates)之间的不对称转化过程,能够获得对映富集的2,2-双氟四氢呋喃产物,其对映选择性高达98% ee。同时,值得注意的是,这一全新的形式[3+2]环加成策略,采用廉价易得的(R)-BINAP作为低负载量的配体,并以中等至优良的反应收率获得一系列二氟化产物。此外,上述策略能够通过一步反应过程,同时获得两种手性的非对映体。
Asymmetric Synthesis of 2,2-Difluorotetrahydrofurans through Palladium-Catalyzed Formal [3+2] Cycloaddition
J. Liu, L. Yu, C. Zheng, G. Zhao, Angew. Chem. Int. Ed. ASAP doi: 10.1002/anie.202111376.
正文
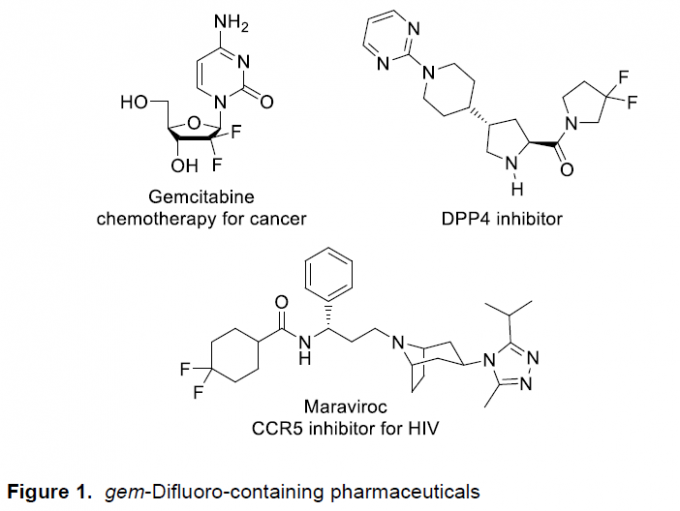
将偕二氟结构单元引入至各类杂环分子中,在生物活性化合物以及药物化学的研究中,具有十分重要的应用价值 (Figure 1)。其中,在具有强吸电子特性的二氟烯基化合物的末端,由于氟原子的存在,表现出极高的反应活性,进而能够作为有机合成方法学研究中的关键砌块。近期,已经有相关的文献报道,采用偕二氟烯基化合物作为起始原料,通过交叉偶联、加成或加成消除过程,最终获得一系列相应的单氟化[1]、二氟化[2]以及三氟化[3]的有机分子。并且,在文献已经报道的相关合成转化策略中,偕二氟烯基化合物的环加成反应方法学更加高效便捷。
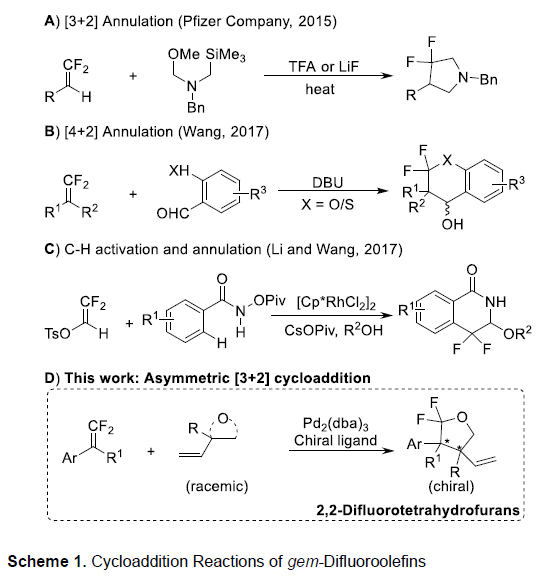
2015年,Pfizer公司的研究团队报道通过双氟乙烯化合物的1,3-偶极环加成策略,进而实现一系列3,3-二氟吡咯烷分子的构建[2a] (Scheme 1A)。2017年,Wang课题组设计出一种采用DBU催化的,通过偕二氟烯基化合物参与的[4+2]环化反应方法学[2b],进而获得相应的偕二氟异黄烷醇 (gem-difluorinated isoflavanol)衍生物 (Scheme 1B)。同时,Li与Wang研究团队同样报道一种通过2,2-而氟乙烯基对甲苯磺酸酯的C-H活化诱导的[4+2]环化反应方法学[1c],并以良好的反应收率,获得各类氟代二氢异喹啉-1(2H)-酮衍生物 (Scheme 1C)。然而,对于具有五元环骨架的对映富集的偕二氟四氢呋喃分子的构建,至今尚未有相关的文献报道。近期,Zhang与Toste课题组报道一种通过偕二氟烯基化合物的对映选择性加成策略,进而获得一系列相应的三氟甲基化合物或溴代二氟甲基化合物[2d],[3c]。受到上述研究报道的启发,这里,本文报道首例偕二氟烯基化合物与乙烯基环氧化物或碳酸乙烯亚乙酯之间的不对称反应方法学,进而成功完成一系列手性偕二氟四氢呋喃分子的构建 (Scheme 1D)。
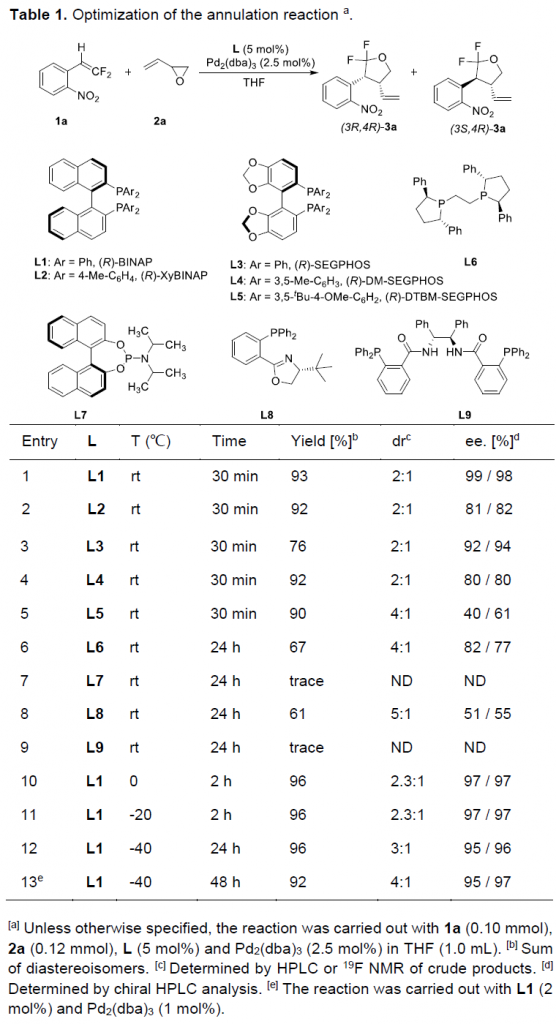
首先,作者采用1-(2,2-双氟乙烯基)-2-硝基苯1a与外消旋2-乙烯基环氧乙烷2a作为模型底物,进行相关反应条件的优化筛选 (Table 1)。进而确定最佳的反应条件为:采用Pd2(dba)3作为催化剂,(R)-BINAP作为手性配体,在THF反应溶剂中,-40 ℃下进行反应,最终获得相应的手性产物(3R,4R)-3a (92%收率, 4:1 dr, 95% ee)以及(3S,4R)-3a (92%收率, 4:1 dr, 97% ee)。
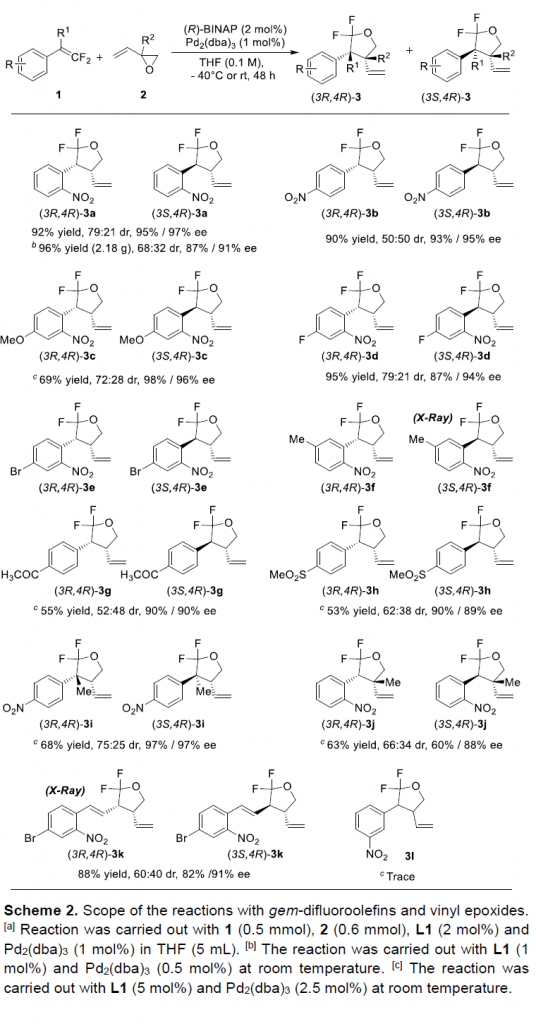
在上述的最佳反应条件下,作者首先对偕二氟烯基底物1的应用范围进行考察 (Scheme 2)。研究表明,各类芳基邻或对位具有硝基、甲氧基、卤素基团、甲基、以及乙酰基等基团取代的偕二氟芳乙烯底物,均能够较好地与上述的标准反应条件进行兼容,并以53-96%收率、60-97% ee以及50:50-79:21dr获得相应的手性产物3a–3k。并且,值得注意的是,在3 a (2.18 g)的克级规模实验研究中,仅采用0.5%负载量的钯催化剂,即可获得96%反应收率以及87%/91% ee的手性二氟四氢呋喃产物。然而,上述的最佳反应条件,对于芳基间位具有硝基取代的偕二氟芳乙烯底物,由于存在不利的电子效应,因而,未能获得相应的目标产物3l。接下来,该小组发现,采用取代的乙烯基环氧化物,同样能够有效地参与上述的对映选择性转化过程,并以良好的反应收率以及中等至优良的对映选择性,分别获得具有四级立体生成碳中心的3-甲基化产物3i与4-甲基化产物3j。
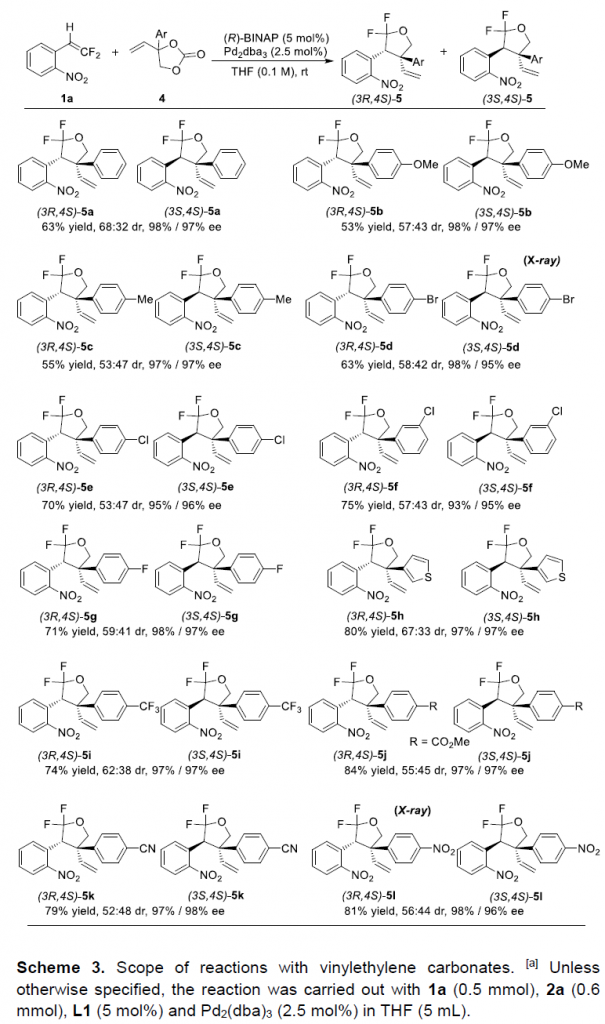
接下来,作者对碳酸乙烯亚乙酯 (vinylethylene carbonate, VEC)底物的应用范围进行深入研究 (Scheme 3)。该小组观察到,VEC底物具有更加优良的稳定性,并且,能够更为有效地参与钯催化的不对称脱羧环加成过程。同时,在上述的标准反应条件下,一系列芳基中具有不同电子与立体特性的基团取代的VEC底物,均能够顺利地与1a进行相应的环加成过程,并以中等至良好的反应收率与优良的对映选择性,获得相应的手性产物5。
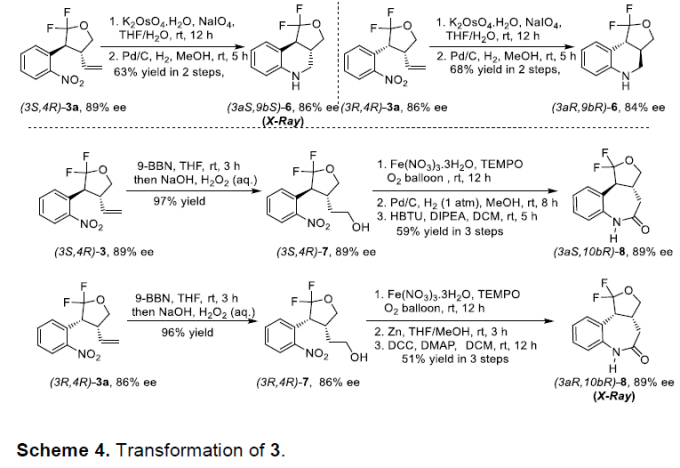
为阐明上述环加成策略的合成实用性,作者进一步对相应的手性二氟四氢呋喃产物进行一系列相关的后期修饰研究 (Scheme 4)。首先,作者发现,产物3a能够较为容易地氧化为醛,并进一步通过Pd/C催化的氢化过程,转化为四氢喹啉化合物6。此外,作者进一步发现,二氟四氢呋喃产物的两种手性非对映体,能够通过硼氢化-氧化以及后续的氧化、还原与缩合反应步骤,最终获得相应的七元环酰胺分子8。值得注意的是,上述的反应过程中,所有相关产物的对映纯度均未受影响。
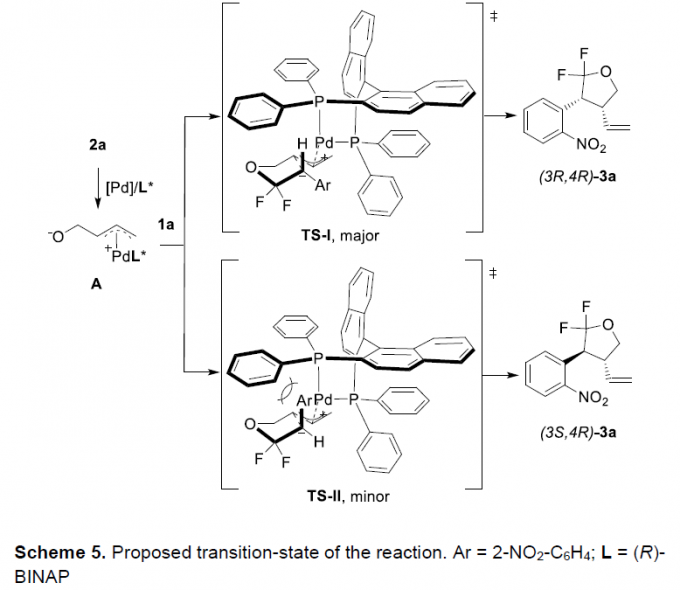
接下来,作者提出一种Pd/(R)-BINAP催化的不对称形式[3+2]环加成反应的过渡态模型 (Scheme 5)。基于上述的实验观察以及前期的文献报道[4],作者假设,反应过程中,能够形成相应的五元环四氢呋喃过渡态。首先,在(L1)-钯配合物存在下,通过乙烯基环氧化物2a的开环过程,形成活化的两性离子(π-烯丙基)钯中间体A。之后,通过两性离子(π-烯丙基)钯中间体A中,烷氧负离子单元对于偕二氟烯基碳中心的亲核进攻,产生两种不同的过渡态TS-I与TS-II。其中,TS-II具有较低的立体位阻,并形成产物(3S,4R)-3a。然而,其配体中的二苯基膦单元与1a中的芳基基团之间,同样可能产生显著的立体阻碍,因此,TS-II的形成过程,热力学更为不利。此外,由于1a中的富电子芳基与缺电子的π-烯丙基-Pd配合物之间,可能存在相关的π-相互作用,进而能够在亲核加成步骤完成之后,形成较为有利的非对映体(3R,4R)-3a。通过上述因素的共同作用,通过Pd/(R)-BINAP催化的对映选择性环加成过程,能够以优良的对映选择性以及中等程度的非对映选择性,获得相应的手性产物。
总结
上海有机化学研究所的赵刚等研究团队报道一种采用钯催化剂促进的对映选择性形式[3+2]环加成反应方法学,进而成功实现一系列对映富集的2,2-二氟-4-乙烯基四氢呋喃分子的构建。并且,这一全新的[3+2]环加成策略具有优良的对映选择性 (高达98%)以及优良的反应收率 (高达96%)。同时,采用廉价易得的(R)-BINAP作为手性配体,进而通过一步的不对称环化过程,获得两种重要的手性非对映产物。而且,这一全新的环加成策略具有底物应用范围广泛、催化剂负载量低、反应条件温和以及便于实现克级规模操作等优势。此外,通过目标产物的后期衍生化过程,能够进一步完成相应四氢喹啉以及七元环酰胺分子的构建。
参考文献
[1] a) H. F. Koch, J. G. Koch, N. H. Koch, A. S. Koch, J. Am. Chem. Soc. 1983, 105, 2388. doi: 10.1021/ja00346a047.b) Y. Xiong, X. Zhang, T. Huang, S. Cao, Org. Chem. 2014, 79, 6395. doi:10.1021/jo5005845.
c) J.Wu, S. Zhang, H. Gao, Z. Qi, C. Zhou, W. Ji, Y. Liu, Y. Chen, Li, X. Li, H. Wang, J. Am. Chem. Soc. 2017, 139, 3537. doi: 10.1021/jacs.7b00118.
[2] a) I. McAlpine, M. Tran-Dube, F. Wang, S. Scales, J. Matthews, M. R. Collins, S. K. Nair, M. Nguyen, J. Bian, L. M. Alsina, J. Sun, J. Zhong, J. S. Warmus, B. T. O’Neill, J. Org. Chem. 2015, 80, 7266. doi: 10.1021/acs.joc.5b00853.b) J. Li, Xu, N. Wei, M. Wang, J. Org. Chem. 2017, 82, 11348.doi: 10.1021/acs.joc.7b01635.
c) D. L.Orsi, B. J. Easley, A. M. Lick, R. A. Altman, Lett. 2017, 19, 1570. doi:10.1021/acs.orglett.7b00386.
d) E. Miller, S. Kim, K. Gibson, J. S. Derrick, F. D. Toste, Am. Chem. Soc. 2020, 142, 8946.doi: 10.1021/jacs.0c02331.
[3] a) B. Gao, Y. Zhao, J. Hu, Angew. Chem. Int. Ed. 2015, 54, 638. doi: 10.1002/anie.201409705.b) P. Tian, C. Wang, S. H. Cai, S. Song, L. Ye, Feng, T. P. Loh, J. Am. Chem. Soc. 2016, 138, 15869.doi: 10.1021/jacs.6b11205.
c) Lin, Z. Pan, Y. Tu, S. Zhu, H. Wu, Y. Liu, Z. Li, J. Zhang, Angew.Chem. Int. Ed. 2020, 59, 22957. doi: 10.1002/anie.202008262.
[4] a) B. M. Trost, P. H. Lee, J. Am. Chem. Soc. 1991, 113, 5076. doi: 10.1021/ja00013a062.b) Craig, C. J. T. Hyland, S. E. Ward, Chem. Comm. 2005, 3439. doi:10.1039/B504731E.
c) D. Madec, G. Prestat, E. Martini, P. Fristrup, G. Poli, P. Norrby, Org.Lett. 2005, 7, 995. doi: 10.1021/ol047548l.
d) B. M. Trost, P. J. Morris, Chem. Int.Ed. 2011, 50, 6167. doi:10.1002/anie.201101684.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.