今天是阿尔兹海默尔日,谨以此文献给当今遭受着阿尔兹海默尔症的家庭和致力于破解此病的科学家们!
全文3600字左右,稍长。分为三个部分:1.阿尔兹海默尔症的简介 2.阿尔兹海默尔症诊断的分子学方法 3.关于ADs的一篇论文介绍
就在今年,VR(Virtual Reality)眼镜的新闻像一股“泥石流”涌入了我们的朋友圈和各大网站的首页。VR就是通过人的眼睛,给大脑营造一个虚拟的场景。各类关于此黑科技的评测,不禁让人感叹道:科技竟然已经发展到了如此的高度!
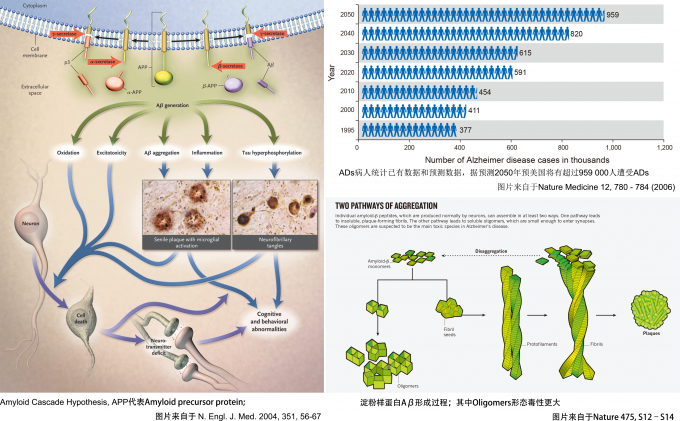
然而,戴着VR的我却不禁想到“人类对于自身大脑的认知还处于黑暗时代”。当提及大脑的未知,阿尔滋海默尔症(Alzhermer‘s Disease;ADs),也就是所谓的老年痴呆症也许就是首当其冲的典型之一了吧。。。当那个儿时还给你煮面的奶奶突然问道:“你是谁?”,那个一到人前就夸赞你的爷爷突然有一天对你说:“见到我孙子了吗?我给他做好了饭他都不吃。”。。。。。。一家人带着老人寻医问药,却被医生告知此病“一旦开始,只能减缓,无药可治”(在小编撰写此文时,nature发表了一篇文章报道了首例进入一期临床测试的抗ADs药物,能有效的减少淀粉样纤维的数量;Nature537,50–56)时,几多无奈几多无助只能唏嘘不已——据WHO统计,全球约有4750万老年痴呆症患者,每年新增770万例,其中60-70%是由阿尔滋海默尔症导致的,而中国目前有超过500万的阿尔滋海默尔症患者和他们的家庭遭受着这不幸[1](如图1右上角,以美国为例,ADs患者在未来30年左右将会翻倍)。
阿尔兹海默尔症的病理假说以及神经毒性淀粉样蛋白
尽管科学家们费尽心力一步步的在揭开此病之谜,然而目前别说治疗了,甚至,阿尔滋海默尔症的致病原因都有待定夺。目前关于ADs有三个主要的理论:1.Amyloid Cascade Hypothesis(ACH)2.oxidative stress 3.metal ion hypotheses。而绝大多数科学家们都极力支持的一个假说就是Amyloid Cascade Hypothesis(ACH)[2],如图1所示,此病理过程大致如下:
- 淀粉样前体蛋白(amyloid precursor protein,APP)过度地表达
- β-secretase切割APP,释放出β-APP,而余下部分进一步被γ-secretase切割释遂放出amyloid β(Aβ)(Aβ40和Aβ42,40和42代表多肽中氨基酸数目)
- 游离的Aβ进一步聚集为低聚物或者淀粉样纤维,其中Aβ42则是导致ACH的主要嫌疑犯[3],如图1右下角
- 低聚Aβ和淀粉样纤维显示出神经性毒性导致神经细胞凋亡
也就是说,寻求1.β-secretase抑制剂 2.γ-secretase抑制剂 3.淀粉样蛋白(Amyloid β;Aβ)清除剂,就都有可能预防/治疗ADs。所以,当代许多的科学家们都纷纷在这三个突破口的最前线上持续地战斗着。值得一提的是,如果将病体中提取的Aβ植入健康机体中,植入的Aβ会诱导并加速形成更多的Aβ,从而致病,所以Aβ曾经也被成为prion,不过现在很少如此使用了。
阿尔兹海默尔症的分子探针
由于ADs暂时缺乏特效药,所以尽早地诊断确诊亦是重点之一。一般通过家族病史和精神状态及智能的检查可以大致判断,但正是如此,往往易产生不小的误差。所以,既然淀粉样蛋白的出现是ADs的标志性指标,可视化的Aβ成像肯定能极大地提高确诊率,也就是使用某些分子探针,此类探针能特异性的结合淀粉样蛋白并发射出特定的信号,通过收集这些信号,医生就可以方便的进行诊断。因此,化学家们很早就致力于此了。比如,最早发现可以作为Aβ荧光标记物的是一名为Thioflavin T(硫磺素T;ThT)的化合物(图2a),ThT能进入淀粉样蛋白β-折叠形成的空腔中与之键合,而进入空腔的ThT的荧光会从无到有极大地增强。ThT作为Aβ探针的先河,虽被称做“Gold Standard”,却只能用于切片组织标记,无法临床使用。然而由ThT的骨架(以及从荧光增强机理出发发现的化合物)衍生出了非常多探针,其中Pittsburgh compound B(PiB,图2)是用于人体的PET(Positron Emission Computed Tomography:正电子发射断层扫描)探针中研究最多的,Florbetapir (18F),F18-AV-45则是其中第一个获得FDA认证可用于人体检测Aβ的PET探针[4],如图2中,如今PET可视化AD的效果已经十分优异了。
不过由于PET设备过于昂贵,大多数医院并不一定具备。并且一次扫描的价格近万元,对病人也带来了不小的压力。所以,科学家们也一直在寻求更加经济更加便捷的检测方法用于ADs诊断,比如单光子发射断层扫描(single photon emission computed tomography,SPECT)和近红外荧光成像,然而此两者目前并没有临床可以使用的探针。如图2右,京都大学的Saji Hideo教授设计的近红外标记DANIR2c[5],不仅具近红外优势,还能很好的进入大脑,并且在30min处明显可以看到标记现象。
总之,这类分子探针都具有比较小的分子量,能很好的穿过血脑屏障(blood brain barrier,BBB)。早在2002年,lee[6]就提出了“Amyloid binding ligands as Alzheimer’s disease therapies”,也就是将这一类对Amyloid具有特异性识别的探针作为治疗方案,不过并不具有特别的效果。
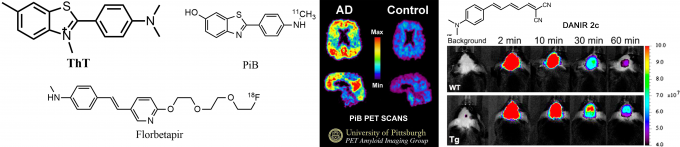
图2 左:以ThT为源,发现的两个高效PET探针PiB和Florbetapir;中:PiB-PET图,左为患者,右为健康人;右:近红外荧光标记DANIR2c的活体荧光实验,WT为正常小鼠,Tg为转基因具有过量Aβ的病态小鼠
而今天将为大家介绍的一篇出自东京大学大药学系金井研究室的研究谷口敦彦讲师(现东京药科大学药学部药品化学教室(林良雄研究室) )之手的文章,则首次利用本来作为标记物ThT的衍生物3,成功地利用了光催化,选择性的阻碍甚至破坏了淀粉样蛋白:
“Switchable photooxygenation catalysts that sense higher-order amyloid structures”
A. Taniguchi, Y. Shimizu, K. Oisaki, Y. Sohma, M. Kanai, Nature Chem. 2016, Advance Online Publication. DOI:10.1038/nchem.2550
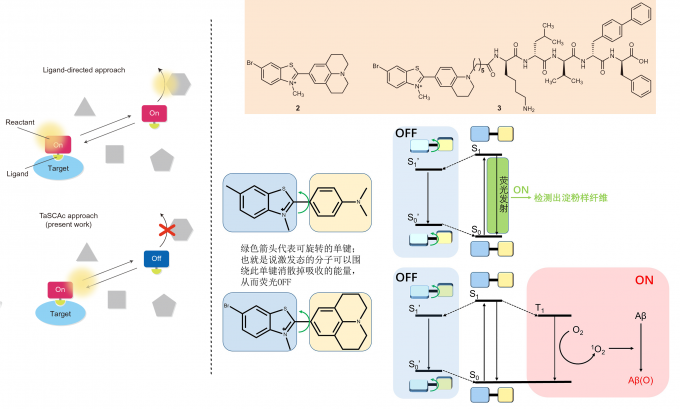
首先,大家想象一下,药物(底物)是不是往往都具有一定的破坏性(副作用/毒性)?比如光动力治疗药物分子(正常细胞也会受到活性氧破坏)和抗癌药物(接受化疗头发掉光)。结合了受体的底物(药物)显示出了活性(药性)的同时, 游离的底物(药物)则显示出了毒性,这也就是当今医学界追求靶向性的一个重要原因之一。如果能做到底物(药物)只在结合了受体之后才打开其活性(药性)ON,而游离时则不显示活性OFF的话,这也许就是开发药物的科研工作者们的最大目标了吧!本文则首例成功实现了此设想,填补此空白。
接着,我们看看分子设计,分子2相较于图1中的ThT,作者将N,N-二甲基苯部分→久洛尼啶,如此能一定程度降低非辐射弛豫增大量子产率;溴原子的取代是因为重原子效应能提升三线态的稳定性,利于分子由单线态进入三线态,从而增大产生单线态氧(活性氧)的可能性。而分子3相比于分子2则修饰了多肽链,此多肽能降低分子毒性并且具有Aβ键合位点。
其次,如图3右, 游离的ThT和2受到激发后,很快由S1进入S1’(也就是扭曲的分子内电荷转移,TICT),随后又由S1’通过非辐射弛豫回到S0,简而言之,即游离的ThT或者2往往通过单键旋转去激发,而呈现OFF状态。键合Aβ之后,受到淀粉样蛋白β折叠空腔的限制,ThT和2无法进行旋转,于是ThT荧光去激发途径ON。对于2而言:首先,单线态S1系间窜越进入三线态T1;随后,T1将能量传递给溶解的氧气,使氧气转化为单线态氧;最后,单线态氧将Aβ氧化破坏。这就是本文的重点机理。
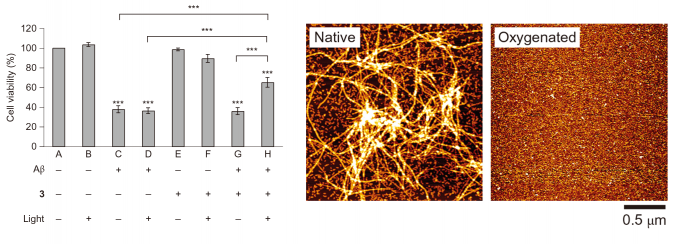
细胞活性实验能很好的证明此机理的可行性,由于2对使用的小鼠PC12细胞具有比较强的毒性(~1.5μM,50%细胞活性),所以如图4左所示,使用3作为实验底物。由A-D可以知道Aβ有显著的毒性以及λ=500nm的激发光几乎不损伤细胞;E-F可以读出3自身没有毒性,并且光照下的3也几乎不会释放单线态氧;而G-H则可以验证图3中提出的机理,键合Aβ的3释放出的单线态氧可以破坏Aβ从而降低其毒性。图4中,原子力显微镜(AFM)实验也说明了光照下,3的加入可以有效的破坏淀粉样纤维。
除了ADs之外,还有其他二十余种Amyloid疾病。所以,除了Aβ之外,作者还对其他能形成淀粉样纤维的蛋白质/多肽也进行了研究。在实验中发现,由于2特异性的键合淀粉样蛋白的β-折叠空腔,2能够选择性的对错误折叠的淀粉样蛋白进行氧化去毒性,而对正常构型的蛋白分子没有影响。
图5 其他能形成淀粉样蛋白的蛋白质/多肽
当然,此篇文章的方法目前用于治疗ADs还不现实,1.所使用的激发光不具有足够的组织穿透性 2.单线态氧量子产率偏低,并不能高效地破坏Amyloid 3.底物分子(也许)不能穿透BBB。就本文中的3而言,具有至少以下三个可能性
- 有用于一些外周淀粉样蛋白疾病(比如,包涵体肌炎(Inclusion body myositis,IBM)、皮肤型淀粉样变性(Amyloidosis cutis ))光动力治疗的可能性。
- 未来可能出现可植入大脑的微型光学仪器,类似于用于帕金森病的脑深部电刺激(Deep-brain-stimulation treatment)。此种仪器的出现能促进本文方法的临床使用
- 近来有研究报道显示[7],淀粉样聚集体有可能最早出现于大脑外周部位比如从嗅觉上皮,随后进一步向内部扩散。如果这个假设成立的话,本文方法必然可以用于早期淀粉样聚集体的预防和治疗。
不论如何,游离的单线态氧对于正常细胞具有不小的毒性,而本文中的方法可以锁定单线态氧生成于特定的异常折叠的蛋白质部位,从而很大程度的降低了单线态氧的危害性。这对于今后利用光动力法治疗阿尔兹海默尔症和其他淀粉样变性疾病奠定了不小的基础!值得期待!
在Alzheimer‘s Day的今天,看了这篇文章的各位,请相信科学家们(不管是医学家还是药学家还是化学家)正在为了人类的福祉战斗着!尽管我们现在的一些家庭正在遭受这阿尔兹海默尔症的折磨,但请相信,也许不久的将来,我们必然能够攻克这一疾病!保证我们所有人的爷爷奶奶晚年的天伦之乐!
最后,知道化学家在做啥了吧!?
参考文献
- [1]4750万的数字援引自世界卫生组织 截止于2016年4月数据 http://www.who.int/mediacentre/factsheets/fs362/zh/;500万数字援引自中国卫计委http://www.nhfpc.gov.cn/zhuzhan/zxfb/201509/d2fa383deac9419b9fdd883799126f81.shtml;小编目前想知道最权威的统计数据,如果有知情者,请告诉小编
- [2]”Alzheimer disease therapy: Can the amyloid cascade be halted?”J. Clin. Invest.,2003,111,11–18. doi:10.1172/JCI200317527;”Little proteins, big clues” Nature,2011,475,S12–S14,doi:10.1038/475S12a;”Alzheimer’s Disease” J. L. N. Engl. J. Med. 2004, 351, 56-67.DOI: 10.1056/NEJMra040223
- [3]”Cell biology of protein misfolding: the examples o2002f Alzheimer′s and Parkinson′s diseases” Nat. Cell Biol.,2004, 6, 1054–1061.
- [4] “Alzheimer’s-disease probe nears approval” Nature,2011, 469, 458 DOI:10.1038/469458a
- [5]”Smart Near-Infrared Fluorescence Probes with Donor–Acceptor Structure for in Vivo Detection of β-Amy” J. Am. Chem. Soc., 2014, 136 , 3388–3394.DOI:10.1021/ja4052922
- [6]”Amyloid binding ligands as Alzheimer’s disease therapies”Neurobiology of Aging,2002,23, 1039–1042.DOI:dx.doi.org/10.1016/S0197-4580(02)00121-5
- [7]”Amyloid-β deposition and olfactory dysfunction in an Alzheimer’s disease model.” J. Alzheimer’s Dis.,2013, 37, 699–712.DOI:10.3233/JAD-122443;”α-Synuclein strains cause distinct synucleinopathies after local and systemic administration”. Nature,2015, 522, 340–344.DOI:10.1038/nature14547
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.