作者:石油醚
导读:
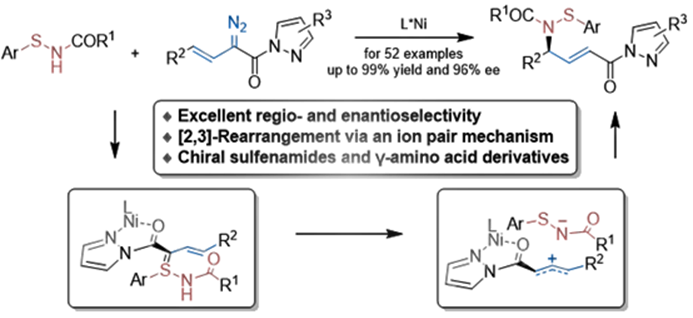
近日,四川大学刘小华教授和冯小明教授团队报道了一类烯丙基硫亚胺不对称反应的新策略。针对重排反应的核心中间体烯丙基硫亚胺,相比于传统反应切断S-N键,作者将其分割为烯丙基部分和S-N部分。这一研究成果近期发表在Angew上,在读博士生肖志杰为文章第一作者,刘小华教授和冯小明院士为论文的通讯作者。
“Asymmetric Catalytic Synthesis of Allylic Sulfenamides from Vinyl α-Diazo Compounds by a Rearrangement Route.
Zhijie Xiao, Maoping Pu, Yuzhen Li, Wei Yang, Fei Wang, Xiaoming Feng*, Xiaohua Liu*
Angew. Chem. Int. Ed. 2024, e202414712. DOI: 10.1002/anie.202414712”
正文:
从上个世纪以来,含硫化合物一直是化学领域特别是有机化学中,非常重要的组成部分和研究对象。而作为广泛存在于天然产物和药物分子中的含N-S键化合物,因其独特的生物活性和多样的衍生价值,近年来也受到了有机化学家们越来越多的关注。
然而,烯丙基硫亚胺的[2,3]-重排反应,是一种有效合成烯丙基次磺酰胺以及烯丙基胺的方法。早在1950年,Challenger和Greenwood两人在研究二烯丙基二硫醚化合物的结构和反应中,就偶然发现了其副产物二烯丙基硫亚胺,在室温或加热条件下,会转化为一种质量相同的油状化合物,且放置冰箱可以保存3到4周。但当时两人并不清楚产物是什么结构,反应又是如何发生的。紧接着第二年,随着Ash的加入,他们通过该未知化合物的水解产物分析,推测该化合物为烯丙基次磺酰胺,其在原有的烯丙基硫亚胺基础上,发生了一个烯丙基的迁移。随后的1952年,他们又利用氯胺T等氮源试剂,实现了更多该类反应的例子,并再次对结构进行了对比与佐证。这也应该是烯丙基硫亚胺重排反应的第一例报道。
在随后的七十年间,烯丙基硫亚胺的重排反应被化学家们充分的发展,但主要策略还是集中在对硫醚的原位亚胺化构建中间体上。其不对称反应核心是构建手性烯丙基硫亚胺中间体,主要分为两类,一是预先制备手性硫醚,再进行有机胺化重排;另一种是对非手性硫醚进行不对称亚胺化,再发生重排。二者在重排过程中均可以保持手性,但也同时会受限于底物类型和胺源试剂。因此,发展一类新的烯丙基硫亚胺重排反应策略,依旧具有一定的价值和应用前景。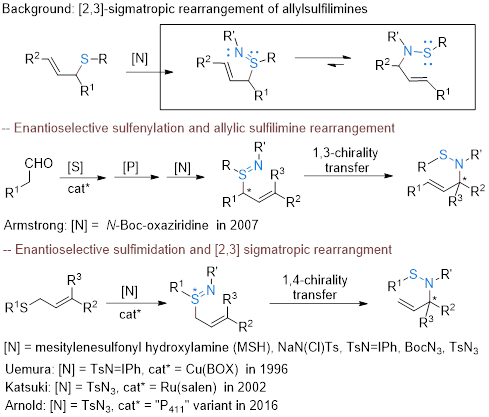
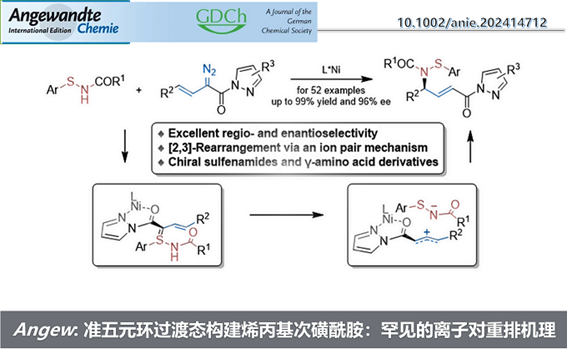
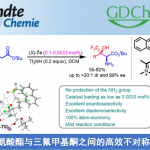
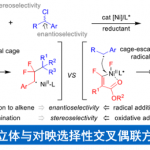
近日,四川大学刘小华教授和冯小明教授团队报道了一类烯丙基硫亚胺不对称反应的新策略。针对重排反应的核心中间体烯丙基硫亚胺,相比于传统反应切断S-N键,作者将其分割为烯丙基部分和S-N部分。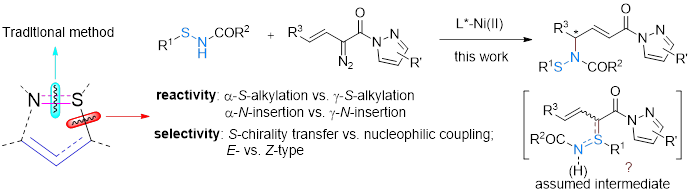
其中,烯丙基部分选取了其充分发展的一类烯基重氮吡唑酰胺作为前体,而S-N部分则是借鉴了Ellman课题组多次报道的次磺酰胺作为硫亚胺的前体,在氮氧-金属镍卡宾的作用下,原位生成烯丙基硫叶立德中间体,实现不对称重排反应。
文章中,作者首先对反应进行了初步筛选。金属、配体和溶剂均对反应有较大的影响,且延长反应时间,催化剂用量可以降到2%,区域选择性和立体选择性几乎得到保持(entry12)。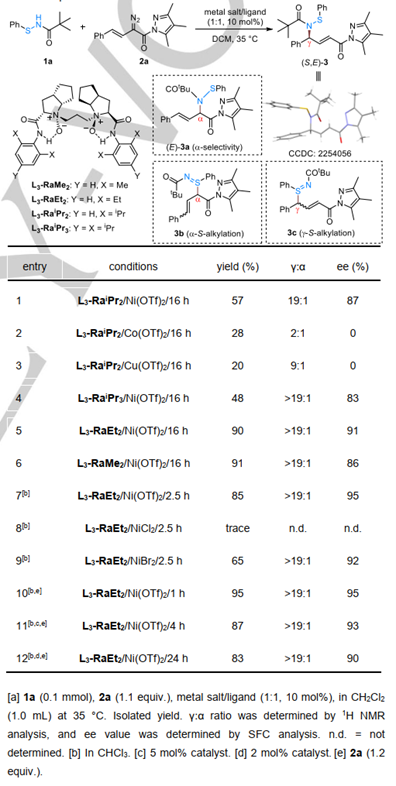
紧接着,作者又进行了底物扩展。大部分类型的底物都可以得到较好的结果,除了邻位芳基硫取代底物(27,28)。其较低的反应活性和较弱的手性控制可能暗示了硫对卡宾底物的靠近,佐证了重排反应的机理。另外,也需要注意得是,反应同样存在其局限性,烷基硫和烷基胺类的次磺酰胺其反应活性和手性控制均较差,可能是由于该类次磺酰胺对金属的毒化作用以及相关副反应的增强。
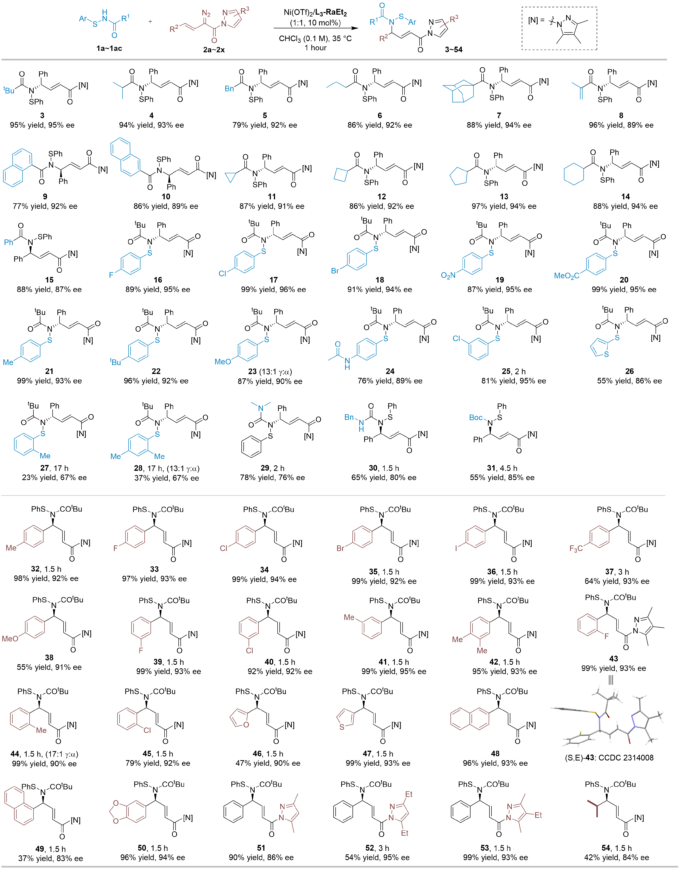
此外,产物衍生也被积极的探索。酰基吡唑基团可以被转化为酯基,酰胺和羧酸;次磺酰胺可以被转化为亚磺酰胺;值得注意得是,手性α,β-不饱和-γ-丁内酰胺也可以通过一步简单的衍生得到,其中涉及了一个有趣的Z→E顺反异构,且手性得到了保持,这在之前文献的报道中似乎是很难实现的。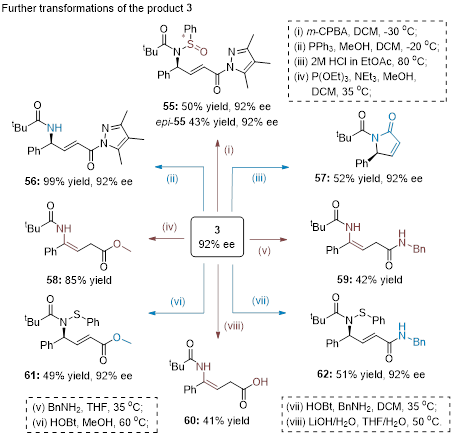
当然,作者也进行了一些机理实验。首先是其他类型的酰胺,都没有拿到产物,进一步减小了直接氮氢插入的可能。随后是氘代实验,由于次磺酰胺不易被氘代,因此该实验可以证明水在其中参与了反应。此外,通过原位胺化烯丙基硫醚,可能的中间体也被制备,且在体系中检测到相关产物的生成,再一次验证了重排反应发生的可行性。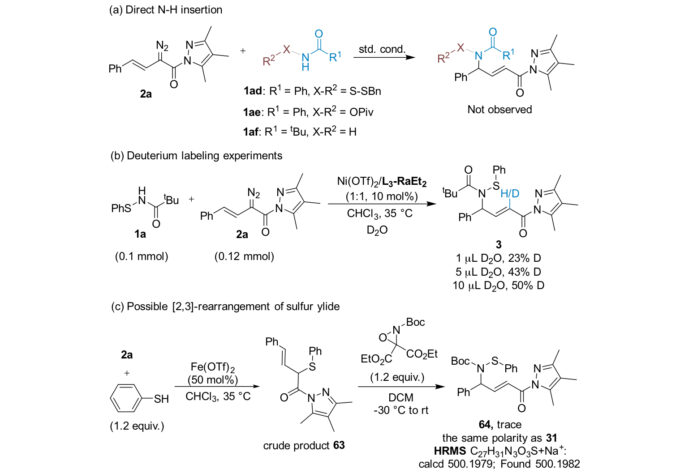
最后,为了探索和验证反应机理,作者进行了较为详细的DFT计算。首先,在手性氮氧金属镍配合物的作用下,烯基重氮生成三线态金属镍卡宾Int2T,且烯基与卡宾成顺式结构。随后,次磺酰胺发生进攻,并原位生成烯丙基硫叶立德Int3。直接的N-H插入由于能量过高,而被直接排除。在水的参与下,Int3发生了一个1,3-质子迁移,同时S-C键断裂,生成次磺酰胺阴离子与烯丙基正离子的离子对Int4。值得注意的是,作者并不能确定烯丙基硫亚胺中间体是否存在,更倾向于是一个同时发生得过程。最后在非共价力作用下,历经一个准五元环过渡态,实现了形式上的[2,3]-重排的过程。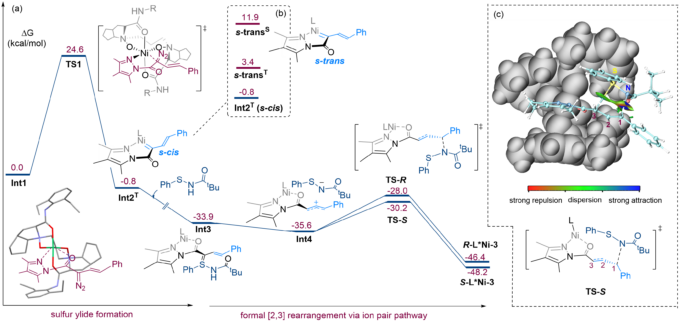
总结
刘小华教授和冯小明院士团队报道了一类烯丙基硫亚胺重排反应的新策略和新机理,并进行了系统的机理研究与应用探索。同时,相关反应也为手性烯丙基次磺酰胺、烯丙基胺以及不饱和γ-氨基酸的合成,提供了一种新的思路和方法。
(非常感谢刘小华教授和冯小明院士团队对Chem-Station的大力支持)
导师介绍

刘小华 教授
简历
1996.9-2000.6 湖北师范学院化学系学习,获理学学士学位。
2000.9-2003.6 四川大学化学学院分析化学专业学习,获理学硕士学位。
2003.9-2006.6 四川大学化学学院有机化学专业学习,获理学博士学位。
2006.7-2010.6 四川大学化学学院副教授,硕士生导师。
2010.7-至今 四川大学化学学院教授,2012年担任博士生导师。
2011年获教育部新世纪优秀人才计划资助;2012年获国家自然科学基金委优秀青年基金资助;2013年入选四川省学术和技术带头人后备人选;获霍英东青年教师基金资助;2015年入选第二届国家高层次人才特殊支持计划青年人才,享受国务院政府特殊津贴专家;2016年获国家杰出青年科学基金资助;2017年国家百千万人才工程入选者和有突出贡献中青年专家;2018年入选四川省学术和技术带头人;2020年获全国三八红旗手称号;2021年当选英国皇家化学会会士。
任Organic & Biomolecular Chemistry副主编,Chinese Chemical Letter和《化学学报》编委委员,《高等学校化学学报》青年执行编委,中国化学会青年工作委员会委员、中国化学会有机化学学科委员、手性化学专业委员会副主任和物理有机化学专业委员会委员。
主要研究方向
主要从事新型手性催化剂的设计合成、不对称催化反应、手性药物和生理活性化合物的高效高选择性合成研究。欢迎各位优秀学子前来报考研究生,详见课题组主页http://www.scu.edu.cn/chem_asl

















No comments yet.