摘要
近日,日本京都大学的Yoshiaki Nakao课题组(主页)以芳硝基化合物和胺为底物,在Pd催化下,首次实现了二者的Buchwald-Hartwig交叉偶联。反应产率较高,底物范围广,为断裂Ar-NO2键实现其他新颖的交叉偶联反应提供了参考。
Buchwald–HartwigAmination of Nitroarenes
Fumiyoshi Inoue, MyutoKashihara, M. RamuYadav, Yoshiaki Nakao
Angew. Chem. Int. Ed. 2017, 56, 13307–13309, DOI:10.1002/anie.201706982
一、研究背景
芳胺在医药和功能材料等领域发挥着重要作用,Buchwald-Hartwig胺化反应是合成取代芳胺的一种高效且通用的方法[1]。该反应最初是利用芳基卤化物作为亲电试剂与胺在Pd催化下偶联,由于芳基卤化物可能影响产物的纯度[2],随后芳基三氟甲磺酸酯[3]、对甲苯磺酸酯[4]、醚[5]等逐渐代替了芳基卤化物参与偶联反应。芳硝基化合物作为芳烃官能团化的重要合成模块,很容易获得,除了可以规避芳基卤化物偶联带来的弊端,在学术研究及工业上都具有较大的意义[6]。因此,研究组报道了首例Pd催化下芳硝基化合物参与的Buchwald-Hartwig反应。
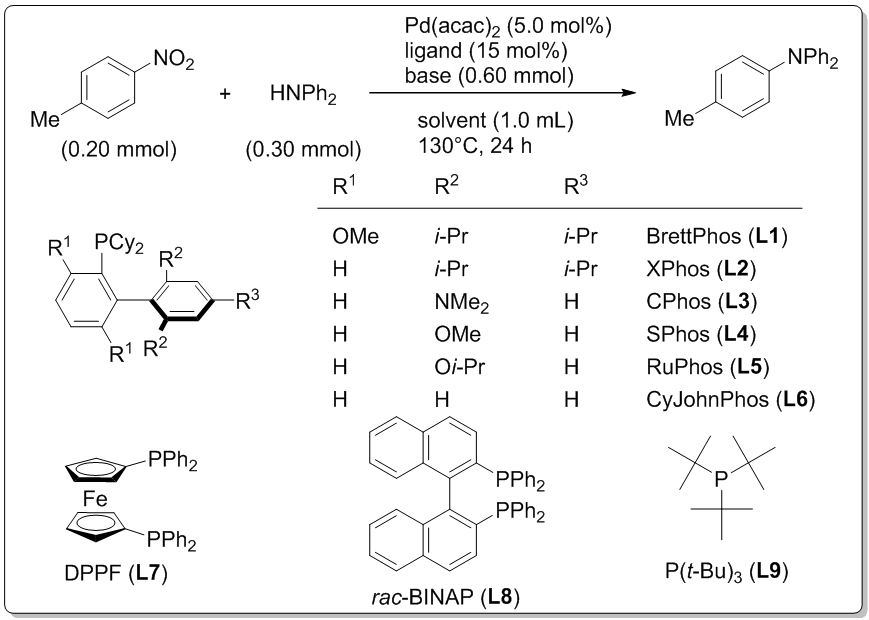
二、最佳反应条件优化
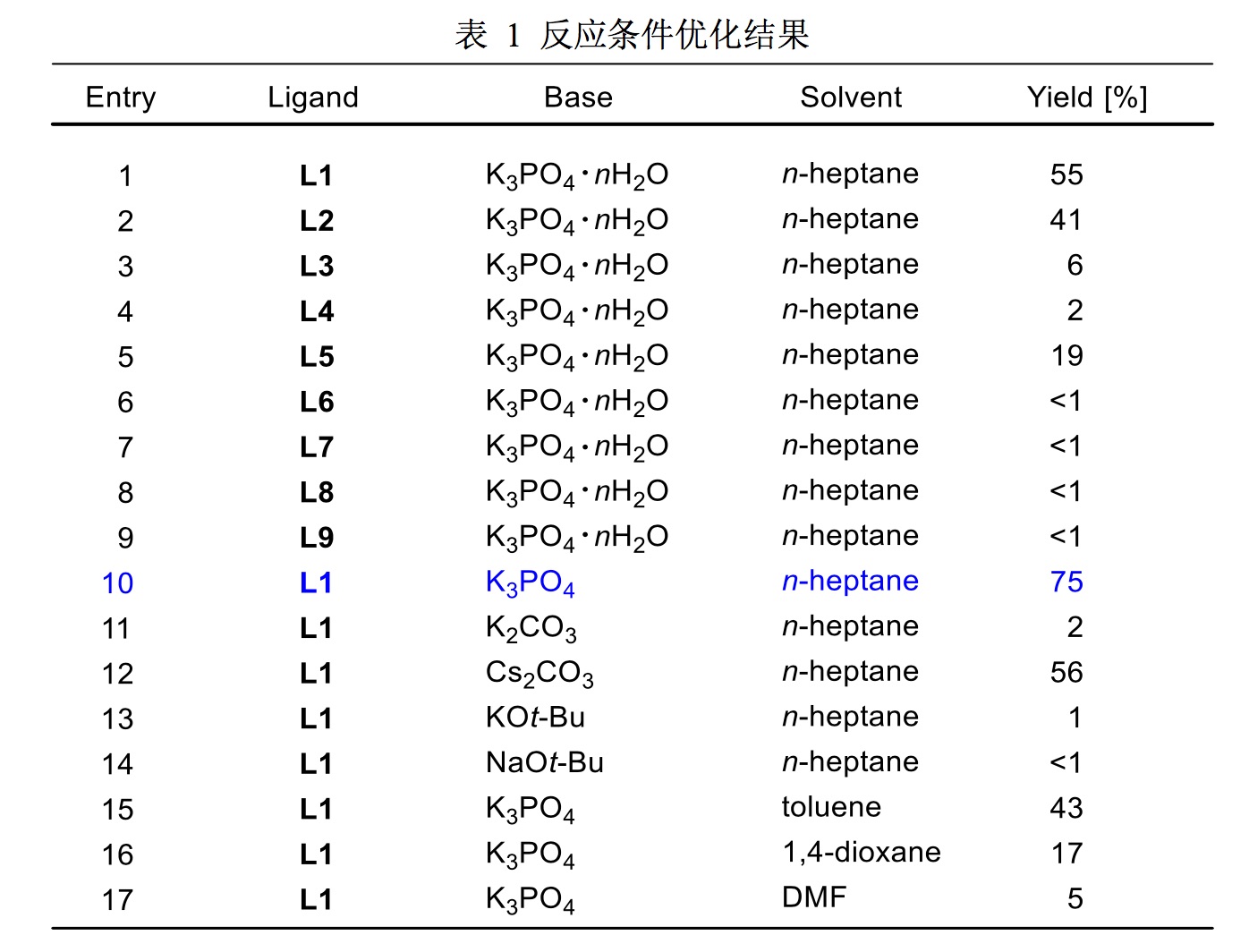
根据课题组近期关于芳硝基化合物参与的Suzuki-Miyaura偶联反应的研究[7],首先利用对硝基甲苯和二苯胺为原料建立模型反应(图1),K3PO4·nH2O和n-heptane分别作为碱和溶剂。首先对配体种类进行筛选优化,BrettPhos(L1)配体效果最佳(表1,Entry 1),产率可达55%。XPhos(L2)配体次之,其他三种配体的效果则相对较差(Entries 3-6)。传统的用于Buchwald-Hartwig反应的配体,例如DPPF,BINAP和P(t-Bu)3并不能得到预期的产物(Entries7-9)。随后对于碱的优化(Entries 10-14)中发现,使用预先干燥的K3PO4可将产率显著提高至75%(Entry 10),诸如K2CO3和Cs2CO3这样的弱碱,结果不是很理想(Entries 11-12);通常用于胺化反应的强碱,例如KOt-Bu和NaOt-Bu却不能在此反应中发挥作用(Entries 13-14),可能原因是硝基通过电子转移竞争还原反应的存在。反应在低极性甲苯溶剂中产率较好(43%;Entry 15),换成较大极性的1,4-二氧六环和DMF产率会大大降低(Entries 16-17)。
表1反应条件优化
三、反应底物拓展
确定最优反应条件后,研究人员对底物范围进行了探究。首先是芳硝基化合物,参与偶联的胺仍采用模型反应的二苯胺。不难看出,无论是未取代亦或是烷氧基单取代的底物,均可以得到中等及以上的收率(图2,3ba和3da),多取代的底物产率良好,接近80%(3ea)。缩酮保护的羰基化合物也可兼容反应(3fa,56%)。底物4-氟代硝基苯(3ga),偶联产物表明只有-NO2发生了亲核取代。应该指出的是,传统的芳香亲核取代反应中通常会把4-氟代硝基苯的氟原子转化为氨基官能团后再进行反应,正如底物9-(4-nitrophenyl)-9H-carbazole可以得到中等产率的预期产物(3ha)。适当改变反应条件,更换配体或碱的种类可以使大位阻的底物(3ja)以及Lewis碱型的官能团底物(3ka)顺利发生反应。与苯属同系物的萘,硝基在其或不同位置取代,均可以和二(4-叔丁基)苯胺发生反应(3mb)。芳杂环底物中,3-硝基吡啶和2-硝基噻吩都不能发生反应,仅1-甲基-5硝基吲哚可以反应,产率中等(3oa,52%)。
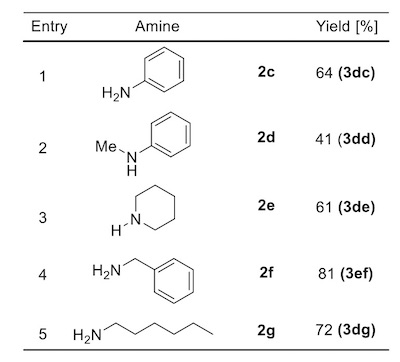
随后探究的是底物胺的适用性(图3),固定4-甲氧基硝基苯作为硝基部分偶联底物。K3PO4·nH2O和1,4-二氧六环作为碱和溶剂,这与最优反应条件有所不同,受限于胺在非极性溶剂中的溶解性,极性溶剂更为必要,而极性溶剂中K3PO4·nH2O较无水的K3PO4效果更佳。事实上,苯胺和4-甲氧基硝基苯偶联只得到了二芳基取代的仲胺,三芳基取代的叔胺并未检测到,证明产物3dc不能作为亲核试剂与硝基化合物再进行偶联,推测可能是位阻原因(Entry 1)。N-甲基苯胺(2d)作为底物产率中等,哌啶(2e)偶联可得叔胺,产率61%。3,5-二甲基硝基苯和苄胺(2f)可以81%的产率实现高效偶联,简单的烷基胺,例如正己胺(2g)也是反应的良好底物。在上述所有的情况里,均未发现三级胺产物的生成。
四、反应机理
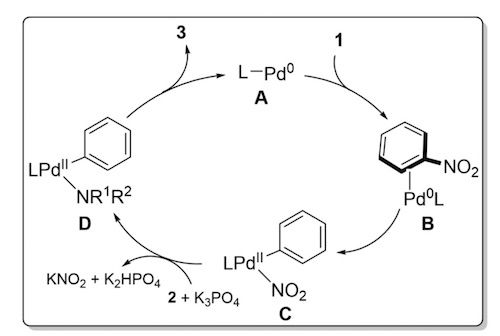
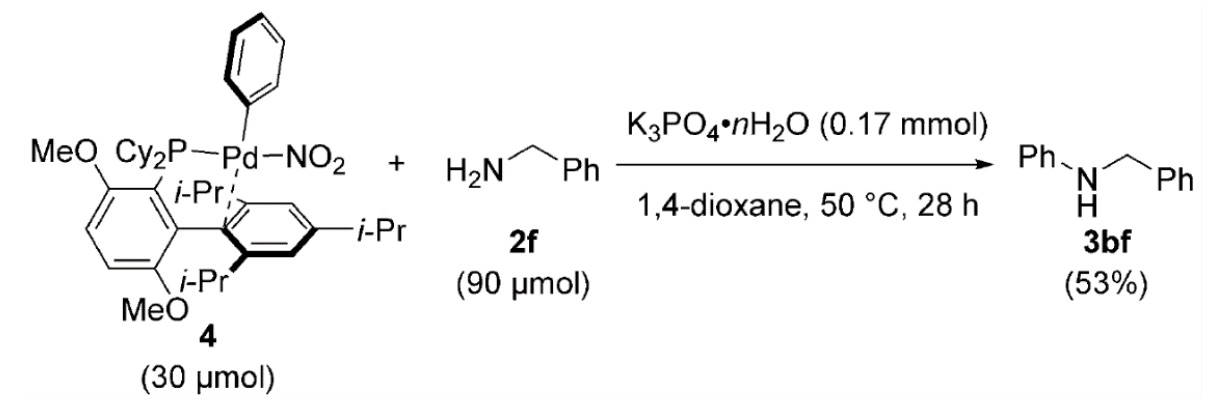
该反应可能的机理如图4所示。首先芳硝基化合物1与零价Pd络合物A反应生成2-芳烃Pd(0)络合物B,随后C-NO2键经过氧化加成得到中间体C。亲核性的胺在碱K3PO4存在下与C反应得到芳基Pd氨基络合物D,紧接着D发生还原消除生成目标化合物3,A也在这一步中得到循环。研究人员在之前实验基础上制备了氧化加成产物4,它和底物2f在50℃下反应(图5),产物收率是53%,这一实验结果有力地支持了上述机理。
五、结论
首例芳硝基化合物参与的Buchwald-Hartwig胺化反应得到报道,反应以Pd作为催化剂,底物适用范围广,产率中等及以上。对于断裂Ar-NO2键以实现其他新颖的交叉偶联反应,课题组正在深入研究中。
参考文献
- [1] For reviews, see: a) D. S. Surry, S. L. Buchwald, Angew. Chem. Int. Ed. 2008, 47, 6338.
- DOI:10.1002/anie.200800497; b) J. F.Hartwig, Acc. Chem. Res. 2008, 41, 1534. DOI: 10.1021/ar800098p
- [2] A. M. Norberg, L. Sanchez, R. E. Maleczka, Jr., Curr. Opin.Drug Discovery Dev. 2008, 11, 853.
- [3] J. P. Wolfe, S. L. Buchwald, J. Org. Chem. 1997, 62, 1264. DOI: 10.1021/jo961915s
- [4] B. C. Hamann, J. F. Hartwig, J. Am. Chem. Soc. 1998, 120, 7369. DOI: 10.1021/ja981318i
- [5] M. Tobisu, T. Shimasaki, N. Chatani, Angew. Chem. Int. Ed.2008, 47, 4866. DOI:10.1002/anie.200801447
- [6] N. Ono, The Nitro Group in Organic Synthesis,Wiley-VCH, New York, 2001.
- [7] M. R. Yadav, M. Nagaoka, M. Kashihara, R.-L. Zhong, T.Miyazaki, S. Sakaki, Y. Nakao, J. Am. Chem. Soc. 2017, 139,9423. DOI: 10.1021/jacs.7b03159
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!