京都大学・浜地格课题组利用吡啶肟(PyOx)作为有机催化剂和酰基供体N-酰基-N-烷基磺酰胺(NASA)成功地开发了酰化蛋白质修饰方法。并且进一步研究发现,该方法还能应用于在试管内对活体细胞进行修饰,而且选择性・稳定性・效率都非常好。
”Affinity-Guided Oxime Chemistry for Selective Protein Acylation in Live Tissue Systems”
Tamura, T.; Song, Z.; Amaike, K.; Lee, S.; Yin, S.; Kiyonaka, S.; Hamachi, I.* J. Am. Chem. Soc. 2017, 139, 14181–14191. DOI: 10.1021/jacs.7b07339
课题设定
在体内环境下,对蛋白质的选择性标记可以成为研究它们的结构,功能,行为等的有效地一种手段。选择性的标记,以铜催化的叠氮-炔烃的环化反应有起点,开发出了很多很多类似的运用不同金属催化的生体正交反应。
然而,这些手法经常存在以下问题,
- 使用活性很高的过渡金属,毒性比较高,不适用于活体细胞。
- 需要运用基因工程的一些方法导入一些非天然的结构作为反应的基点,多少回影响在生物体中的功能。
解决手法
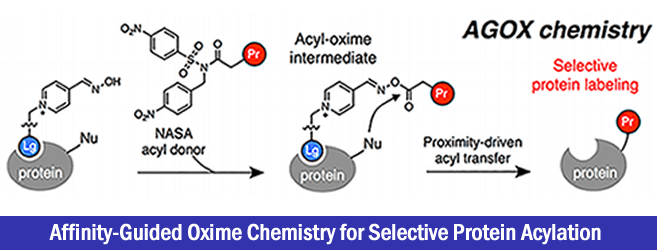
为了解决上述问题,作者开发了一种可以与蛋白质特异性配位的带有有机催化剂(DMAP)基团的配体组合,然后如下图所示,选择性的在DMAP近旁的蛋白质位点进行酰基化修饰、作者命名这种方法为「affinity-guided DMAP(AGD) chemistry」[1]。该case中,作者使用硫酯作为酰基化供体,通过对与蛋白质配位的配体上的DMAP基团进行亲核进攻,形成活性酰基吡啶鎓中间体。通过这种手法,反应选择性的发生在配体近旁的Lys上,实现了选择性的蛋白质标记。
然而,次AGD法还存在以下缺点、为了改善这些缺点,有必要开发别的有机催化剂/酰基化供体组合。
- 为了保证DMAP的亲核能力,该反应需要再碱性条件下进行(pH > 8)
- 硫酯的反应性高、需要低温进行反应,不然的话会引起非选择性的酰基化background副反应。
- 硫酯在体内环境条件下会分解。
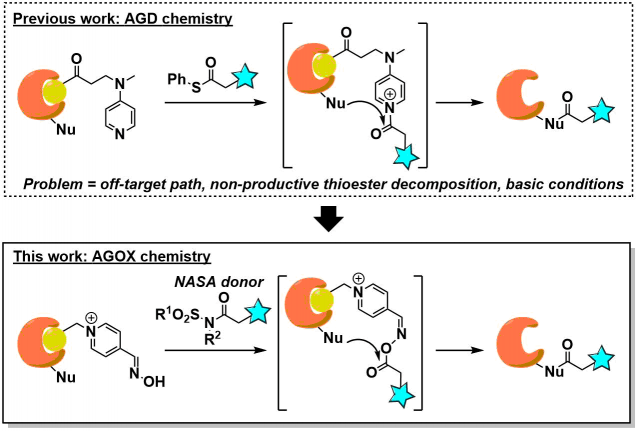
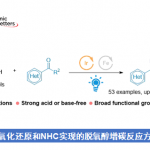
这一次介绍的论文中,作者等人报道了使用吡啶肟(PyOx)作为有机催化剂、N-酰基-N-烷基磺酰胺(NASA)作为酰基供体的「affinity-guided oxime (AGOX) chemistry」。
PyOx具有较强的碱性・亲核性,并且在中性条件下具有水解活性(pH7.2、37℃,以p-nitrophenylacetate为对象,PyOx活性为DMAP的9倍)。
另一方面NASA是已知的酰基化供体,容易受到亲核进攻,进场用在多肽故乡合成的C-末端的linker的结合部[2]。由于其非天然的结构,因此不惧酶降解,同时磺酰基部位(R1)与酰胺部位(R2)的结构可以tunning。另外,与硫酯相比亲电子性要低,可以有效抑制活性国强引起的background反应。
基本上concept与AGD一样。
设想的有效性验证
作者通过使用PyOx和NASA酰基供体的组合,使得各种蛋白质修饰成为可能。本论文中着重需要验证的有以下三点
- 只发生通过配体-PyOx催化剂介导的修饰反应、不发生Background反应
- 反应适用条件中性・37℃
- 应用于活体细胞的可能性(细胞膜上的蛋白质作为反应靶点)
而以下是具体的实验结果。
①FKBP12的生物素修饰
作者设计了与FKBP12配位的配体由(SLF)与PyOx连接的(SLF-PyOx)分子组成,以此配体作为催化剂,加上Bt-NASA作为生物素供体,尝试对蛋白质的Lys残基进行生物素修饰。在对NASA结构进行一定筛选后,发现含有p-硝基取代的结构显示出很好的反应活性。配体近旁的残基有两个分别是Lys44, Lys52、无论哪个残基都可以进行定量的修饰。
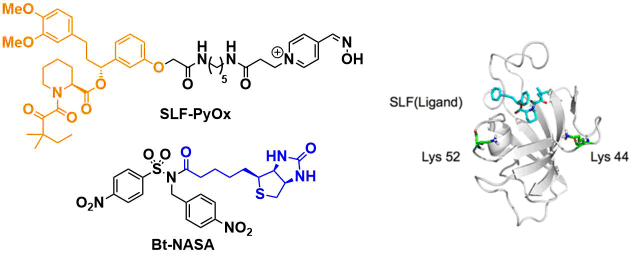
同时,作者还发现
- 配体中无PyOx的话修饰反应无法进行
- 当添加的SLF竞争反应剂FK506后,不会发生对SLF的修饰反应
- Bt-NASA的半衰期比其硫酯版的要长。
- 硫酯版的Bt-NASA会发生background反应
以上四点可以表明AGOX Chemistry显示出了其相对于AGD的特异性。
②对活细胞表面的碳酸酐酶(CAⅫ)进行荧光标记
作者尝试了对生物膜表面蛋白质CAⅫ进行荧光标记。在这个反应中,为了进一步提高催化剂活性,作者在配体(SA)上引入了两个PyOx分子形成SA-diPyOx作为催化剂使用。
SA-diPyOx与荧光标记试剂(FL-NASA)在pH7.2、37℃下雨细胞进行反应、SDS-PAGE监测显示48%的CA在3小时内被荧光标记。作为对照实验,利用SA-triDMAP,AGD chemistry手法,同样进行标记,发现发生了大量的非特异性的标记。另外,当加入配体-CAII结合阻断剂(EZA)后,修饰反应就无法进行了。
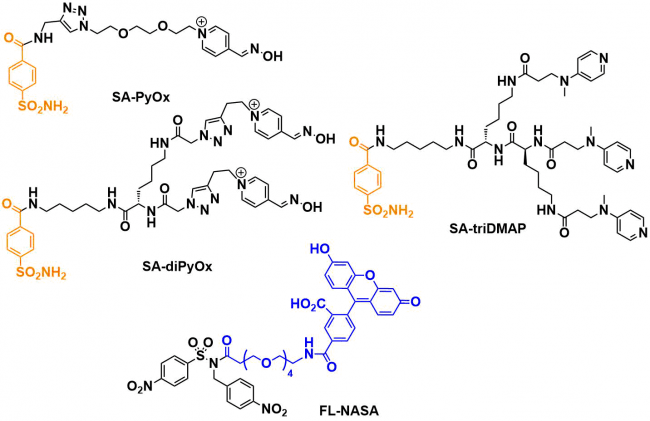 利用膜表面蛋白质的荧光标记手法,作者还通过激光褪色实验研究了它的扩散速率[3]。 发现结果与用GFP融合蛋白检测的值一致。
利用膜表面蛋白质的荧光标记手法,作者还通过激光褪色实验研究了它的扩散速率[3]。 发现结果与用GFP融合蛋白检测的值一致。
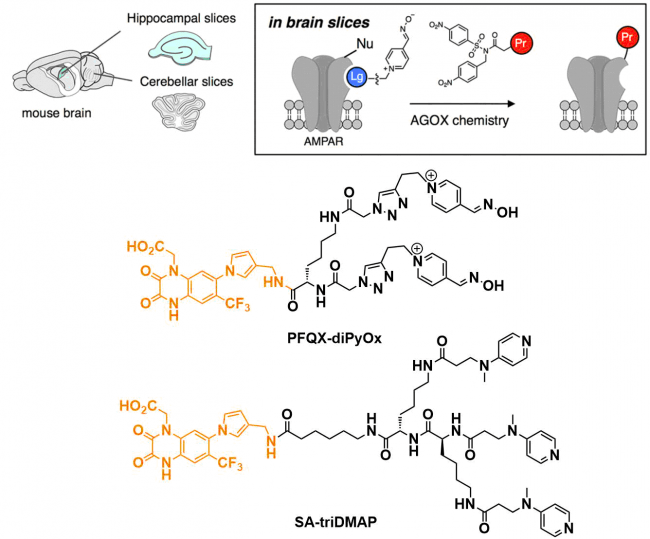
③对小鼠脑组织中的AMPAR进行荧光标记
做着准备了小鼠的脑切片组织、对神经细胞膜上含有的α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)型谷氨酸受体(AMPAR)进行了修饰反应。该反应中的配体用了PFQX。
对于该反应,作者也对比了AGD系(PFQX-triDMAP)与AGOX系(PFQX-diPyOx)、通过SDS-PAGE分析表明只有AGOX系实现了有效标记。
Comment
- 与以前的报道相比,这次的新方法的选择性大大的提高了,并且可以适用于活细胞体系。另外可以选择的配体·酰基化供体的种类也增多。
- 下一个课题很有可能是应用于活細胞「内」的化学反应。这一点作者也在文中说了,尚未达成,而很有可能是因为PyOx的吡啶部的阳离子性不利于透过细胞膜,而这一难点也会是下一个需要改善突破的点。
参考文献
- (a) Koshi, Y.; Nakata, E.; Miyagawa, M.; Tsukiji, S.; Ogawa, T.; Hamachi, I. J. Am. Chem. Soc. 2008, 130, 245. DOI: 10.1021/ja075684q (b) Wang, H-x.; Koshi, Y.; Minato, D.; Nonaka, H.; Kiyonaka, S.; Mori, Y.; Tsukiji, S.; Hamachi, I. J. Am. Chem. Soc. 2011, 133, 12220. DOI: 10.1021/ja204422r (c) Hayashi, T.; Sun, Y.; Tamura, T.; Kuwata, K.; Song, Z.; Takaoka, Y.; Hamachi, I. J. Am. Chem. Soc. 2013, 135, 12252. DOI: 10.1021/ja4043214 (d) Hayashi, T.; Yasueda, Y.; Tamura, T.; Takaoka, Y.; Hamachi, I. J. Am. Chem. Soc. 2015, 137, 5372. DOI: 10.1021/jacs.5b02867 (d) Song, Z.; Takaoka, Y.; Kioi, Y.; Komatsu, K.; Tamura, T.; Miki, T.; Hamachi, I. Chem. Lett. 2015, 44, 333. doi:10.1246/cl.141065
- Heidler, P.; Link, A. Bioorg. Med. Chem. 2005, 13, 585. doi:10.1016/j.bmc.2004.10.045
- (a) Soumpasis, D. M. Biophys. J. 1983, 41, 95. (b) Sprague, B. L.; McNally, J. G. Trends Cell Biol. 2005, 15, 84. doi:10.1016/j.tcb.2004.12.001
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


















No comments yet.