作者:石油醚
导读:
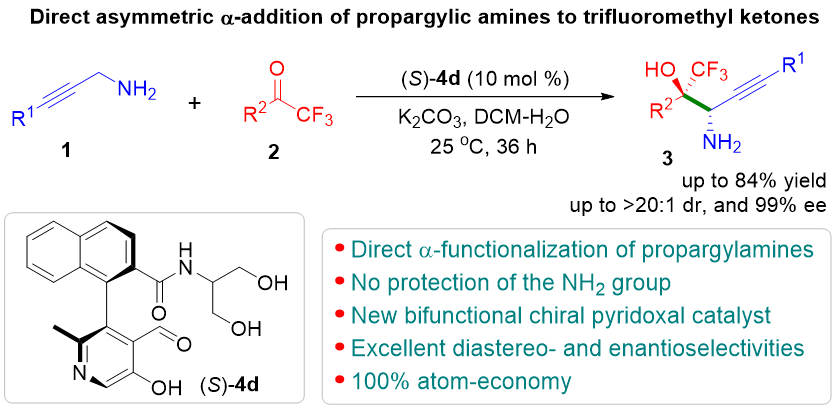
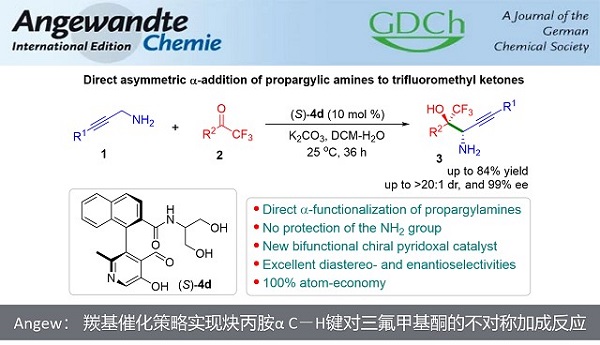
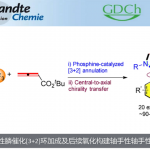
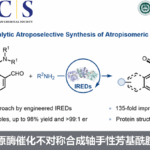
近日,上海师范大学赵宝国教授、陈雯雯副研究员团队基于羰基催化策略,利用发展的手性吡哆醛催化剂,成功实现了未保护的炔丙胺a C-H键对三氟甲基酮的不对称加成反应,以良好的收率和优秀的立体选择性 (85-99% ee, 7:1 ~ >20:1 dr)构建了一系列手性炔基取代的邻氨基醇类化合物,拓展了羰基催化的适用范围。
“Direct Asymmetric α-C-H Addition of N-unprotected Propargylic Amines to Trifluoromethyl Ketones by Carbonyl Catalysis.
Pengwei Ji, Xiaopei Liu, Jiwei Xu, Xu Zhang, Jianhua Guo, Wen-Wen Chen* and Baoguo Zhao*
Angew. Chem. Int. Ed. 2022, e202206111. doi: 10.1002/anie.202206111”
正文:
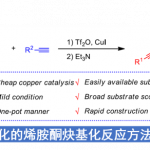
手性炔丙胺及其衍生物是许多药物活性分子以及天然产物的重要结构骨架,在医药、农药和材料等领域中有广泛的应用。炔丙胺α C-H键对亲电试剂直接不对称加成是构建α-取代手性炔丙胺化合物的高效策略。但由于炔丙胺α C-H键的酸性低 (pKa ~ 42.6),难以去质子化形成相应的碳负离子中间体;同时,炔丙胺中裸露的氨基以及炔基均为高活性官能团,会干扰反应或毒化催化剂。因此,发展炔丙胺α C-H键对亲电试剂的不对称加成反应具有挑战性。
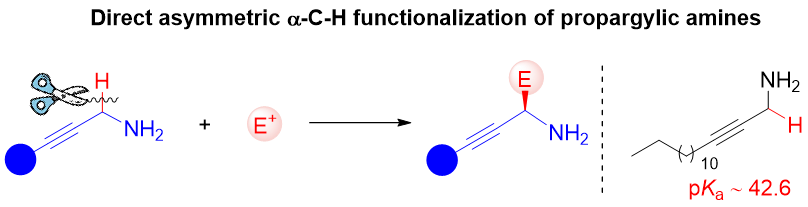
羰基催化是伯胺在未保护条件下,一步实现α C-H键不对称官能团化的有效策略。但是,羰基催化目前主要适用于高活性的伯胺,例如α-氨基酸(pKa ~ 24)和2-吡啶甲胺,α C-H键酸性低的伯胺,如炔丙胺,仍然是挑战性的底物。
上海师范大学赵宝国教授、陈雯雯副研究员团队基于羰基催化策略,利用发展的手性吡哆醛催化剂,成功实现了未保护的炔丙胺a C–H键对三氟甲基酮的不对称加成反应,以良好的收率和优秀的立体选择性 (85-99% ee, 7:1 ~ >20:1 dr)构建了一系列手性炔基取代的邻氨基醇类化合物,拓展了羰基催化的适用范围。
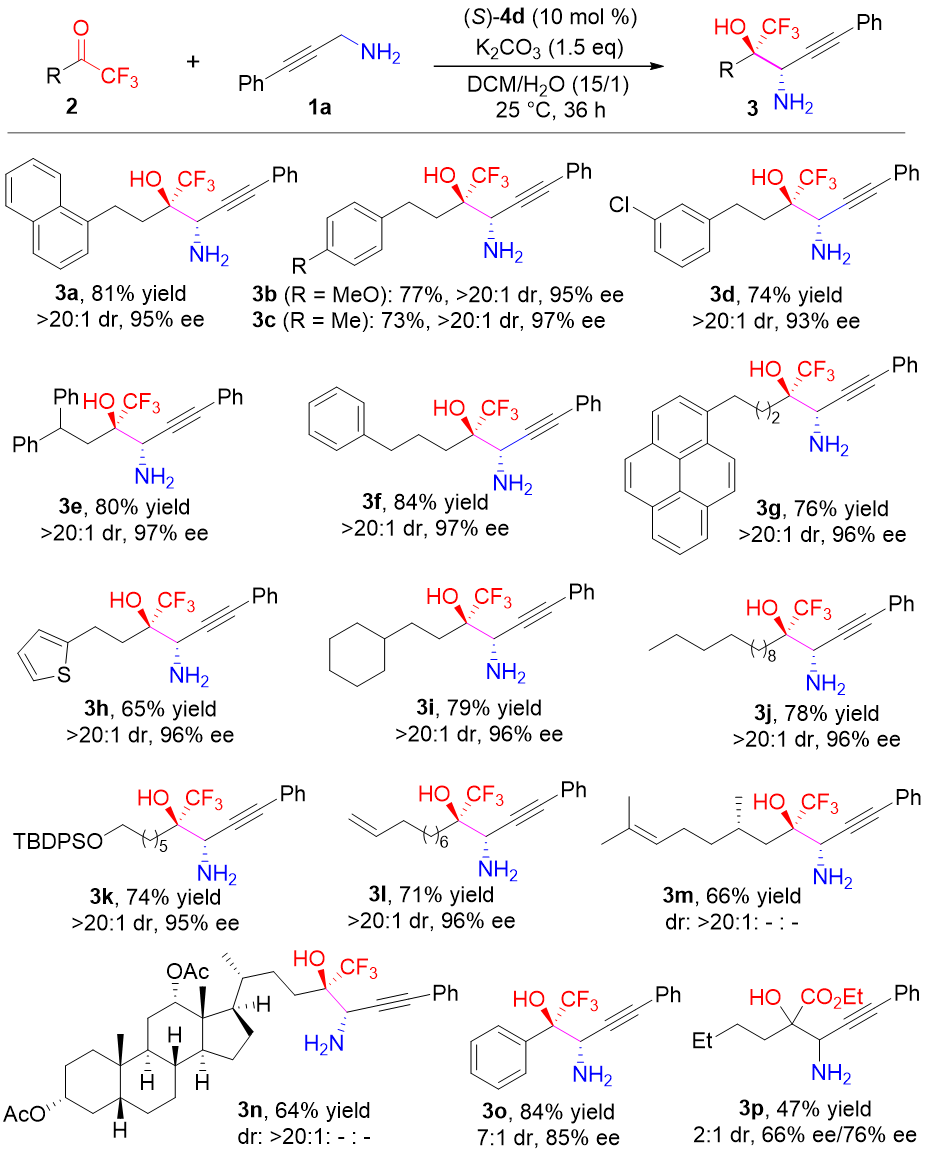
经过一系列条件筛选,作者在最优条件下首先考察了三氟甲基酮底物。烷基三氟酮连接不同的官能团,如芳基、杂环、硅基或烯基等官能团以及手性底物均具有良好的收率及优秀的立体选择性。
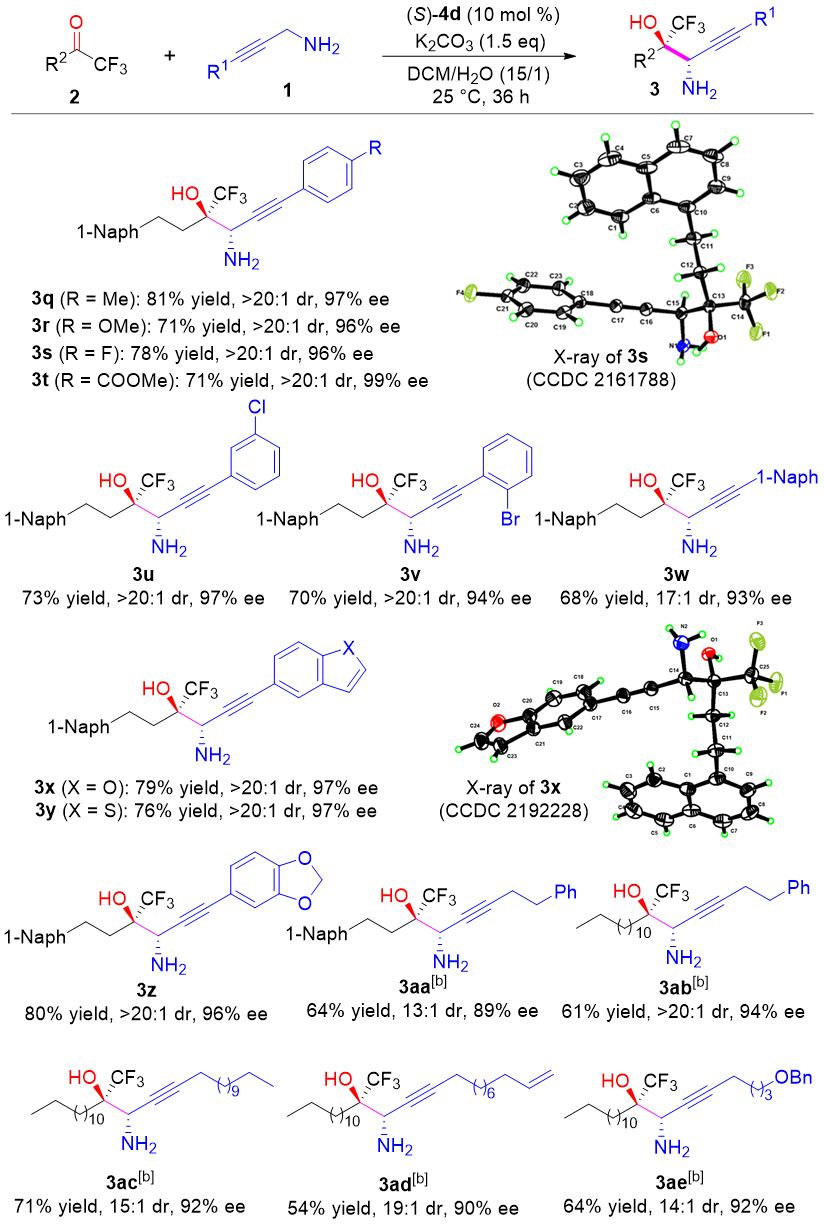
作者也考察了炔丙胺底物。对于富电子或缺电子芳基炔丙胺均可保持良好的反应活性及立体选择性。值得关注的是,烷基炔丙胺的反应效果也可以得到保持。
在前期的研究基础上,作者提出了如下机理:首先炔丙胺1a与手性吡哆醛催化剂4d形成亚胺7,在碱的作用下去质子化形成碳负离子中间体8,再与三氟甲基酮2发生不对称加成反应,经水解得到目标产物3,同时再生吡哆醛催化剂4d完成催化循环。此外,作者也通过计算提出了下图所示的可能的过渡态9,对反应的立体选择性控制进行了解释。
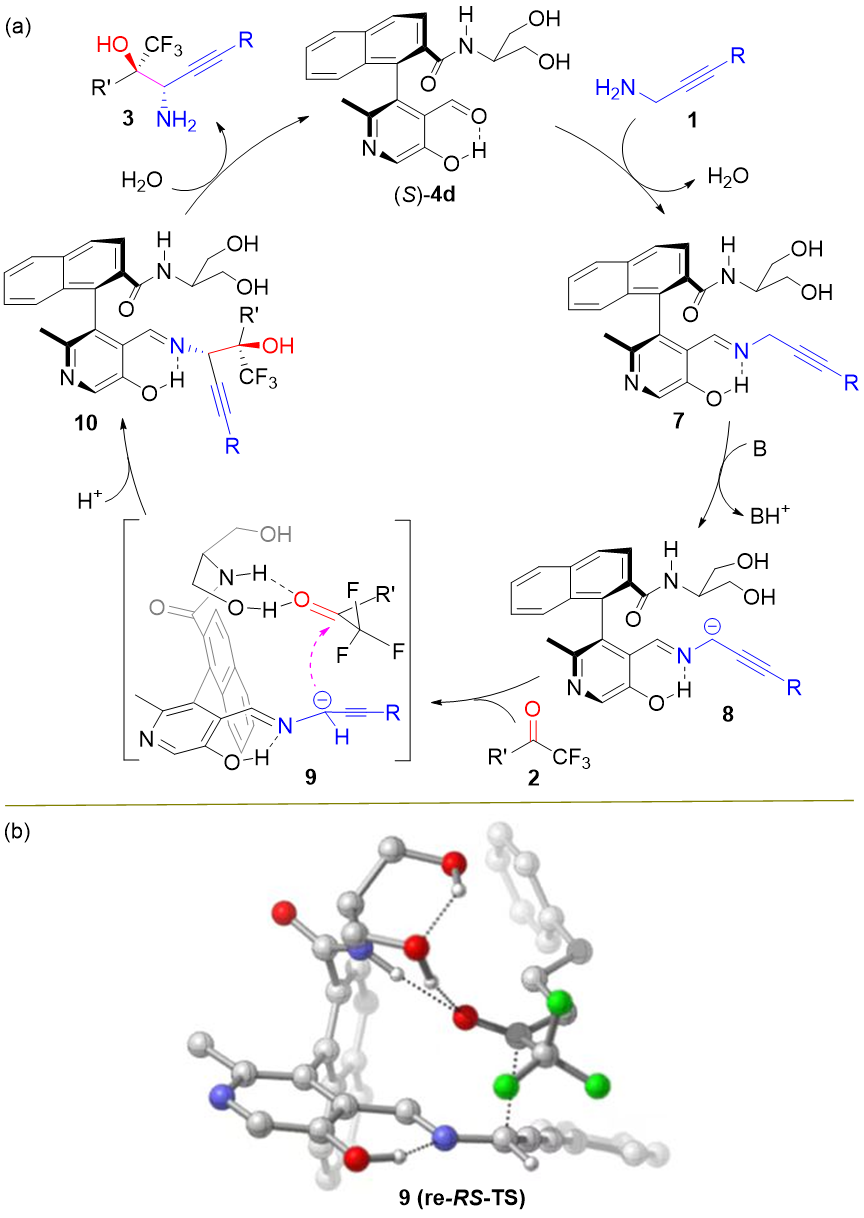
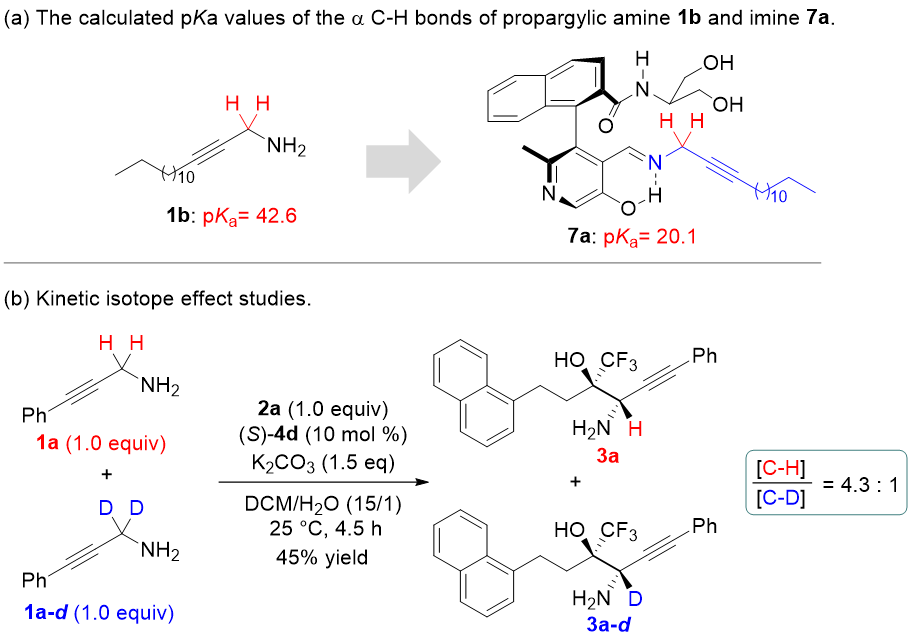
计算结果显示,炔丙胺α C-H键的pKa值为42.6,具有较低的酸性,难以发生去质子化形成活性中间体。当炔丙胺与吡哆醛催化剂形成亚胺后,α C-H键的pKa变为20.1,进而能在温和条件下发生去质子化。反应存在明显的同位素效应,KIE值为4.3,表明炔丙胺α C-H键去质子化为该反应的决速步。
总结
上海师范大学赵宝国教授、陈雯雯副研究员团队利用新开发的手性吡哆醛催化剂,成功实现了炔丙胺的a C-H键对三氟甲基酮的直接不对称加成反应,以良好的收率和优秀的立体选择性构建了一系列手性的炔基取代的β-氨基醇化合物。吡哆醛催化剂通过与炔丙胺形成亚胺,将炔丙胺α C-H键的酸性提升了1022倍,展示了吡哆醛催化剂强大的活化能力。研究工作也拓展了基于维生素B6的仿生催化化学。
(赵宝国教授供稿)
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载














No comments yet.