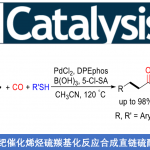
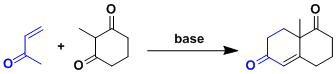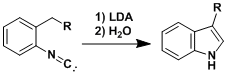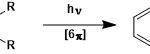- 概要
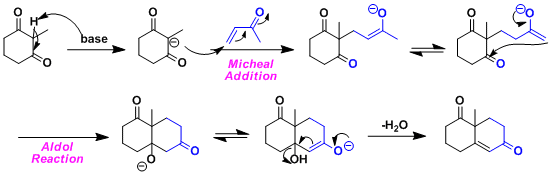
通过分子间米歇尔反应→分子内羟醛缩合,最终得到六圆环化合物的一种合成方法。
必须由烯酮做底物,因此主要的副反应就是烯酮的自聚。
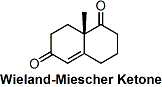
被称为Wieland-Miesche具有良好结晶性的Robinson环化物是一种非常有用的合成中间体。甾体・类萜类天然产物合成的及其重要的起始物。在脯氨酸催化作用下、可以大量制备具有光学活性的物质(Hajos-Parris-Eder-Sauer-Wiechert反応)。
- 基本文献
・DuFeu, E .C.; McQuillin, F. J.; Robinson, R. J. Chem. Soc. 1937, 53.
・Wieland, P.; Miescher, K. Helv. Chim. Acta 1950, 33, 2215. doi:10.1002/hlca.19500330730
・Bergmann, E. D.; Gingberg, D.; Pappo, R. Org. React. 1959, 10, 179.
・Balasubramanian, K.; John, J. P.; Swaminathan, S. Synthesis 1974, 51.
・Gawley, R. E. Synthesis 1976, 777. doi:10.1055/s-1976-24200
・Jung, M. E. Tetrahedron 1976, 32, 3. doi:10.1016/0040-4020(76)80016-6
- 反应机理
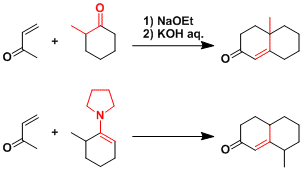
- 反应实例
在碱性条件下加热,重排得到的烯基碳负离子开始引发反应进行。用烯胺反应得到它的位置异构产物。
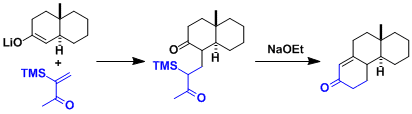
Michael受体的α位引入硅基团、提高生成的碳负离子的稳定性的同时,抑制了烯基酮的自聚合,从而提高罗宾森环化反应的产率。
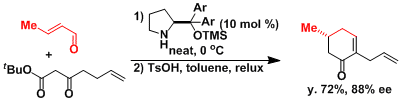
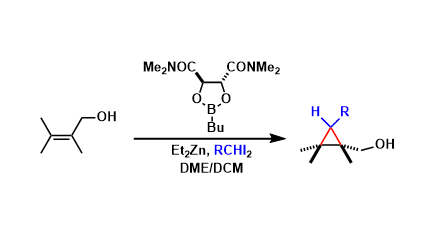
有机分子催化的取代环己酮的不对称合成[1]
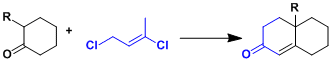
用1,3-二氯-cis-2-丁烯代替容易发生自聚的甲基乙烯基酮(Wichterle変法)。[2]
- 实验步骤
- 实验技巧
- 参考文献
[2] (a) Wichterle, O. et al. Collect. Czech. Chem. Commun. 1948, 13, 300. (b) Kobayashi, M.; Matsumoto, T. Chem. Lett. 1973, 957. doi:10.1246/cl.1973.957 (c) Yoshioka, H.; Takasaki, K.; Kobayashi, M.; Matsumoto, T. Tetrahedron Lett. 1979, 20, 3489. doi:10.1016/S0040-4039(01)95442-5 (d) Review: Hudlicky, M. Collect. Czech. Chem. Commun. 1993, 58, 2229.