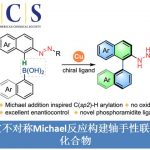
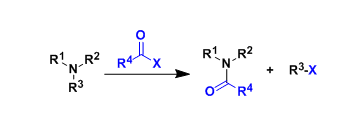
过渡金属催化不对称烯丙基烷基化反应广泛用于药物以及农药化合物的合成中,因而该反应成为化学家们关注的重点。其中,关于过渡金属催化炔丙基碳酸酯与末端炔丙醇衍生物或内部炔烃类似物的区域选择性炔丙基化反应已经取得了不错的进展(Scheme 1A)。Mitsudo课题组报道了Ru催化硫醇和炔丙基碳酸酯的S-炔丙基化反应生成一系列炔丙基硫化物及其衍生物[1]。此外,钯可催化炔丙基碳酸酯发生消旋化的亲核取代反应,生成炔丙基化产物、丙二烯产物以及1,3-二烯产物[2]。最近,Murakami课题组报道了Ni催化炔丙基碳酸酯与苯酚反应,生成2-芳氧基-1,3-二烯[3]。总的来说,内部炔烃与炔丙基碳酸酯的不对称炔丙基烷基化反应仍然面临巨大挑战(Scheme 1B)。在上述研究背景的基础上,中国科学技术大学郭昌课题组报道了Ni/Cu协同催化炔丙基碳酸酯和醛亚胺酯的不对称炔丙基烷基化反应,能以优秀的区域选择性和对映选择性得到一系列含α-季碳炔丙基氨基酯。相关研究成果发表于
“Cooperative Ni/Cu-Catalyzed Asymmetric Propargylic Alkylation of Aldimine Esters”
Peng, L.; He, Z.; Xu, X.; Guo, C.* Angew. Chem. Int. Ed. 2020, Early View. DOI: 10.1002/anie.202005019
Scheme 1 背景研究
论文作者介绍
郭昌教授
教育与科研经历
- 2018.03-至今,特任教授,博士生导师,合肥微尺度物质科学国家研究中心
- 2017.02-2018.02,特任研究员,中国科学技术大学,合肥微尺度物质科学国家研究中心
- 2013.08-2017.01,博士后,德国明斯特大学
- 2007.09-2013.06,博士,中国科学技术大学
- 2003.08-2007.06,学士,中国科学技术大学
研究方向
研究工作主要集中在不对称合成方向,以新型不对称催化研究为基础,发展惰性化学键的直接手性官能团化反应,建立手性催化模型,提高反应活性与选择性,并将这些方法学用于天然产物的合成,发展高效、原子经济性和环境友好的现代有机合成化学。
论文概要
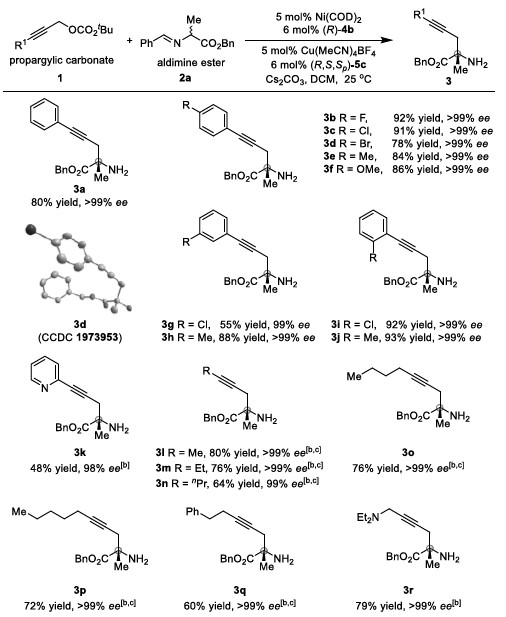
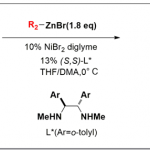
以炔丙基碳酸酯1a和醛亚胺酯2a为模板底物,作者对催化剂、碱、溶剂等反应条件反复筛选,确定最优反应条件:5 mol% Ni(COD)2 和6 mol% (R)-4b为Ni催化剂,5 mol% Cu(MeCN)4BF4 和6 mol% (R,S,Sp)-5c为Cu催化剂,15 mol% Cs2CO3为碱,DCM为溶剂,在25℃条件下反应24小时,能以80%的收率和>99%的对映选择性得到产物3a。
在最优反应条件下,作者对炔丙基碳酸酯的底物范围进行了考察(Table 1)。各种吸电子或给电子芳基取代的炔丙基碳酸酯能较好的适应反应条件,能以中等至优秀的收率和优秀的对映选择性得到相应α-季碳炔丙基氨基酯。同时,活性较低的脂族族炔丙基碳酸酯也能与醛亚胺酯反应,能以良好的收率和优秀的对映选择性得到相应产物。
Table 1 炔丙基碳酸酯的底物扩展
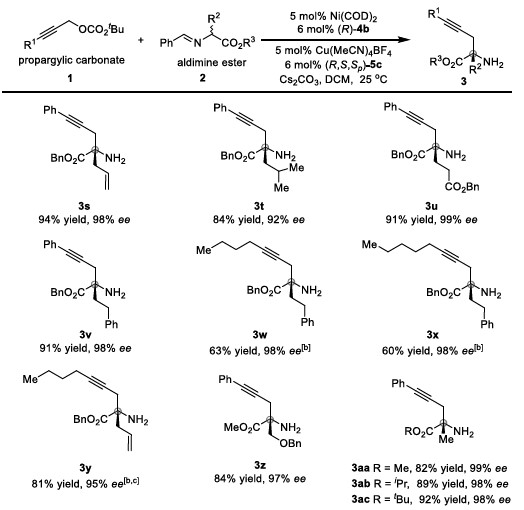
紧接着,作者考察了醛亚胺酯的底物范围(Table 2)。各种取代的醛亚胺酯均能较好的适应反应条件,能以良好至优秀的收率和优秀的对映选择性得到相应α-季碳炔丙基氨基酯,且不同取代的酯对反应的影响不大。
Table 2 醛亚胺酯的底物范围
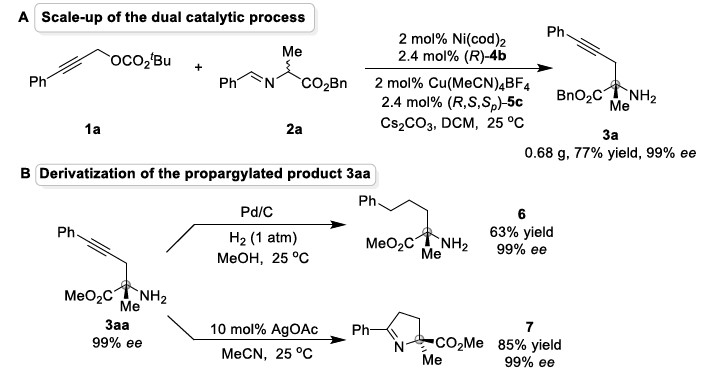
为了证明反应的应用潜力,作者进行了扩大化反应和衍生反应(Scheme 2)。将催化剂用量降至2 mol%,扩大化反应也能正常进行。3aa的炔基部分可被还原为饱和手性胺酯6。同时,3aa在AgOAc的MeCN溶液中可发生环化反应生成手性亚胺7。
Scheme 2 衍生反应
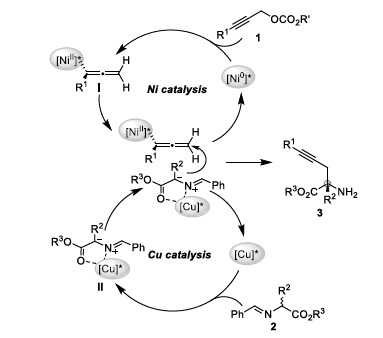
根据实验结果,作者推测可能的反应机理(Figure 1):首先,Ni催化炔丙基碳酸酯1发生脱羧反应,生成亲电的烯基基镍配合物I。同时,Cu催化醛亚胺酯2生成亲核的金属化甲亚胺叶立德II。中间体II和中间体I依次发生亲核加成反应和酸水解反应生成炔丙基化产物3。
Figure 1 反应机理
论文总结评价
中国科学技术大学郭昌课题组报道了Ni/Cu协同催化炔丙基碳酸酯和醛亚胺酯的不对称炔丙基烷基化反应。在温和的反应条件下,各种取代的炔丙基碳酸酯和醛亚胺酯均能较好地适应反应条件,能以优秀的区域选择性和对映选择性得到一系列含α-季碳炔丙基氨基酯。
参考文献
- [1] Kondo, T.; Kanda, Y.; Baba, A.; Fukuda, K.; Nakamura, A.; Wada, K.; Morisaki, Y.; Mitsudo, T. J. Am. Chem. Soc. 2002, 124, 12960-12961. DOI: 10.1021/ja027750o
- [2] (a) Locascio, T. M.; Tunge, J. A. Chem. Eur. J.. 2016, 22, 18140-18146. DOI: 10.1002/chem.201603481 (b) Kalek, M.; Stawinski, J. Adv. Synth. Catal. 2011, 353, 1741-1755. DOI: 10.1002/adsc.201100119
- [3] Ishida, N.; Hori, Y.; Okumura, S.; Murakami, M. J. Am. Chem. Soc. 2019, 141, 84-88. DOI: 10.1021/jacs.8b11159
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!




















No comments yet.