本文作者:石油醚
导读
近日,大连化物所陈庆安研究员团队在国际知名期刊 Nature Catalysis上发表文章,报道了由廉价金属镍和大位阻氮杂环卡宾配体组成的催化体系,实现了大宗化学品异戊二烯的不对称杂芳基化环状二聚,高立体选择性合成了一类非天然手性环状单萜骨架。
“Nickel-catalysed asymmetric heteroarylative cyclotelomerization of isoprene.
Gong Zhang, Chao-Yang Zhao, Xiang-Ting Min, Ying Li, Xiang-Xin Zhang, Heng Liu, Ding-Wei Ji, Yan-Cheng Hu & Qing-An Chen*
Nat. Catal., 2022, 5, 708-715. doi: 10.1038/s41929-022-00825-z
正文
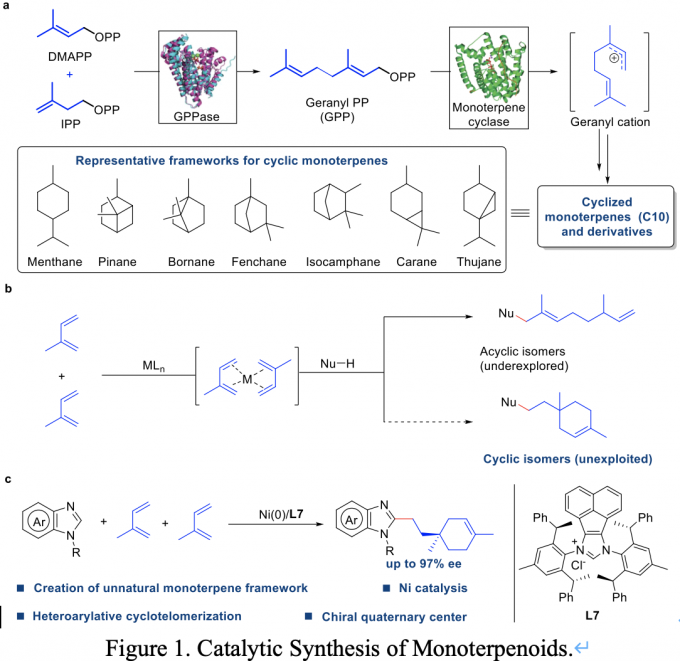
萜类化合物是自然界中最大、结构最多样化的一类天然产物,几乎存在于所有生物中,具有重要的生理功能[1]-[3]。在自然界中,萜类化合物的生物合成首先是异戊烯基焦磷酸酯和二甲基烯丙基焦磷酸酯在香叶酰焦磷酸酯合成酶作用下,缩合形成香叶焦磷酸酯。接下来,通过一个关键中间体(香叶基阳离子),在不同萜类合成酶的作用下,形成不同的萜类化合物(Figure 1)[4]-[7]。虽然大自然已经进化了数百万年,但是,由酶介导的香叶基碳正离子经过重排、环化所形成的环状单萜骨架是有限的,代表性环状单萜骨架如柠檬烯、蒎烯、樟脑、松油醇、卡琳和薄荷醇等,在学术界和工业界有着十分重要的应用,如天然产物的合成,香水和制药等行业。 因此,利用人工催化体系,通过仿生催化的策略,实现新的非天然环状单萜骨架的创造性合成具有重大的学术价值和广泛的实际应用价值。同时也将面临巨大的困难和挑战。
作为廉价易得且来源广泛的一类大宗化学品,异戊二烯是合成萜类化合物的理想前体[8]-[10]。在1967年,Smutny和Takahashi报道了第一例1,3-丁二烯与亲核试剂的调聚反应[11]。之后,Beller, Finn, Réau, Navarro和Carbó等人相继报道了异戊二烯与不同亲核试剂的选择性调聚反应。尽管关于异戊二烯的区域选择性调聚已经有报道,但其主要局限于线性调聚,且关于手性环状调聚的例子还未见报道。
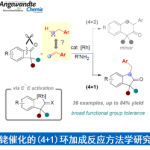
杂环化合物,例如嘌呤、咪唑等,作为一类重要的合成砌块广泛存在于天然产物以及药物分子中,具有重要的药理及生理活性。针对杂环化合物进行官能团化修饰是药物研发以及病理学研究的重要途经。其中,由过渡金属催化的C-H键活化是一类兼具原子以及步骤经济性的方法。最近,Ellman, Cavell, Ye, Ackermann和Cramer等人报道了镍催化的简单烯烃的氢芳基化反应[12]-[17]。受这些研究结果的启发,研究者设想能否实现简单异戊二烯的不对称环状二聚。作为最简单的不对称共轭二烯,其参与化学反应也具有很多的困难和挑战。首先,异戊二烯是非活化烯烃,这就导致了其活性低且需要的反应条件苛刻。其次,异戊二烯的共轭双键具有的相似的电子效应和位阻效应,使得反应的区域选择性和立体选择性难以有效的控制。最后。之前的工作表明,异戊二烯的直接氢官能化比亲核二聚反应更容易实现,而异戊二烯具有四个反应位点,以芳烃与异戊二烯的偶联为例,有六种可能的加成方式,进一步的双键异构化可以产生14个区域异构体,使得反应的选择性调控更加困难。
近日,大连化物所陈庆安研究员团队通过使用廉价金属镍与大位阻氮杂环卡宾组成的催化体系,实现了一类非天然环状单萜骨架的创造性合成,将廉价易得的大宗化学品异戊二烯转化为高附加值单萜类化合物。最高产率可达98%,最高对应选择性可达97%。
Figure 1. Catalytic Synthesis of Monoterpenoids.
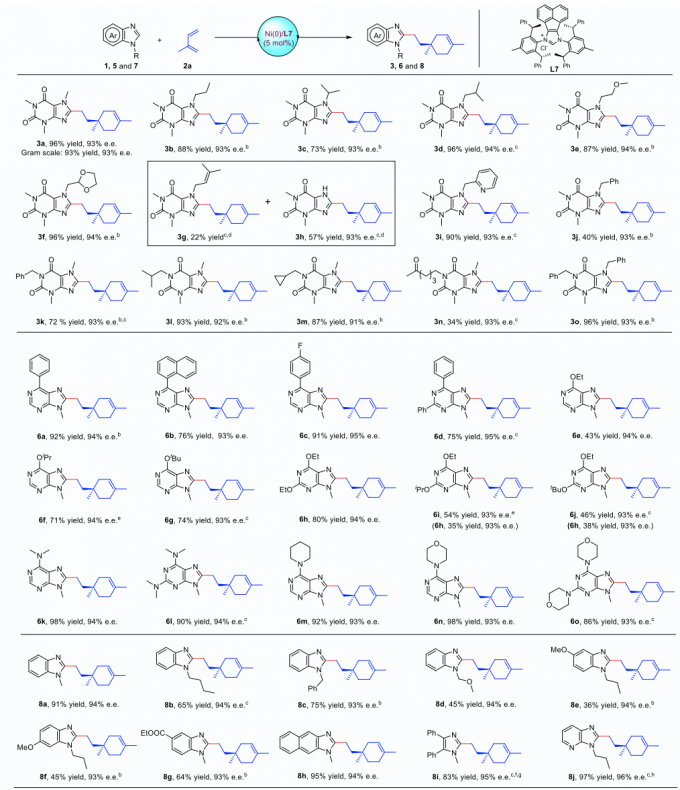
首先,作者选择咖啡因1a和异戊二烯2a作为模板底物,选择廉价金属镍作为催化剂,甲苯作为溶剂。通过筛选不同的配体,最终确定L7为最优配体,反应温度为100 ℃, 在当量碱存在下,最终获得96%产率的目标产物,对映选择性为93%。
Figure 2. Substrate scope of purines, adenines and imidazoles.
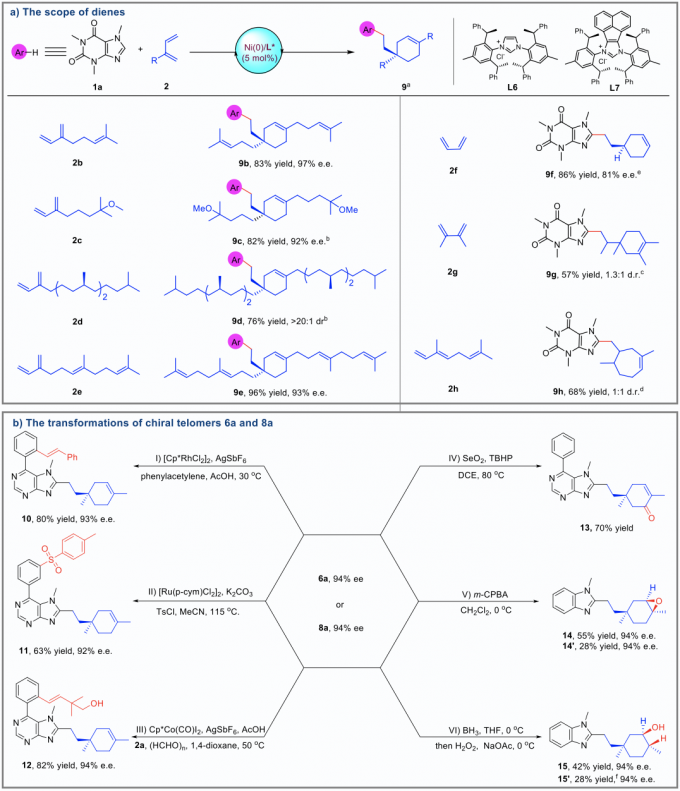
接下来,在最优反应条件下,作者对底物范围进行了拓展,各种取代的咖啡因类似物、嘌呤类似物以及咪唑类似物均可以在该反应体系下很好的兼容(Figure 2)。同时,将异戊二烯替代为其他长链萜烯,反应也可以很好的兼容。为了验证该反应的应用价值,作者针对手性调聚物进行了进一步转化,产物的对应选择性都能很好的保持(Figure 3)。
Figure 3. Substrate scope of other conjugated dienes and transformation of chiral telomers
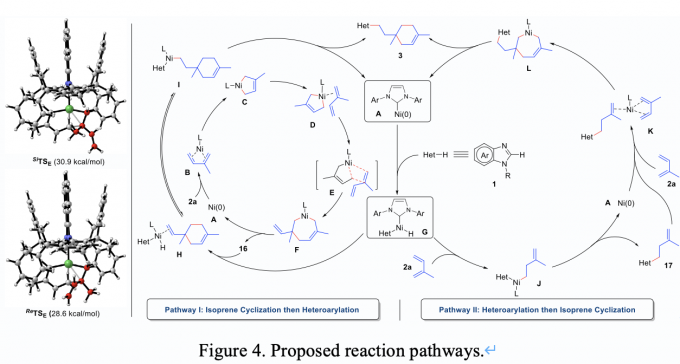
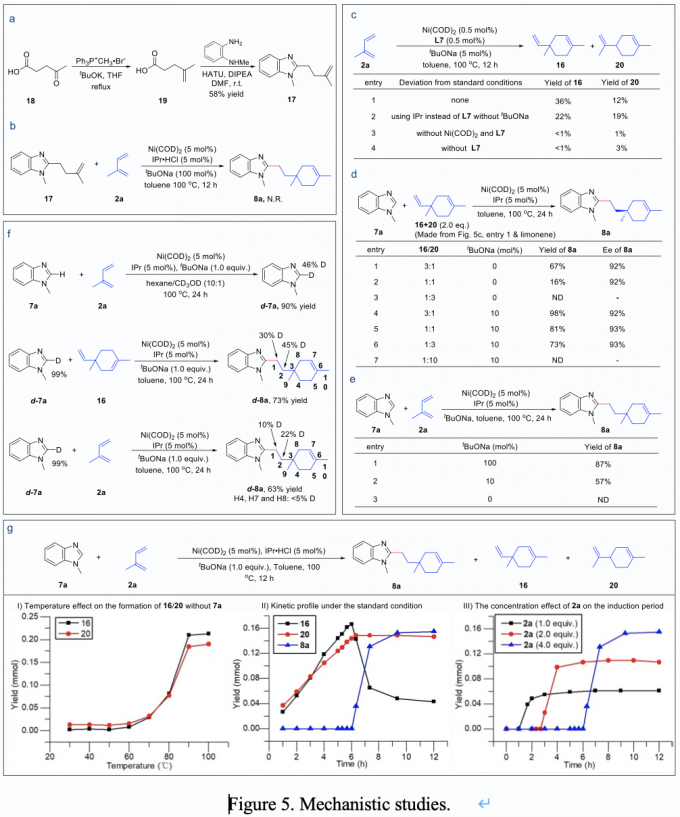
最后,作者对反应的机理进行了详细的探究。作者提出了两种反应机理,一种是异戊二烯先与亲核试剂发生氢杂芳基化,再与第二分子异戊二烯发生环化反应;一种为异戊二烯先进行自身的二聚,形成手性二聚体,再与亲核试剂发生氢杂芳基化(Figure 4)。为了验证上述两种机理,作者首先合成了中间体17,将其投入到标准反应条件中,发现没有目标产物生成,从而排除了反应路径II。在不加亲核试剂的条件,成功分离到手性二聚体16,将其投入到标准反应条件中,得到目标产物8a,对映选择性也得到很好的保持。最后,作者进行了反应的动力学监测,发现该反应在起始阶段并没有目标产物8a产生,但是二聚体16和20会大量产生,待异戊二烯消耗殆尽,反应开始进行第二阶段,生成目标产物8a(Figure 5)。
Figure 4. Proposed reaction pathways.
Figure 5. Mechanistic studies.
总结:
大连化物所陈庆安研究员团队开发了一种新方法,实现了简单异戊二烯的高附加值转化,合成了一类新颖的手性环状单萜骨架。机理研究表明,该反应首先在镍催化下,发生异戊二烯的对映选择性二聚,再在镍催化下发生氢杂芳基化反应,最终得到目标产物。
(陈庆安研究员供稿)
相关链接:
陈庆安研究员课题组主页:http://www.lbcs.dicp.ac.cn/
参考文献:
- [1] E. Oldfield, F. Y. Lin, Angew. Chem. Int. Ed. 2012, 51, 1124. doi: 10.1002/anie.201103110.
- [2] Z. G. Brill, M. L. Condakes, C. P. Ting, T. J. Maimone, Chem. Rev. 2017, 117, 11753. doi: 10.1021/acs.chemrev.6b00834.
- [3] H.-F. Tu, X. Zhang, C. Zheng, M. Zhu, S. L. You, Nat. Catal. 2018, 1, 601. doi: 10.1038/s41929-018-0111-8.
- [4] J. C. Sacchettini, C. D. Poulter, Science 1997, 277, 1788. doi: 10.1126/science.277.5333.1788.
- [5] D. C. Hyatt, P. Natl. Acad. Sci. USA 2007, 104, 5360. doi: 10.1073/pnas.0700915104.
- [6] Y. Gao, R. B. Honzatko, R. J. Peters, Nat. Prod. Rep. 2012, 29, 1153. doi: 10.1039/C2NP20059G.
- [7] W. C. Chang, H. Song, H. W. Liu, P. Liu, Curr. Opin. Chem. Biol. 2013, 17, 571. doi: 10.1016/j.cbpa.2013.06.020.
- [8] T. Nishimura, Y. Ebe, T. Hayashi, J. Am. Chem. Soc. 2013, 135, 2092. doi: 10.1021/ja311968d.
- [9] T. Nishimura, M. Nagamoto, Y. Ebe, T. Hayashi, Chem. Sci. 2013, 4, 4499. doi: 10.1021/ja311968d.
- [10] G. J. P. Perry, T. Jia, D. J. Procter, ACS Catal. 2019, 10, 1485. doi: 10.1021/acscatal.9b04767.
- [11] E. J. Smutny, J. Am. Chem. Soc. 1967, 89, 6793. doi: 10.1021/ja01001a089.
- [12] N. D. Clement, K. J. Cavell, Angew. Chem. Int. Ed. 2004, 43, 3845. doi: 10.1002/anie.200454166.
- [13] Y. Nakao, N. Kashihara, K. S. Kanyiva, T. Hiyama, Angew. Chem. Int. Ed. 2010, 49, 4451. doi: 10.1002/anie.201001470.
- [14] W. C. Shih, Org. Lett. 2012, 14, 2046. doi: 10.1021/ol300570f.
- [15] Y. X. Wang, J. Am. Chem. Soc. 2018, 140, 5360. doi: 10.1021/jacs.8b02547.
- [16] J. Diesel, D. Grosheva, S. Kodama, N. Cramer, Angew. Chem. Int. Ed. 2019, 58, 11044. doi: 10.1021/jacs.8b02547.
- [17] J. Loup, V. Muller, D. Ghorai, L. Ackermann, Angew. Chem. Int. Ed. 2019, 58, 1749. doi: 10.1002/anie.201813191.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载
















No comments yet.