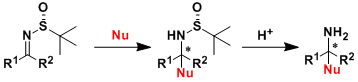
本文作者:杉杉
导读
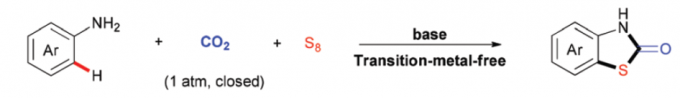
在绿色化学中,将两种非反应活性的起始原料同时应用于一步反应,具有极高的挑战性。近期,四川大学余达刚与成都大学张振课题组在Green Chem.中发表论文,首次报道了将惰性的硫与二氧化碳同时应用于多组分反应。成功完成一系列具有合成应用价值的噻唑烷-2-酮(thiazolidin-2-ones)以及1,3-噻嗪-2-酮(1,3-thiazinan-2-ones)砌块的构建。反应过程中无需过渡金属催化剂的参与。同时,这一全新的方法学具有广泛的底物适用范围、良好的官能团兼容性以及高度的原子经济性等优点。
Transition-metal-free synthesis of thiazolidin-2-ones and 1,3-thiazinan-2-ones from arylamines,elemental sulfur and CO2
C.Ran, L.Song, Y. Niu, Mi. Wei, Z. Zhang, X. Zhou, D. Yu, Green Chem. ASAP DOI: 1039/d0gc03723k.
正文
绿色化学目前已经成为有机合成化学的重要研究方向之一。其中,CO2作为一种含量丰富、应用范围广泛,并且无毒性的气体,将其作为C1源(C1 source),能够构建起一系列具有较高应用价值的合成砌块。然而,由于CO2具有较高的热力学稳定性与动力学惰性,进而使该分子在有机合成中的进一步应用面临巨大挑战,尽管通过CO2构建一系列重要的含羰基杂环化合物已有文献报道。近年来,基于“CO2 = CO + [O]”的概念,C-H键与CO2之间的羰基化已经成为构建各类含羰基杂环化合物的一种十分高效并具有广阔前景的策略。
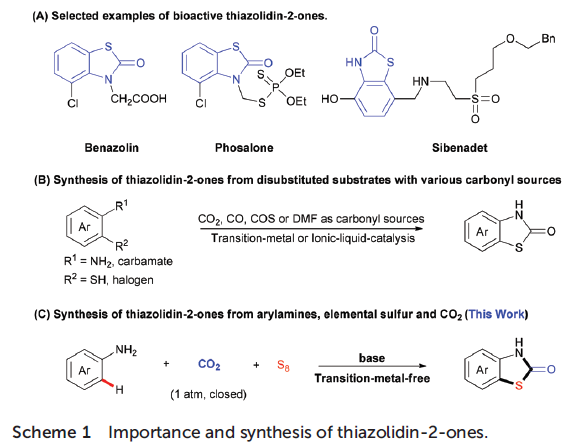
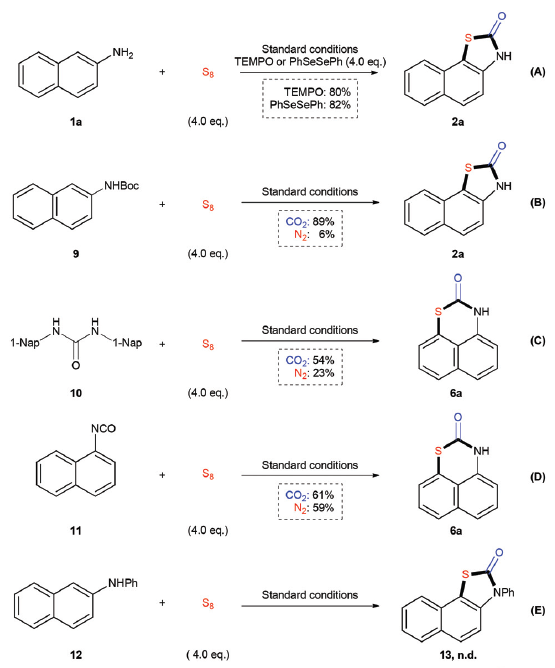
噻唑烷-2-酮作为重要结构组成单元,广泛存在于各类药物分子、农用化学品以及一系列天然产物分子中(Scheme 1A)。因此,开发一种能够应用于噻唑-2-酮衍生物选择性合成的有效策略尤为重要。近年来,选用各种羰基源(例如CO2、CO、DMF等)合成噻唑烷-2-酮化合物的研究已有诸多文献报道[1]。然而,多数报道中,底物范围仅限于带有两种官能团(如卤素、含硫基团)的芳烃(Scheme 1B)。而采用单官能团底物(例如芳胺)与二氧化碳以及硫源构建噻唑-2-酮分子的策略未有文献报道。这里,作者设想选用无毒、稳定、廉价且易于处理的单质硫(S8)作为硫源,并与芳基胺与CO2进行相应的三组分反应,进而获得一系列噻唑烷-2-酮衍生物。然而,这种设想同样存在巨大的挑战。首先,由于C-H键与S8的活性较低,通过C-H键硫化(C–H bond sulfuration)形成C-S键的反应有效性较差。此外,CO2的分子的动力学惰性同样能够进一步阻碍羰基化反应的进行。因此,这三种反应组分较低的低反应活性,可能需要较为苛刻的反应条件,从而使反应过程的化学与区域选择性难以控制。例如可能发生二硫化或多硫化而非单硫化,或可能产生其他羰基化产物(如脲等)。这里,作者受到前期通过二氧化碳构建含羰基杂环分子的相关方法学研究的启发,最终成功开发出一种在无过渡金属催化剂的条件下,通过芳胺、S8以及CO2(1 atm)之间的三组分反应,顺利完成一系列噻唑烷-2-酮化合物的构建(Scheme 1C)。
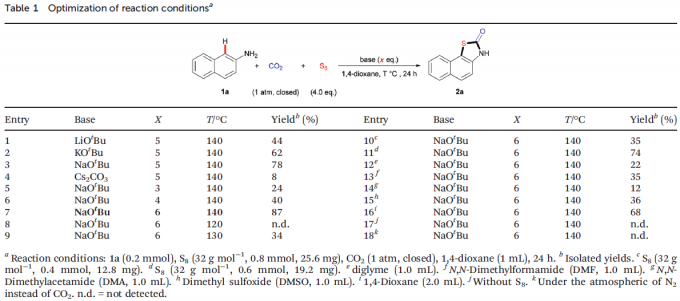
首先,作者以2-氨基萘1a、S8以及CO2作为模型底物,进行相关反应条件的优化筛选(Table 1)。研究表明最佳的反应条件为:NaOtBu作为碱,1,4-二氧六环作为溶剂,在140℃下反应24小时。最终,获得87%的收率的目标产物2a。
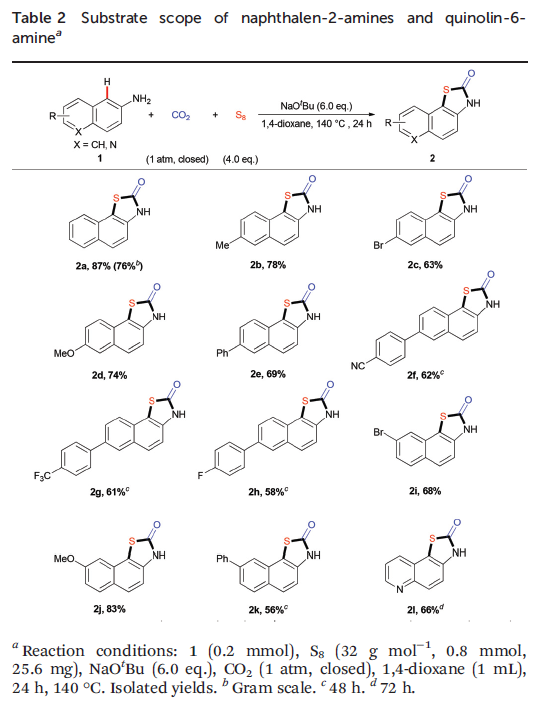
在获得上述最佳反应条件之后,作者开始考察底物1的应用范围(Table 2)。实验表明,各种取代的2-氨基萘底物1a–k均能够较好地参与上述三组分反应,获得相应的产物2a–2k。值得注意的是,将1a的用量增大至克级规模,同样可以获得76%收率的产物2a。同时,6-氨基喹啉以及稠合芳胺(例如2-氨基蒽3)同样能够与上述反应条件良好地兼容,并获得产物2l与4。
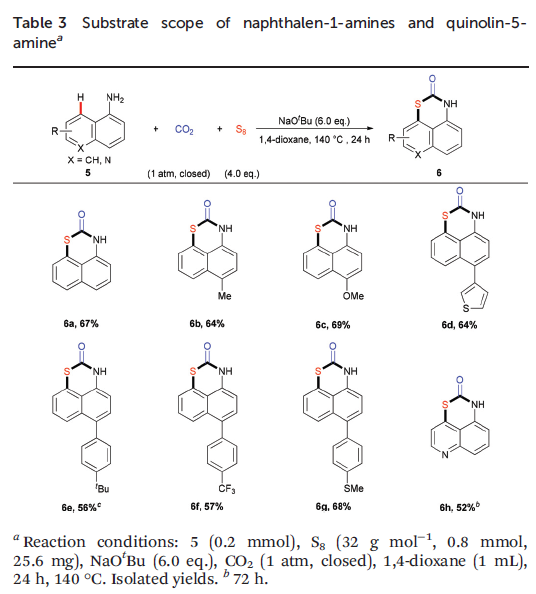
除2-氨基萘(1)以外,1-氨基萘(5)同样可以顺利完成上述反应,以中等至良好的收率获得相应的噻嗪酮产物6a–6h(Table 3)。有趣的是,底物5的硫化反应能够区域选择性地在C8位发生,进而获得一系列具有六元环稠合的1,3-噻嗪-2-酮化合物。
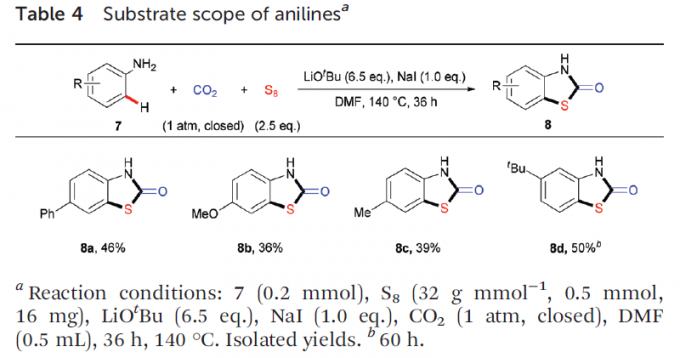
此外,该小组对上述反应条件进行进一步优化,研究发现:采用叔丁醇锂作为碱,加入碘化钠,在DMF溶剂中,将反应温度维持140℃下,能够将底物范围扩展至反应活性较低的部分苯胺底物7,并获得中等收率的杂环产物8a–8d(Table 4)。值得注意的是,邻位取代的苯胺由于存在显著的立体位阻,因而反应活性较差,反应收率偏低。
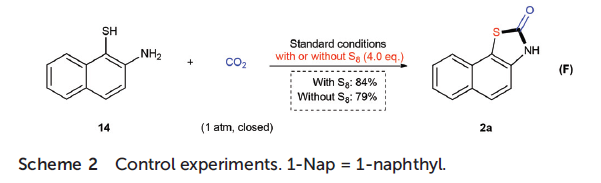
为了进一步阐明反应机理,作者进行一系列相关的控制实验(Scheme 2)。首先,作者发现,向反应体系中加入自由基捕获剂TEMPO或PhSeSePh时,对反应产物及其收率基本无影响。这表明该反应并未涉及单电子转移过程(Scheme 2A)。同时,在相关的反应混合物中,作者能够检测到氨基甲酸酯与尿素副产物的存在。接下来,作者选择萘-2-基氨基甲酸叔丁酯(9)、1,3-二(萘-1-基)脲(10)以及1-异氰基萘(11)作为起始反应物,在CO2或N2气氛以及上述最佳条件下进行反应,最终观察到这类反应物均能够转化为相应目标产物。然而,在N2气氛下,9与10的反应收率偏低,这表明氨基甲酸酯与尿素并非后续硫化过程的关键中间体(Scheme 2B-2D)。此外,作者进一步发现,在标准反应条件下,N-苯基萘-2-胺(12)无法转化为13(Scheme 2E)。综上实验结果,作者推测反应过程中,可能通过动力学活性更高的异氰酸酯中间体,进而获得最终目标产物。随后,该课题组选用2-氨基萘-1-硫醇(14)作为反应底物,在加入S8与未加入的S8情况下进行上述转化,实验发现这两种情况下,均能够以良好的反应收率获得相应预期产物2a(Scheme 2F)。因此,作者推测异氰酸酯的形成以及后续的环化过程可能更有利于相应目标产物的生成。
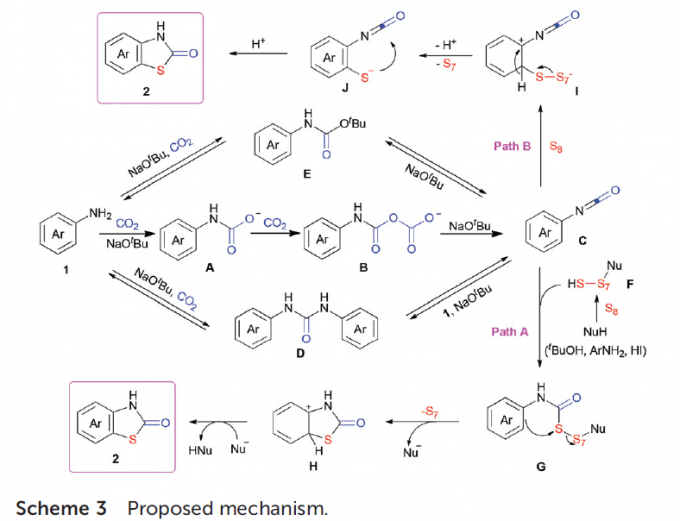
根据上述的实验结果与前期的文献报道[2],作者提出可能的反应机理(Scheme 3)。首先,芳胺1在NaOtBu存在下,与两分子的CO2反应,产生异氰酸酯C,同时形成中间体A与B以及副产物NaHCO3与HOtBu。而副产物D与E可能通过1或异氰酸酯C在二氧化碳或叔丁醇钠存在下产生,并进一步分解,形成1或C。接下来,通过亲核试剂对硫单质的亲核进攻,使S8发生开环,形成中间体F。 Path A中,通过F对异氰酸酯C的亲核进攻,生成中间体G,并通过G的分子内硫化成环过程,产生中间体H,最后,再经过去质子化与再芳构化过程,从而获得相应目标产物2。此外,Path B过程同样合理,即中间体C与S8反应,形成中间体I,进而通过I的去质子化过程,形成芳基硫负离子J,再经分子环化与后续的质子化过程,获得目标产物2。
总结:四川大学余达刚与成都大学张振课题组报道了首例无需过渡金属与额外的氧化剂参与,参与动力学惰性的S8与CO2作为反应物,与芳胺进行相应的三组分反应方法学,从而合成一系列具有合成应用价值的噻唑烷酮与噻嗪酮衍生物。该方法学具有起始原料易得且应用范围广泛以及优良的的官能团兼容性等优点。同时,反应机理研究表明,异氰酸酯为反应的关键中间体。
参考文献
[1] (a) Y. Wan, M. Alterman, M. Larhed, A. Hallberg, J. Org.Chem. 2002, 67, 6232. (b) X. Wu, A. K. Mahalingam, Y. Wan, M. Alterman, Tetrahedron Lett. 2004, 45, 4635. (c) L. Troisi, C. Granito, S. Perrone, F. Rosato, Tetrahedron Lett. 2011, 52, 4330. (d) S. Ding, N. Jiao, Angew. Chem., Int. Ed. 2012, 51, 9226. (e) B. Yu, H. Zhang, Y. Zhao, S. Chen, J. Xu, L. Hao, Z. Liu, ACS Catal. 2013, 3, 2076. (f ) Y. Jing, R. Liu,Y. Lin and X. Zhou, Sci. China: Chem. 2014, 57, 1117. (g) B. Zhou, H. Hong, H. Wang, T. Zhang, L. Han, N. Zhu, Eur. J. Org. Chem. 2018, 6983. [2] (a) S. Wang, P. Shao, G. Du, C. Xi, J. Org. Chem. 2016, 81, 6672. (b) Z. Zhang, X.-Y. Zhou, J.-G.Wu, L. Song, D.-G. Yu, Green Chem. 2020, 22, 28. (c) H. Xu, H. Deng, Z. Li, H. Xiang, X. Zhou, Eur. J. Org.Chem. 2013, 7054. (d) X. Che, J. Jiang, F. Xiao, H. Huang, G.-J. Deng, Org. Lett. 2017, 19, 4576.


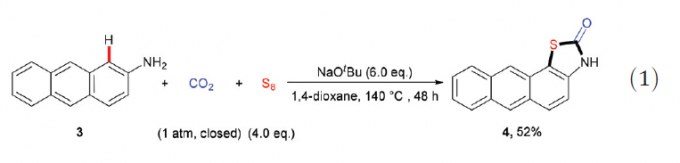















No comments yet.