本文作者:杉杉
导读
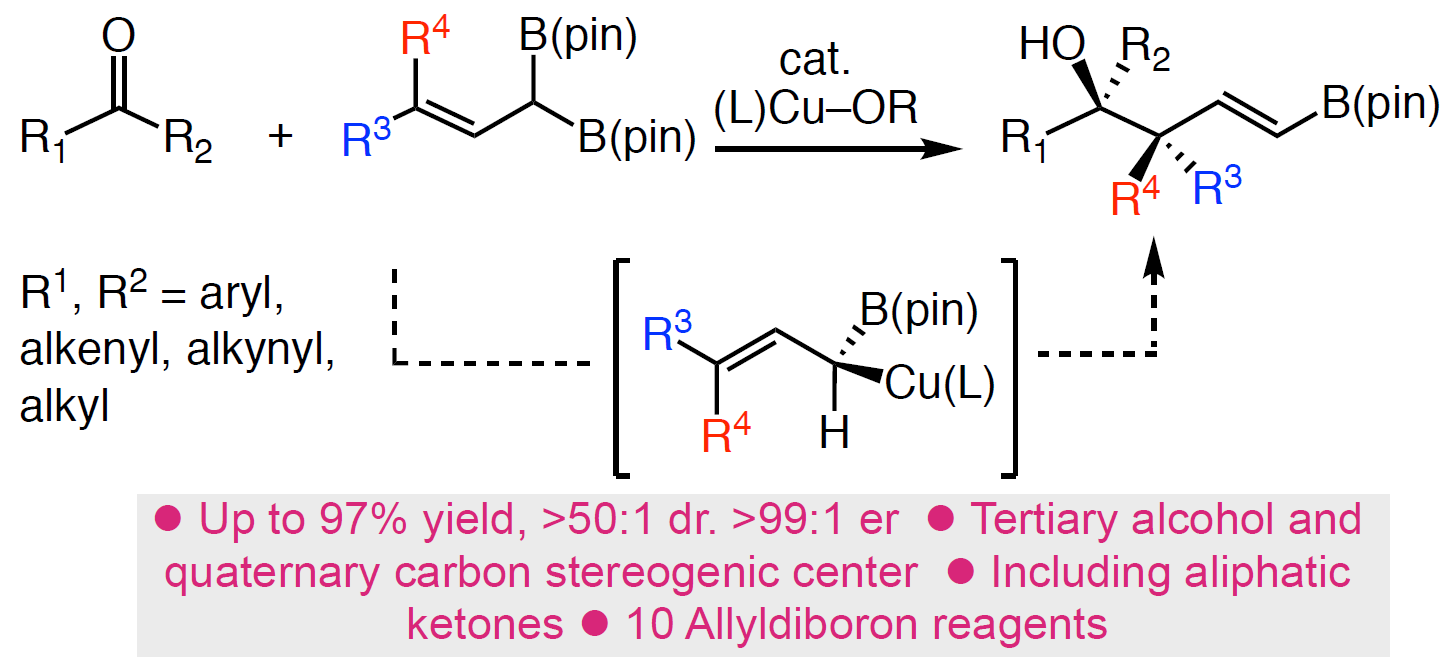
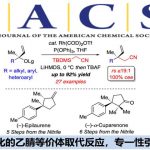
近日,美国北卡罗来纳大学教堂山分校Simon John Meek团队在德国应化杂志发表论文,通过亚磷酰胺铜配体作为催化剂,实现多种酮和烯丙基1,1-二硼酸酯试剂的(非)对映选择性合成(高收率、高dr和高er),获得具有相邻的季碳立体中心的复杂高烯丙醇衍生物。此外,合成的烯基硼酸酯化合物可进一步修饰获得各类具有价值的分子骨架。
Cu‐Catalyzed Diastereo‐ and Enantioselective Reactions of γ,γ‐Disubstituted Allyldiborons with Ketones
Joseph M Zanghi and Simon John Meek,
Angew. Chem. Int. Ed. ASAP DOI:10.1002/anie.202000675
正文
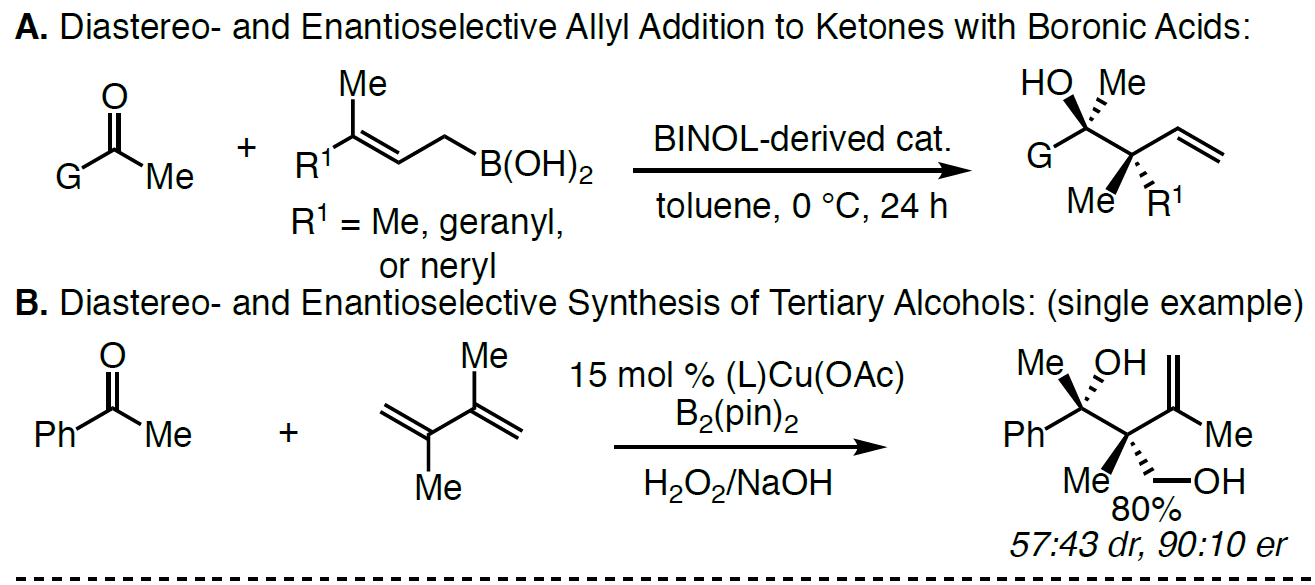
季碳立体中心和叔醇作为许多生物活性分子中常见的骨架,通过对映选择性的制备(尤其是无环体系)作为有机合成中常见的反应过程。尽管如此,通过催化对映选择性方案,构建新的C-C键从而同时引入上述两个官能团的过程,仍具有重大的挑战。为此,如果将适当取代的烯丙基亲核试剂以(非)对映体选择性加成至酮中,即可一步合成该类骨架。通过催化对映选择性的方式合成含有邻三级碳立体中心的烯丙基醇已被大量报道。相反,酮的反应性低和羰基取代基的大小更接近均等,从而阻碍了季碳立体中心的构建。然而,酮和烯丙基亲核试剂经对映选择性加成获得具有季碳立体中心的产物也已被报道。此外,Szabó课题组作为第一个报道了通过γ,γ-二取代的烯丙基硼酸与乙酰酮在手性联萘基的二醇催化下,合成具有季碳立体中心的烯丙醇衍生物(Scheme 1A)。近期,也有文献报道在铜催化下可实现二烯与苯乙酮的偶联,获得邻季碳立体中心的产物(Scheme 1B)。但这些方法常常使用不稳定的硼酸或存在烯丙基硼酸酯副产物等缺点。
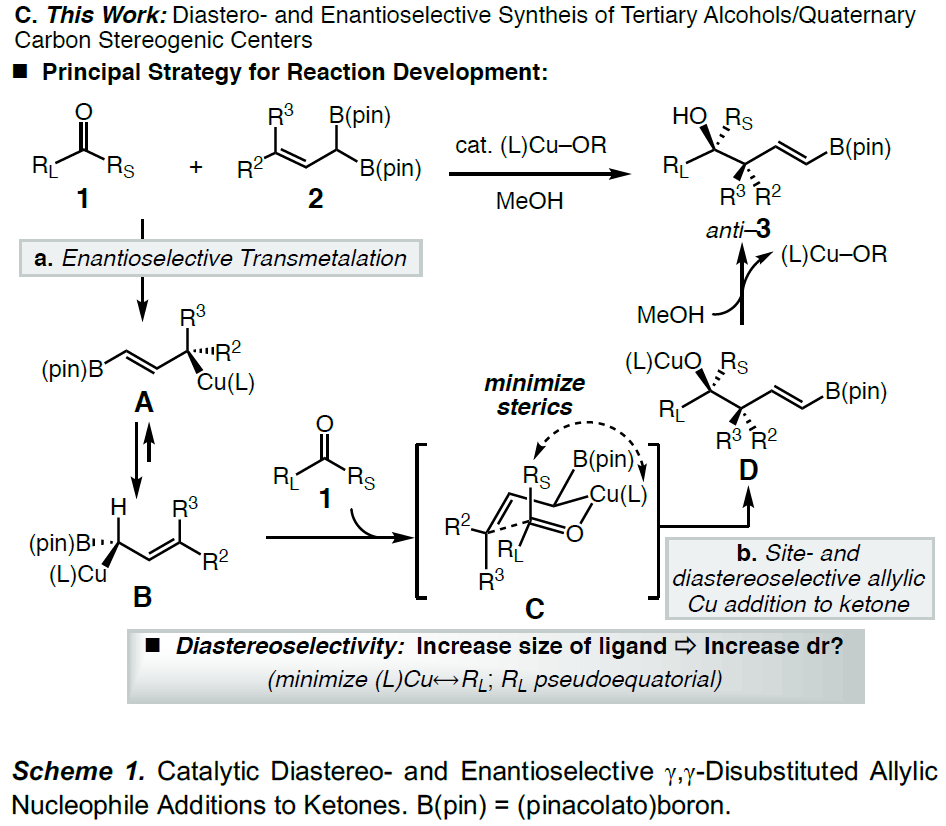
为了解决上述的问题,作者开发一种通用的催化烯丙基亲核试剂立体选择性加成策略, 用于合成邻位含有叔醇的季碳中心的产物(Scheme 1C),该方法集中在催化剂控制的γ,γ-二取代的烯丙基二硼酸酯(可用于醇和胺的对映选择性合成)与酮的1,2-加成反应上。在这方面,作者设想了催化反应,首先是在原位生成的(L)-Cu-OMe与烯丙基二硼之间进行对映选择性SE2’金属迁移过程形成四元烯丙基铜中间体A,A经快速的表面转移,从而获得空间较小并且能量更高的α-硼基-Cu物种B,紧接着再与酮反应获得中间体C,再经旋转和迁移获得最稳定的D,最后在甲醇中再生(L)-Cu-OMe,同时获得目标产物。
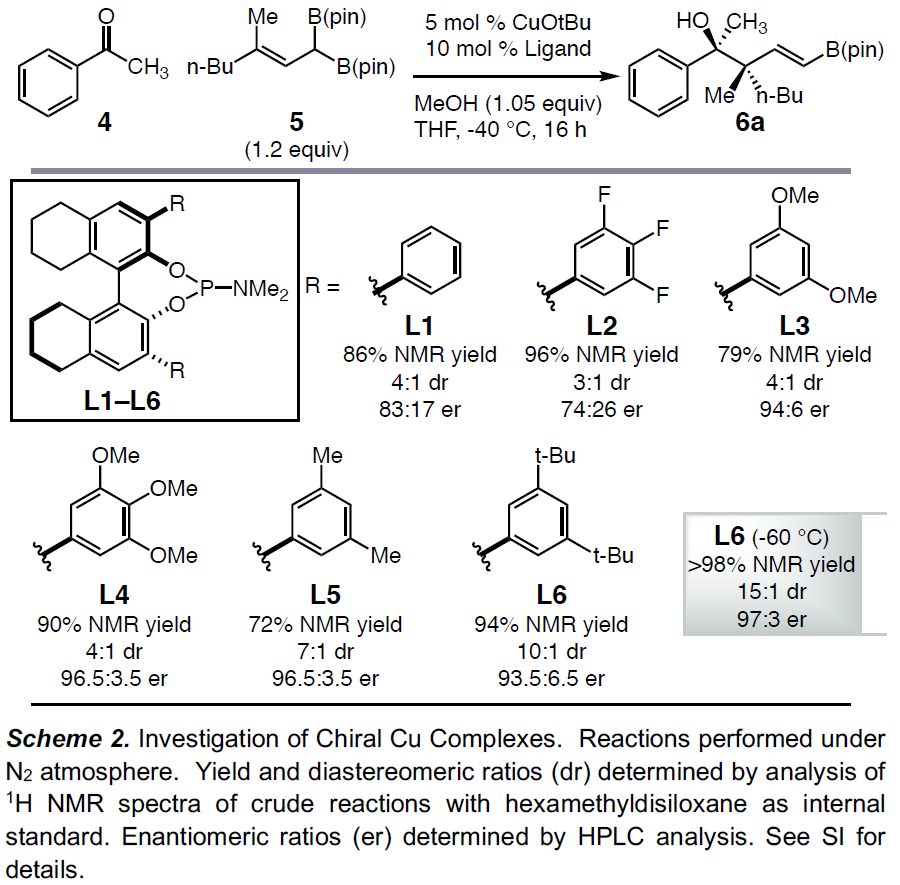
首先,作者以苯乙酮4与烯丙基二硼化合物5作为模型底物,进行相关条件的筛选(Scheme 2)。当使用5.0 mol%CuOtBu作为催化剂,10 mol%H8-联萘衍生的L1作为配体,在1.05当量MeOH的THF溶液-40℃下反应16h,获得预期的目标产物6a,NMR收率为86%,dr为4:1,er为83:17。如果在3,3’位置上改用位阻更大芳基配体L2–L5时,产物6a的dr(4:1→7:1)和er(83:17→96.5:3.5)均进一步增加。当使用含有3,5-t-BuC6H3取代基的亚磷酰胺L6时,可将非对映选择性进一步提高至10:1 dr。此外,将反应温度冷却至-60℃,从而获得NMR产率>98%,dr为15:1,er为97:3 的产物6a。
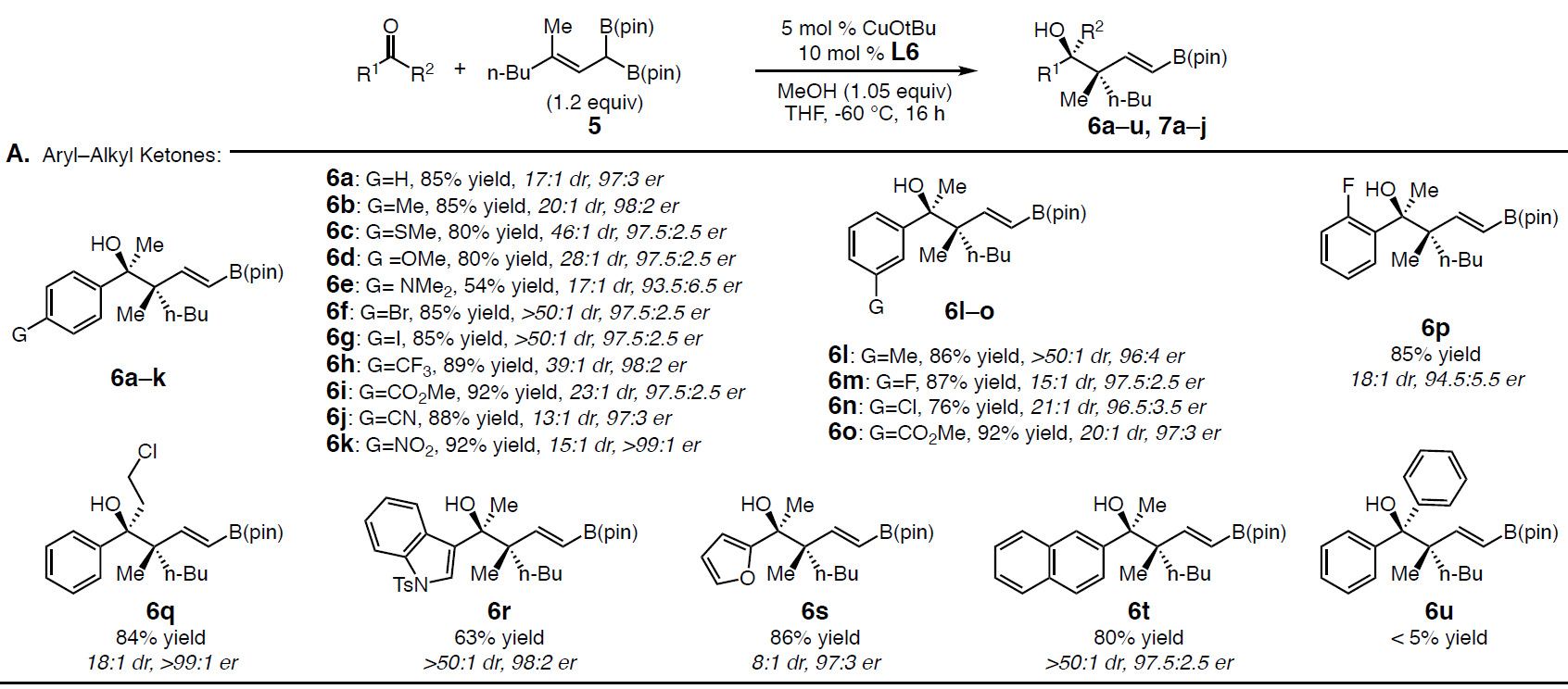
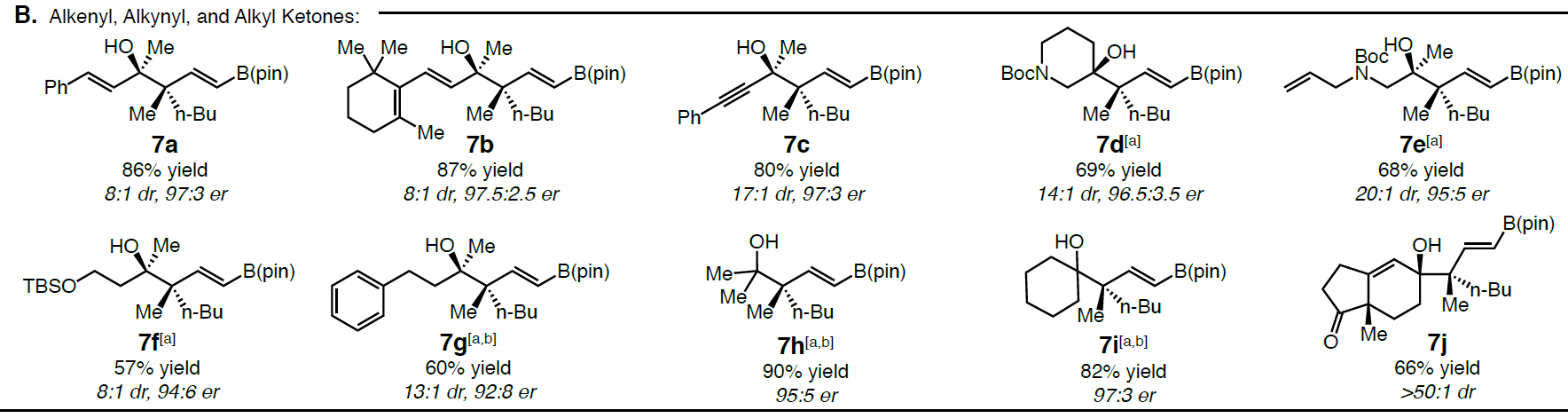
在获得上述最佳反应条件后,作者开始对底物酮进行了扩展(Scheme 3)。首先作者对多种芳基和杂芳基取代的酮进行了相关的验证(Scheme 3A)。当带有给电子基团(6b–6e)和吸电子基团(6f–6k)的芳基酮,包括间位(6l–6o)和邻位(6p)取代基的芳基酮等,均可取得较好的结果。此外,芳基酮产物6q具有高收率和高选择性,从而表明反应可耐受伯烷基氯化物。杂芳基和萘酮也是有效的底物(6r–6t),但未保护的吲哚无法获得目标产物。尽管芳基酮的范围不受电子效应和定位效应的影响,但空间位阻对于反应影响较大,如大多数邻位取代基(如o-Me)或二芳基酮(如二苯甲酮)(如6u)不参与反应,仅获得微量的产物。随后,作者继续将酮的底物扩展到了烯酮(7a–7b)、炔酮(7c)以及环状(7d)和非环状烷基酮(7e–7g)等(Scheme 3B)。在N-Boc酰胺和甲硅烷基醚存在的条件下,均可获得良好收率和立体选择性的7d–7f。同时,可将催化方案扩展至对称的二烷基酮,如丙酮(er为95:5)和环己酮(er 为97:3),获得产物7h–7i。而与手性酮的反应同样也以高水平的非对映选择性进行,如在标准催化条件下添加(S)-Hajos-Parrish到反应中可获得单一非对映异构体(dr>50:1)的7j,同时对烯酮的化学选择性高于脂族酮。
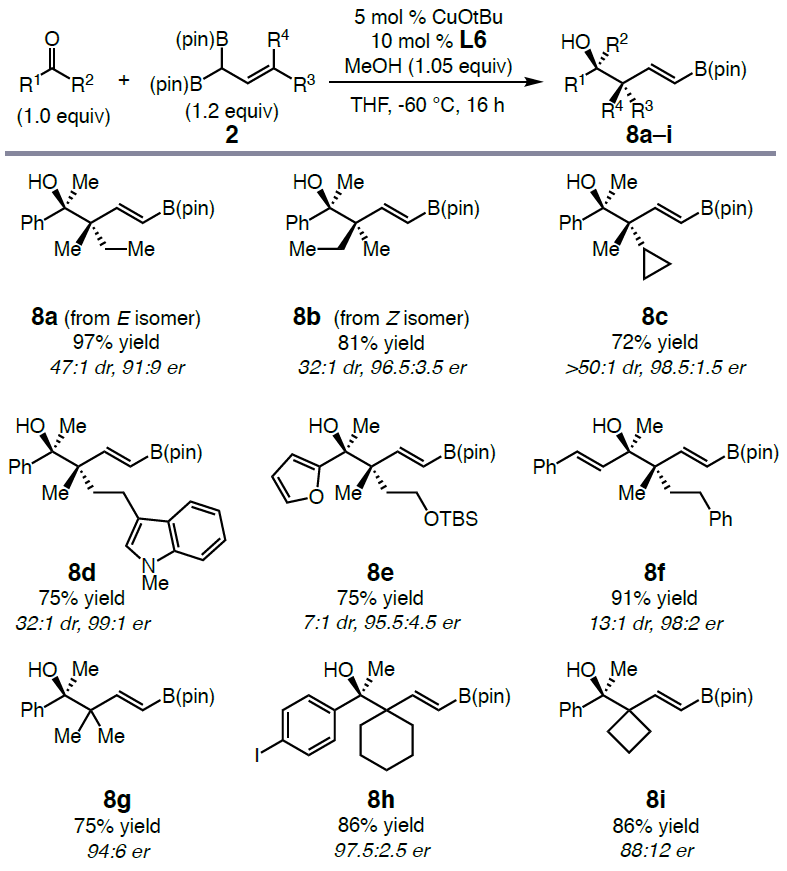
随后,作者也对烯丙基二硼试剂底物的范围在进行了相关的扩展(Scheme 4)。可通过E-和Z-烯丙基二硼试剂选择性地形成相应构型的产物8a(dr为 47:1,er 为91:9)和8b(dr为32:1,er为96.5:3.5)。此外,可以构建多种季碳立体中心,如环丙基(8c)、N-杂芳基(8d)、甲硅烷基醚(8e)、苄基(8f)等,并且收率>71%,dr>7:1和er>95.5:4.5。同时对称的γ,γ-二取代的烯丙基二硼酸酯也可形成含季碳中心的手性叔醇,如二甲基(8g)、环己烷(8h)和环丁烷(8i)取代基的叔醇形成,产率>75%,er为88:12→97.5:2.5。
Scheme 4. Variation of Allyl 1,1-Diboronate Scope.
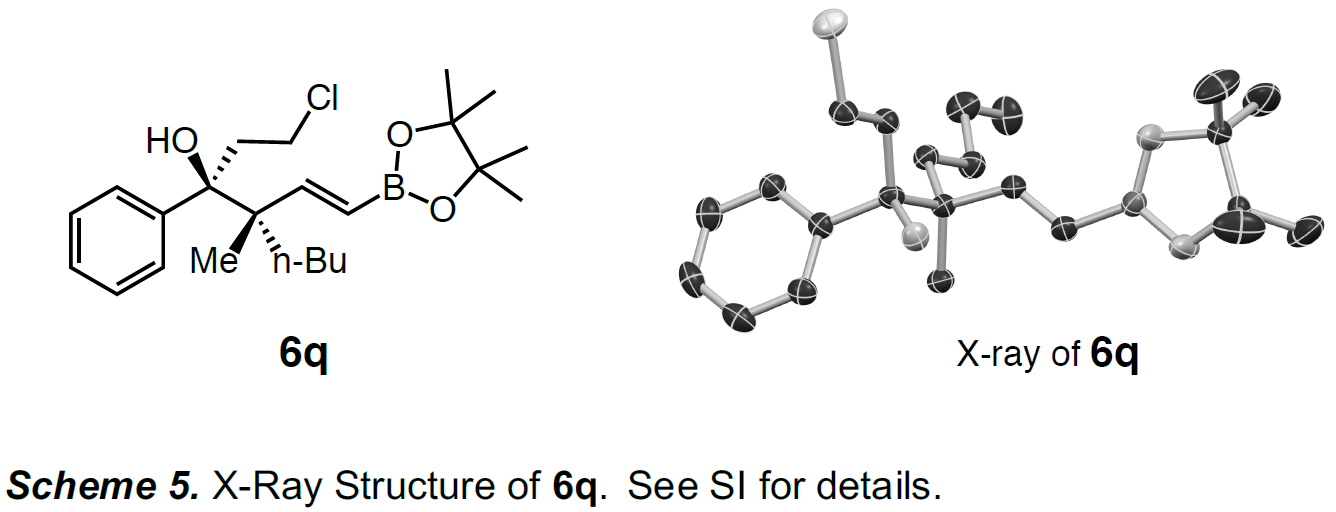
产物的相对和绝对构型的立体化学,作者也通过晶体的培养获得1q的单晶,并通过X-射线衍射确定了产物的最终构型(Scheme 5)。如所预期一致,羟基和正丁基取代基处于反式,对应的酮取代基位于假平伏键上。
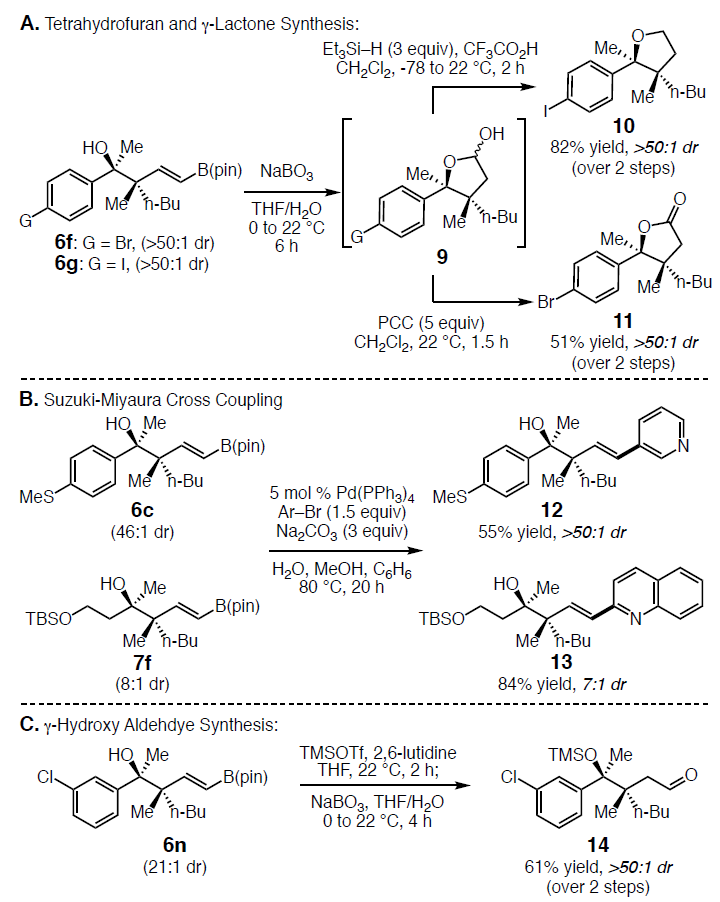
随后,作者继续对产物进行了相关的后期修饰,以便获得更具价值的化合物(Scheme 6)。首先,将6f和6g经NaBO3•4H2O处理导致C-B氧化获得相应的半缩醛(9),如果将其用三氟乙酸和三乙基硅烷对9进行脱羟基反应,获得82%产率的四氢呋喃化合物10,如果用PCC氧化经两步反应获得51%产率的内酯11。此外,获得的产物很适合Suzuki-Miyaura交叉偶联反应(Scheme 6B),如与芳基6c和烷基酮7f衍生的烯基硼产物,均可经过Pd催化发生偶联反应,获得N-杂芳烃的产物12(收率55%)和13(收率84%)。同时,可通过两步反应制备脂族醛(Scheme 6C),先将6n中的羟基用 TMSOTf和2,6-二甲基吡啶进行保护,然后用NaBO3•4H2O进行C-B键氧化,即可获得β-季碳醛14(收率61%)。
Scheme 6. Synthetic Utility of Alkenyl Boronate Products.
总结
美国北卡罗来纳大学教堂山分校Meek Simon John团队报道一种实用、高效的铜催化体系,可实现酮和烯丙基1,1-二硼酸酯试剂的(非)对映选择性反应(高收率、高dr和高er),获得具有相邻季碳立体中心的复杂的高烯丙醇衍生物。该反应具有广泛的底物范围,可耐受各种芳基、杂芳基、烯基、炔基和烷基酮以及各类烯丙基二硼试剂等。此外,合成的烯基硼酸酯产物可进一步修饰,获得多种更具价值的分子骨架。
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!






















No comments yet.